Непрерывная ректификация



 1. ЛИТЕРАТУРНЫЙ ОБЗОР
1. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1. Теоретические основы разрабатываемого процесса
![]() 1.1.1. Общие сведения о процессе ректификация
1.1.1. Общие сведения о процессе ректификация
Ректификация представляет собой процесс многократного частичного испарения жидкости и конденсации паров. Процесс осуществляется путем контакта потоков пара и жидкости, имеющих различную температуру, и проводится обычно в колонных аппаратах. При каждом контакте из жидкости испаряется преимущественно легколетучий, или низкокипящий, компонент (НК), которым обогащаются пары, а из паров конденсируется преимущественно труднолетучий, или высококипящий, компонент (ВК), переходящий в жидкость. Такой двухсторонний обмен компонентами, повторяемый многократно, позволяет получить в конечном счете пары, представляющие собой почти чистый НК. Эти пары после конденсации в отдельном аппарате образуют дистиллят (ректификат) и флегму – жидкость, возвращаемую для орошения колонны и взаимодействия с поднимающимися парами. Пары получают путем частичного испарения снизу колонны остатка, являющегося почти чистым ВК.
Как отмечалось, достаточно высокая степень разделения однородных жидких смесей на компоненты может быть достигнута путем ректификации. Сущность процессов, из которых складывается ректификация, и получаемые при этом результаты можно проследить с помощью t — х — у -диаграммы (рис. 1.1).
Нагрев исходную смесь состава х1до температуры кипения получим находящийся в равновесии с жидкостью пар (точка b). Отбор и конденсация этого пара дают жидкость состава x2обогащенную НК (х2 > х1).Нагрев эту жидкость до температуры кипения t2, получим пар (точка d),конденсация которого дает жидкость с еще большим содержанием НК, имеющую состав ха, и т. д. Проводя таким образом последовательно ряд процессов испарения жидкости и конденсации паров, можно получить в итоге жидкость (дистиллят), представляющую собой практически чистый НК.
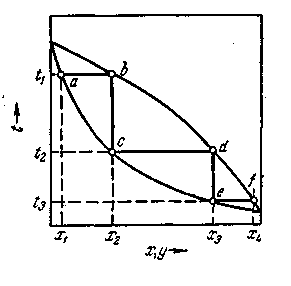
Рис. 1.1. Изображение процесса разделения бинарной смеси путем ректификации на диаграмме t—Х—у.
Аналогично, исходя из паровой фазы, соответствующей составу жидкости x4, путем проведения ряда последовательных процессов конденсации и испарения можно получить жидкость (остаток), состоящую почти целиком из ВК.
В простейшем виде процесс многократного испарения можно осуществить в многоступенчатой установке, в первой ступени которой испаряется исходная смесь. На вторую ступень поступает на испарение жидкость, оставшаяся после отделения паров в первой ступени, в третьей ступени испаряется жидкость, поступившая из второй ступени (после отбора из последней паров) и т. д. Аналогично может быть организован процесс многократной конденсации, при котором на каждую следующую ступень поступают для конденсации пары, оставшиеся после отделения от них жидкости (конденсата) в предыдущей ступени.
При достаточно большом числе ступеней таким путем можно получить жидкую или паровую фазу с достаточно высокой концентрацией компонента, которым она обогащается. Однако выход этой фазы будет мал по отношению к ее количеству в исходной смеси. Кроме того, описанные установки отличаются громоздкостью и большими потерями тепла в окружающую среду.
Значительно более экономичное, полное и четкое разделение смесей на компоненты достигается в процессах ректификации, проводимых обычно в более компактных аппаратах — ректификационных колоннах.
Процесс ректификации осуществляется путем многократного контакта между неравновесными жидкой и паровой фазами, движущимися относительно друг друга.
При взаимодействии фаз между ними происходит массо- и теплообмен, обусловленные стремлением системы к состоянию равновесия. В результате каждого контакта компоненты перераспределяются между фазами: пар несколько обогащается НК, а жидкость — ВК. Многократное контактирование приводит к практически полному разделению исходной смеси.
Таким образом, отсутствие равновесия (и соответственно наличие разности температур фаз) при движении фаз с определенной относительной скоростью и многократном их контактировании являются необходимыми условиями проведения ректификации.
1.1.2. Равновесие в системах жидкость-пар
В общем случае жидкая смесь может состоять из нескольких компонентов. В простейшем случае из двух, например из компонентов А и В. Характер поведения жидкой смеси зависит главным образом от природы составляющих ее веществ и давления.
Для идеальных растворов характерно то, что сила взаимодействия между всеми молекулами (одноименными и разноименными) равна. При этом общая сила, с которой молекула удерживается в смеси, не зависит от состава смеси. Очевидно, что парциальное давление в этом случае должно зависеть лишь от числа молекул, достигающих в единицу времени поверхности жидкости со скоростью, необходимой для преодоления сил внутреннего притяжения молекул, т. е. при данной температуре давление соответствующего компонента возрастает пропорционально его содержанию в жидкой смеси (закон Рауля):
рА = РАхА (1.1) и рВ = РВ(1-хА) (1.2.)
Закон Рауля справедлив и для газов с температурой ниже критической(т. е. такой температуры, выше которой газ при увеличении давления не сжижается).
По степени растворимости компонентов смеси жидкости подразделяют на взаиморастворимые в любых соотношениях, частично растворимые и практически взаимонерастворимые. В свою очередь смеси со взаиморастворимыми компонентами в любых соотношениях делятся на: идеальные растворы, которые подчиняются закону Рауля; так называемые нормальные растворы - жидкие смеси, частично отклоняющиеся от закона Рауля, но не образующие смесей: с постоянной температурой кипения (азеотропов)неидеальные растворы - жидкости со значительными отклонениями от закона Рауля, в том числе смеси с постоянной температурой кипения (азеотропы). (Отметим, что полностью взаимонерастворимых жидкостей нет, обычно все жидкости хотя бы в незначительных количествах, но растворяются друг в друге. Однако в этих случаях на практике для удобства принимают такие жидкости взаимонерастворимыми.)
Смесь двух жидкостей, взаиморастворимых в любых соотношениях, представляет собой систему, состоящую из двух фаз и двух компонентов, и по правилу фаз:
С=К-Ф+2=2-2+2=2 (1.3.)
имеет две степени свободы (из трех - давления Р, температуры t, концентрации х). Однако при анализе и расчете процессов перегонки жидкостей одну из переменных обычно закрепляют и строят диаграмму фаз в плоской системе координат. При этом возможны следующие варианты фазовых диаграмм: Р — t (х = const), Р — — x(t = const), t — х(Р = const).
Для технических расчетов наиболее важной является диаграмма t — х, у, так как обычно процессы перегонки в промышленных аппаратах протекают при Р = const, т. е. в изобарных условиях. На этой диаграмме (рис. 5.2.) по оси абсцисс отложены концентрации жидкой х и паровой у фаз, отвечающие различным температурам.
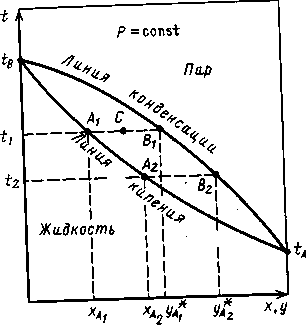
Рис. 1.2. Фазовая диаграмма t — х, у
По закону Дальтона рА = Рy*A, и тогда
y*A= pA/P=(PA/P) xA, (1.4.)
но
Р = pA+pB=PAxA+PB(1-xB)=PB+(PA-PB)xA (1.5.)
тогда
xA=(P-PB)/(PA-PB) (1.6.)
По уравнению (1.6.)) по известным РАи РBпри заданной температуре t1 , t2и т.д. находят хA , хBи т.д., а затем по уравнению (1.4.) -соответствующие значения у*A1 , у*А2и т.д. и по найденным точкам строят линии кипения жидкости (кривая tAA2A1tB) и конденсации паров (кривая tAB2BltB). Отметим, что уравнение (1.6.) устанавливает связь между концентрациями (по жидкости) и заданными давлениями (общим Р и насыщенных паров РАи РB). Отрезки А1В1 , А2 В2и т. д., соединяющие точки равновесных составов жидкой и паровой фаз, являются изотермами.
Отметим, что точки, лежащие на кривой tAA2A1tB,, отвечают жидкой фазе, находящейся при температуре кипения. Очевидно, что любая точка, лежащая ниже этой кривой, характеризует систему, состоящую только из жидкой фазы. Аналогично, любая точка лежащая выше кривой tAB2 В1tB , характеризует систему, темпера тура которой выше температуры начала конденсации пара, т. е пары в этой точке являются перегретыми, и система состоит только из паровой фазы. Точки, находящиеся между кривыми кипения и конденсации (например, точка С на рис. 1.2.), характеризуют системы, температуры которых выше температуры кипения жидкости данного состава и ниже температуры конденсации паров этого же состава. Таким образом, эти точки отвечают равновесным парожидкостным системам.
Основные положения фазового равновесия были рассмотрены в гл. 2 (правило фаз Гиббса, законы Генри и Рауля и др.). Там же для идеальных бинарных систем получено уравнение (1.7.), которое описывает линию равновесия:
у*А = ахА/(1+хА(а-1)), (1.7.)
где а = РА/РВ - относительная летучесть компонента А (иногда а называют коэффициентом разделения).
Очевидно, что для смеси, состоящей из n компонентов, например, А, В, С, D, на основе законов Рауля и Дальтона имеем
yA = (РA/Р)хA; yB = (РB/Р)хB; yC = (РC/Р)хC; yD = (РD/Р)хD. (1.8.)
Поскольку
P=PAxA+ PBxB+ PCxC+ PDxD+ …=![]() (1.9.)
(1.9.)
то для любого j-го компонента
yj = PjXj/![]() . (1.10.)
. (1.10.)
Разделив числитель и знаменатель правой части уравнения (1.10) на величину РА, получим
yj = аjXj/![]() , (1.11.)
, (1.11.)
где аA = РА/РВ ; ав = РВ/РА ; аC = РС/РА и т. д.
Например, зависимость давления насыщенного пара от температуры хорошо описывается эмпирическим уравнением Антуана
lnРА = А - В/(Т+ C), (1.12.)
где А - постоянная, не зависящая от температуры; В и С -константы, определяемые по справочникам; T- абсолютная температура.
Уравнение (5.12) описывает температурную зависимость давлений паров в интервале температур до нескольких десятков градусов и при давлениях, не слишком близких к критическим.
Взаимное положение кривых на фазовых диаграммах t — х — у и у — х как для идеальных, так и для реальных систем могут быть определены с помощью законов Коновалова. Законы Коновалова устанавливают связи между изменениями состава, давления или температуры в двухфазных системах, они лежат в основе теории перегонки и ректификации бинарных смесей.
Первый - закон Коновалова формулируется так: пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается ее температура кипения, или пар всегда более обогащен НК, чем соответствующая ему равновесная жидкая фаза.
Первый закон Коновалова дополняется первым правилом Вревского, отражающим влияние температуры на равновесные составы фаз: при повышении температуры бинарной смеси в парах возрастает относительное содержание того компонента, парциальная молярная теплота испарения которого больше.
Это можно проиллюстрировать с помощью фазовой диаграммы (рис. 1.2.). Для идеальной смеси очевидно, что при одной и той же температуре t содержание НК в парах у*A1 (точка B1 больше его содержания ха в равновесной с парами жидкости (точка А1). При добавлении к смеси НК ее температура кипения снижается, но содержание НК в паре остается выше, чем в жидкости.
Реальные жидкие смеси могут значительно отклоняться от закона Рауля. Если зависимость полного давления (или сумма парциальных давлений) паров от состава жидкой смеси проходит выше линий, характеризующих те же зависимости для идеальных смесей (рис. 1.3.), то такое отклонение называют положительным, если ниже - отрицательным отклонением от закона Рауля. Эти отклонения определяются изменением активности молекул в растворе, диссоциацией, гидратацией и др. Степень отклонения реальной системы от закона Рауля выражают величиной коэффициента активности ![]() :
:
pA = PAxA![]() . (1.13.)
. (1.13.)
Для смесей с положительным отклонением от закона Рауля![]() > 1, для смесей с отрицательным отклонением —
> 1, для смесей с отрицательным отклонением — ![]() < 1. Отметим, что определение значений у часто затруднительно, поэтому диаграммы P — х обычно строят по экспериментальным (справочным) данным.
< 1. Отметим, что определение значений у часто затруднительно, поэтому диаграммы P — х обычно строят по экспериментальным (справочным) данным.
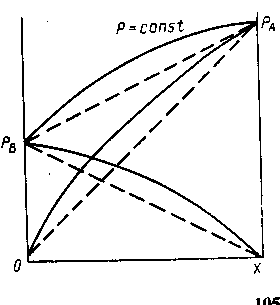
![]()
Рис. 1.3. Диаграмма р — х для смеси с положительным отклонением от закона Рауля (пунктиром показаны соответствующие линии для идеального раствора)
Для многих реальных смесей отклонение от закона Рауля настолько существенно, что приводит к качественно новому состоянию системы, а на фазовых диаграммах Р — х и t — х появляются (рис. 1.4.,б, в) относительный максимум или минимум. При этом кривые жидкости и пара соприкасаются друг с другом в экстремальных точках, в которых составы равновесных фаз одинаковы. Такие смеси, как известно, называют азеотропными, или азеотропами. Их основная особенность состоит в том, что при испарении такая смесь (азеотроп) не изменяет своего состава, поэтому для ее разделения требуются специальные методы (азеотропная и экстрактивная ректификация, изменение давления и др.).
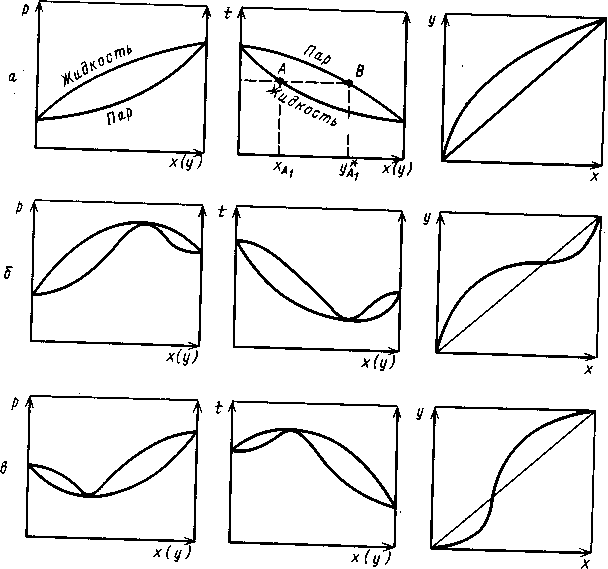
Рис. 1.4. Фазовые диаграммы равновесия жидкость-пар для идеальной (а) и реаль- ных (б, в) систем
Эта особенность азеотропных смесей постулируется вторым законом Коновалова, который можно сформулировать следующим образом: если давление и температура сосуществования двух бинарных фаз имеют экстремум (максимум или минимум), то составы фаз одинаковы. Это справедливо для фаз любой природы. Для систем жидкость - пар второй закон Коновалова определяет основное свойство азеотропов.
При изменении внешних условий - температуры (или давления) значение а изменяется различно по разные стороны от точки азеотропа; одна часть «рыбки» (рис.1.4., б, в) должна становиться шире, другая - уже. Очевидно, что в части диаграммы, где в паре содержится больше, чем в растворе, компонента с меньшей теплотой испарения, при понижении температуры (давления), а увеличивается.
5.1.3. Материальный и тепловой балансы ректификационной колонны
Пусть, согласно схеме на рис. (1.5.), в колонну поступает Fкмоль исходной смеси, состав которой хFмол. долей НК. Сверху из колонны удаляется Gкмоль паров, образующих после конденсации флегму и дистиллят. Количество получаемого дистиллята Р кмоль, его состав хPмол. долей НК. На орошение колонны возвращается флегма в количестве Ф кмоль, причем ее состав равен составу дистиллята (хф= xPмол. долей). Снизу из колонны удаляется Wкмоль остатка состава xwмол. долей НК.
Тогда уравнение материального баланса колоны будет:
Ф+F = G+W. (1.14)
Поскольку G=P+Ф, то
F = P+W. (1.15.)
Соответственно по НК материальный баланс:
FxF = PxP+WxW (1.16.)
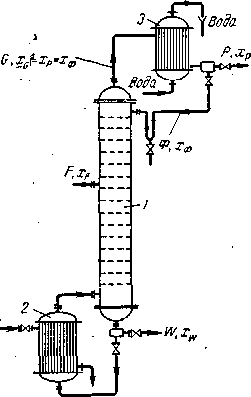
Рис. 1.5. К составлению материального баланса ректификационной колонны:
/ — колонна; 2 — куб; 3 — дефлегматор.
Для колонны непрерывного действия с учетом потерь тепла в окружающую среду имеем:
Приход тепла Расход тепла
С теплоносителем в кипя- С парами, поступающими из
тальнике .……… QКИП.. колонны в дефлегматор QG= GI
С исходной смесью……….QF=FiFС остатком………………… QW =Wiw
С флегмой ................. . QФ = ФiФПотери в окружающую среду QП
Кроме известных величин, в выражения для количеств тепла входят: I, iF, iфи iw— энтальпии соответственно паров, выходящих из колонны, исходной смеси, флегмы и остатка.
Таким образом, уравнение теплового баланса:
Qкип + QF + QФ = QG + QW + QП . (1.17.)
Подставляя вместо Qих значения и учитывая, что F=Р +W, G = P(R+ 1) и Ф = PR, получим
Qкип + (Р + W)iF + РRiФ = P(R+\)I + WiW + QП(1.18.)
Решая уравнение (5.18.) относительно Qкип, находим расход тепла в кипятильнике
Qкип = Р(I – iF) + PR( I -iФ) + W(iW - iF) + QП ( 1.18а. )
Из уравнения теплового баланса (5.18а.) видно, что тепло, подводимое в кипятильник, затрачивается на испарение дистиллята (Р(I—iF)),испарение флегмы (PR(I — iф)), нагревание остатка до температуры кипения (W(iw — iF)), а также на компенсацию потерь тепла в окружающую среду.
Флегма из дефлегматора поступает в колонну при температуре ее кипения. Поэтому энтальпия выходящих из колонны паров I == iФ + rф, где rф — теплота испарения флегмы.
Потери тепла в окружающую среду обычно выражают в долях тепла, подводимого в кипятильник, т. е. принимают QП = aПQкип, где при наличии хорошей тепловой изоляции коэффициент аП = 0,03—0,05.
Делая соответствующие подстановки в уравнение (1.18а.), окончательно получим
QКИП=(P(I– iF) + PRrФ + W(iW - iF)) / (1-aП) (1.19.)
Энтальпии жидкостей, входящих в уравнение (1.18.) и (1.19.), равны произведениям их мольных теплоемкостей с на температуры t (в °С). Теплоемкости с и теплоты испарения для бинарных смесей вычисляют по правилу аддитивности исходя из свойств чистых компонентов А и В:
с = сАх+сВ(1—х)
r = rАх+rВ(1—х)
где х — мольная доля компонента А в смеси.
Количество тепла QДЕФ, отнимаемого охлаждающей водой в дефлегматоре, зависит от количества конденсирующихся в нем паров. При полной конденсации паров, выходящих из колонны, находим
QДЕФ = P(R+1)rФ = P(R+1)(I-iФ) (1.20.)
Уравнения рабочих линий. Для получения уравнений рабочих линий воспользуемся общим для всех массообменных процессов уравнением ():
y=![]() , (1.21)
, (1.21)
где L и G— расходы жидкой и паровой фаз; у, х, уаи хк—соответственно текущие концентрации паровой и жидкой фаз и их концентрации на верхнем конце колонны .
Применяя это уравнение к процессу ректификации, выразим все входящие в него величины в мольных единицах.
Укрепляющая часть колонны. Количество жидкости (флегмы), стекающей по этой части колонны
L = Ф = PR, (1.22)
где R=![]() -флегмовое число, представляющее собой отношение количества флегмы к количеству дистиллята.
-флегмовое число, представляющее собой отношение количества флегмы к количеству дистиллята.
Количество паров, поднимающихся по колонне
G=P+Ф=P+PR=P(R+1), (1.23)
Для верхнего конца укрепляющей части колонны состав паров yG=yPи, согласно принятому выше допущению, ур= хр. Следовательно, в данном случае ун= хр.
В том же сечении колонны состав жидкости (флегмы), поступающей из дефлегматора, xф= хр, т. е. хк = хр. Учитывая значения L, G, ykи хk получаем уравнение (1.24), получим
y=![]() (1.24)
(1.24)
откуда
y=![]() (1.25)
(1.25)
Зависимость (1.24) является уравнением рабочей линии укреплящей части колонны. В этом уравнении ![]() = tg а = А — тангенс угла наклона рабочей линии к оси абсцисс, а
= tg а = А — тангенс угла наклона рабочей линии к оси абсцисс, а ![]() =В — отрезок, отсекаемый рабочей линией на оси ординат диаграммы у — х (рис. 1.6).
=В — отрезок, отсекаемый рабочей линией на оси ординат диаграммы у — х (рис. 1.6).
Исчерпывающая часть колонны. Количество орошающей жидкости L' в этом части колонны больше количества флегмы Ф, стекающей по укрепляющей части на количество исходной смеси, поступающей на питающую тарелку. Если обозначить количество питания, приходящегося на 1 кмоль дистиллята через f= F/P, то F = Pfи количество жидкости, стекающей по исчерпывающей части колонны, составит:
L = Ф + F = PR + Pf = P (R + I) (1.26)
Количество пара, проходящего через нижнюю часть колонны, равно количеству пара, поднимающегося по верхней (укрепляющей) ее части. Следовательно
G’=G=P(R+1)
Для низа колонны состав удаляющейся жидкости (остатка) х'к = xwи, согласно допущению, состав поступающего сюда из кипятильника пара у’н=yw =xw .Подставив значения L', G', х’к и у’н в общее уравнение , получим
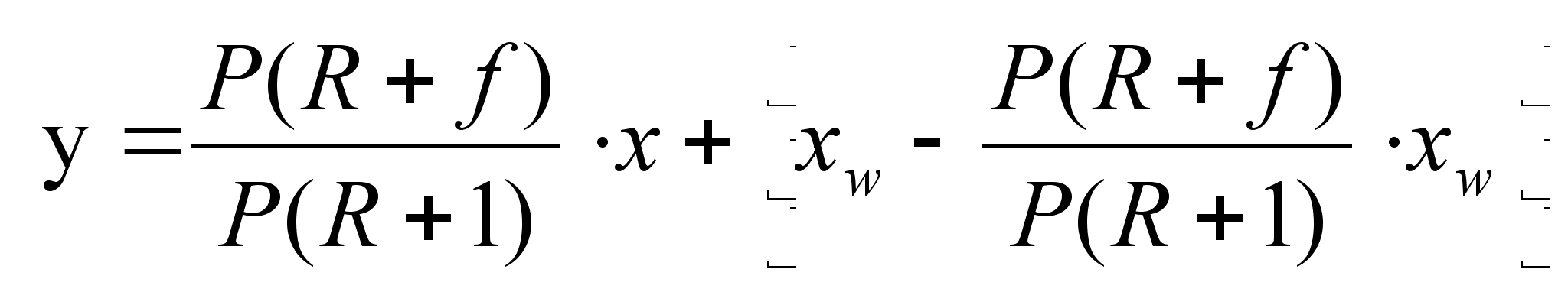 (1.27)
(1.27)
После приведения к общему знаменателю и сокращения подобных членов находим:
![]() (1.28)
(1.28)
Зависимость (1.25) представляет собой уравнение рабочей линии исчерпывающей части колонны. В этом уравнении ![]() = tg a' = А' —тангенс угла наклона рабочей линии к оси ординат, а
= tg a' = А' —тангенс угла наклона рабочей линии к оси ординат, а ![]() = В' — отрезок, отсекаемый рабочей линией на оси абсцисс (см. рис.1.6).
= В' — отрезок, отсекаемый рабочей линией на оси абсцисс (см. рис.1.6).
Умножив числитель и знаменатель выражений для А' и А (для укрепляющей части колонны) на количество дистиллята Р, можно заметить, что они представляют собой отношения количеств жидкой и паровой фаз, или удельный расход жидкости, орошающей данную часть колонны.
Построение рабочих линий на диаграмме у — х. Для построения рабочих линиоткладывают на оси абсцисс диаграммы (см. рис. 1.6) заданные составы жидкостей xw, xfи хр. Учитывая принятые допущения о равенстве составов пара и жидкости на концах колонны, из точки х восстанавливают вертикаль до пересечения с диагональю диаграммы в точке а с координатами ур= хр.
Величину Rсчитаем известной. Откладывая на оси ординат отрезок
В=![]() , соединяют прямой конец отрезка (точку d) с точкой а. Из точки, отвечающей заданному составу хf, проводят вертикаль до пересечения с линией adв точке . Прямая а— рабочая линия укрепляющей части колонны. Согласно допущению yw = xw ,из точки, соответствующей составу xw , восстанавливают вертикаль до пересечения с диагональю диаграммы и получают точку с — конечную точку рабочей линии исчерпывающей части колонны. Соединяют точку с прямой с точкой , принадлежащей одновременно рабочим линиям укрепляющей и исчерпывающей частей колонны. Прямая bcпредставляет собой рабочую линию исчерпывающей части колонны.
, соединяют прямой конец отрезка (точку d) с точкой а. Из точки, отвечающей заданному составу хf, проводят вертикаль до пересечения с линией adв точке . Прямая а— рабочая линия укрепляющей части колонны. Согласно допущению yw = xw ,из точки, соответствующей составу xw , восстанавливают вертикаль до пересечения с диагональю диаграммы и получают точку с — конечную точку рабочей линии исчерпывающей части колонны. Соединяют точку с прямой с точкой , принадлежащей одновременно рабочим линиям укрепляющей и исчерпывающей частей колонны. Прямая bcпредставляет собой рабочую линию исчерпывающей части колонны.
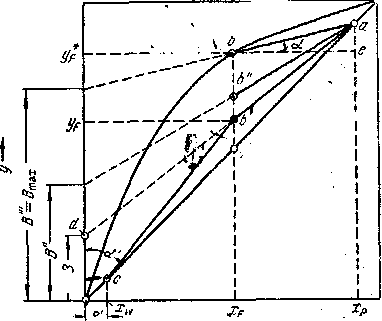
Рис. 1.6 Построение рабочих линий ректификационной колонны на у—x диаграмме.
Рабочие линии abи bcв отличие от рабочих линий процесса абсорбции располагаются под линией равновесия. В данном случае, как уже отмечалось, НК переходит в паровую фазу, стремящуюся к равновесию с жидкой фазой, т. е. по существу десорбируется из жидкости.
1.2. Основные технологические схемы для проведения разрабатываемого процесса
Процессы ректификации осуществляются периодически или непрерывно при различных давлениях: при атмосферном давлении, под вакуумом (для разделения смесей высококипящих веществ), а также под давлением больше атмосферного (для разделения смесей, являющихся газообразными при нормальных температурах).
1.2.1. Непрерывная ректификация
Рассмотрим, как реализуются указанные выше условия в ректификационных колоннах непрерывного действия (рис. 1.7.), которые наиболее широко применяются в промышленности.
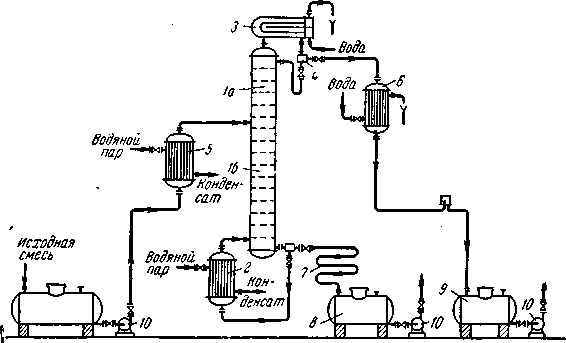
Рис.1.7. Схема непрерывно действующей ректификационной установки:
1— ректификационная колонна (а — укрепляющая часть, б — исчерпывающая часть); 2 —кипятильник; 3 — дефлегматор; 4 — делитель флегмы; 5 — подогреватель исходной смеси;6 — холодильник дистиллята (или холодильник-конденсатор); 7 — холодильник остатка (или нижнего продукта); 8, 9 сборники; 10 — насосы.
Ректификационная колонна 1 имеет цилиндрический корпус, внутри которого установлены контактные устройства в виде тарелок или насадки. Снизу вверх по колонне движутся пары, поступающие в нижнюю часть аппарата из кипятильника 2, который находится вне колонны, т. е. является выносным (как показано на рисунке 1.7.), либо размещается непосредственно под колонной. Следовательно, с помощью кипятильника создается восходящий поток пара. Пары проходят через слой жидкости на нижней тарелке, которую будем считать первой, ведя нумерацию тарелок условно снизу вверх.
Пусть концентрация жидкости на первой тарелке равна х1(по низкокипящему компоненту), а ее температура t1. В результате взаимодействия между жидкостью и паром, имеющим более высокую температуру, жидкость частично испаряется, причем в пар переходит преимущественно НК. Поэтому на следующую (вторую) тарелку поступает пар с содержанием НК у1> х1.
Испарение жидкости на тарелке происходит за счет тепла конденсации пара. Из пара конденсируется и переходит в жидкость преимущественно ВК, содержание которого в поступающем на тарелку паре выше равновесного с составом жидкости на тарелке. При равенстве теплот испарения компонентов бинарной смеси для испарения 1 мольНК необходимо сконденсировать 1 моль ВК, т. е. фазы на тарелке обмениваются эквимолекулярными количествами компонентов.
На второй тарелке жидкость имеет состав x2, содержит больше НК, чем на первой (х2> x1), и соответственно кипит при более низкой температуре (t2
Таким образом пар, представляющий собой на выходе из кипятильника почти чистый ВК, по мере движения вверх все более обогащается низкокипящим компонентом и покидает верхнюю тарелку колонны в виде почти чистого НК, который практически полностью переходит в паровую фазу на пути пара от кипятильника до верха колонны.
Пары конденсируются в дефлегматоре 3, охлаждаемом водой, и получаемая жидкость разделяется в делителе 4 на дистиллят и флегму, которая направляется на верхнюю тарелку колонны. Следовательно, с помощью - дефлегматора в колонне создается нисходящий поток жидкости.
Жидкость, поступающая на орошение колонны (флегма), представляет собой почти чистый НК. Однако, стекая по колонне и взаимодействуя с паром, жидкость все более обогащается ВК, конденсирующимся из пара. Когда жидкость достигает нижней тарелки, она становится практически чистым ВК и поступает в кипятильник, обогреваемый глухим паром, или другим теплоносителем.
На некотором расстоянии от верха колонны к жидкости из дефлегматора присоединяется исходная смесь, которая поступает на так называемую питающую тарелку колонны. Для того чтобы уменьшить тепловую нагрузку кипятильника, исходную смесь обычно предварительно нагревают в подогревателе 5 до температуры кипения жидкости на питающей тарелке.
Питающая тарелка как бы делит колонну на две части, имеющие различное назначение. В верхней части 1а (от питающей до верхней тарелки) должно быть обеспечено возможно большее укрепление паров, т. е. обогащение их НК с тем, чтобы в дефлегматор направлялись пары, близкие по составу к чистому НК. Поэтому данная часть колонны называется укрепляющей. В нижней части 1б(от питающей до нижней тарелки) необходимо в максимальной степени удалить из жидкости НК, т. е. исчерпать жидкость для того, чтобы в кипятильник стекала жидкость, близкая по составу к чистому ВК. Соответственно эта часть колонны называется исчерпывающей.
В дефлегматоре 3 могут быть сконденсированы либо все пары, поступающие из колонны, либо только часть их соответствующая количеству возвращаемой в колонну флегмы. В первом случае часть конденсата, остающаяся после отделения флегмы, представляет собой дистиллят (ректификат), или верхний продукт, который после охлаждения в холодильнике 6 направляется в сборник дистиллята 9. Во втором случае несконденсированные в дефлегматоре пары одновременно конденсируются и охлаждаются в холодильнике 6, который при таком варианте работы служит конденсатором-холодильником дистиллята.
Жидкость, выходящая из низа колонны (близкая по составу ВК) также делится на две части. Одна часть, как указывалось, направляется в кипятильник, а другая — остаток (нижний продукт) после охлаждения водой в холодильнике 7 направляется в сборник 8.
На рис. (1.7.) приведена лишь принципиальная схема непрерывно-действующей ректификационной установки. Такие установки оснащаются необходимыми контрольно-измерительными и регулирующими приборами, позволяющими автоматизировать их работу и проводить процесс с помощью программного управления в оптимальных условиях.
1.2.2. Периодическая ректификация
Периодически действующие ректификационные установки применяют, как правило, для разделения жидких смесей в тех случаях, когда использование непрерывнодействующих установок нецелесообразно. Обычно это характерно для технологических процессов, в которых количества подлежащих разделению смесей невелики и требуется определенное время для накопления этих продуктов перед разделением или в условиях часто меняющегося состава исходной смеси. Последний случай специфичен для гибких технологических процессов, в которых спектр получаемых продуктов весьма разнообразен.
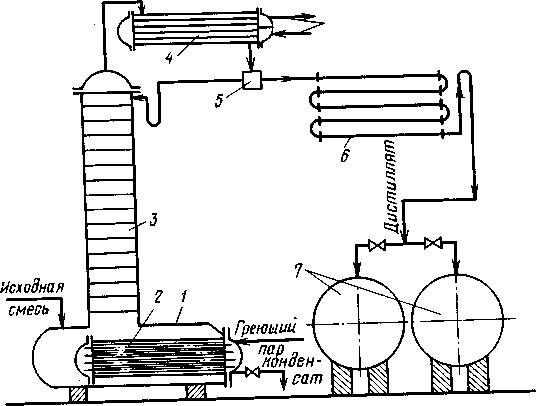
Периодическую ректификацию проводят на установках с практически идентичной принципиальной схемой. Один из возможных вариантов такой установки показан на рис. (1.8.).
Рис. 1.8. Схема установки для проведения периодической ректификации:
1-куб-кипятильник; 2-подогреватель; 3-ректификационная колонна; 4-дефлегматор; 5-делитель потока; 6-холодильник; 7-сборники.
Исходную смесь периодически загружают в куб-кипятильник 1, снабженный подогревателем 2, в который подается теплоноситель, например насыщенный водяной пар. Исходную смесь доводят до кипения. Образующиеся пары поднимаются по колонне 3, в которой происходит противоточное взаимодействие этих паров с жидкостью (флегмой), поступающей из дефлегматора 4. Часть конденсата после делителя потока возвращается в колонну в виде флегмы, другая часть - дистиллят Р - через холодильник 6собирается в сборниках 7 в виде отдельных фракций. Процесс ректификации заканчивают обычно после того, как будет достигнут заданный средний состав дистиллята. Таким образом, колонна 3 является аналогом укрепляющей части колонны непрерывного действия, а куб выполняет роль исчерпывающей части.
Периодическая ректификация может осуществляться двумя способами: 1) при постоянном составе дистиллята (хр = const) и 2) при постоянном флегмовом числе (RP = const).
В первом случае количество флегмы по мере уменьшения содержания легколетучего компонента в кубе должно постепенно возрастать. В промышленных условиях установки для проведения такого процесса необходимо оснащать управляющими автоматизированными системами, способными осуществлять непрерывное и строго программированное изменение питания колонны флегмой и подачи теплоносителя в испаритель (куб колонны). Изменение основных расходных параметров можно проводить, например, по данным о качественном составе легколетучего компонента либо в кубовой жидкости, либо в дистилляте.
1.2.3. Экстрактивная и азеотропная ректификация
Уровень трудности разделения смесей с близкими температурами кипения может быть оценен с помощью коэффициента относительной летучести = РА/РВ. Если значение невелико, то такую смесь можно разделять под вакуумом. Вместе с тем часто экономически целесообразнее в этом случае оказывается использование метода, основанного на введении в разделяемую смесь дополнительного-разделяющего-компонента избирательного действия.
В разделяющем компоненте, который является высококипящим по отношению к одному из двух компонентов исходной смеси, этот последний хорошо растворим, а второй компонент либо нерастворим, либо труднорастворим. Присутствие третьего - разделяющего, или экстрагирующего, - компонента приводит к снижению сил притяжения нерастворимого компонента в растворе к остальным частицам и в результате этого - к увеличению его относительной летучести в системе (рис. 1.9.).
Таким образом, разделяющий агент обладает избирательным действием - повышает давление пара НК в большей степени, чем давление пара ВК. Резкое увеличение облегчает разделение исходных компонентов, но влечет за собой последующий процесс разделения смеси хорошо растворимого и экстрагирующего компонентов, которые удаляются с остатком. Описанный метод разделения называют экстрактивной ректификацией.
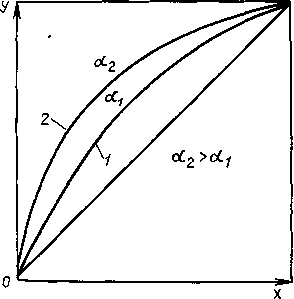
Рис. 1.9. Положение кривой равновесия без добавки (1) и с добавкой (2) разделяющего агента
В отличие от экстрактивной, азеотропная ректификациязаключается в осуществлении процесса в присутствии разделяющего компонента, образующего с компонентами разделяемой смеси один или несколько азеотропов, которые в основном отбираются в виде дистиллята. Схема установки для проведения экстрактивной ректификации представлена на рис. (1.10.).
Исходную смесь, состоящую из компонентов А и В, подают на тарелку питания колонны 7 для экстрактивной ректификации. Несколько выше тарелки питания вводят разделяющий агент С. Низкокипящий компонент отбирают в виде дистиллята, а смесь высококипящего компонента В и разделяющего компонента С из нижней части колонны 1 направляют на разделение в колонну 2. Разделяющий компонент, отбираемый в виде кубового остатка, возвращают на орошение колонны 1.
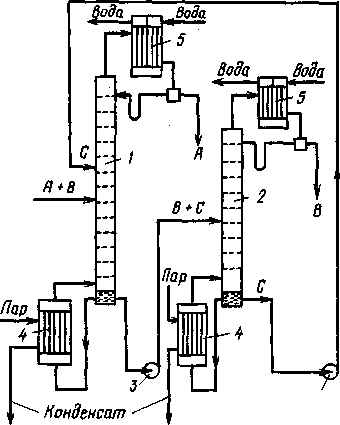
Рис. 1.10. Схема установки для экстрактивной ректификации бинарной смеси
1-колонна для экстрактивной ректификации; 2-колонна для разделения продукта В и экстрагирующего компонента С; 3-насосы; 4-кипятильники; 5-конденсаторы
При азеотропной ректификации (рис. 1.11.) исходную азеотропную смесь подают на тарелку питания колонны, которая орошается сверху разделяющим агентом С. Расход разделяющего агента в основном зависит от состава исходной смеси. Так, при азеотропной ректификации расход разделяющего компонента увеличивается с повышением в исходной смеси концентрации тех компонентов, которые отбираются в дистиллят. При экстрактивной ректификации, наоборот, расход разделяющего компонента возрастает при увеличении в исходной смеси концентрации компонентов, отбираемых в виде кубового остатка.
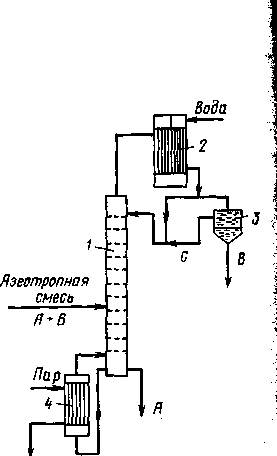
Рис. 1.11. Схема установки для азеотропной ректификации:
1-колонна; 2-конденсатор; 3-отстойник; 4-кип
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Нефть: происхождение, состав, методы и способы переработки
Бурный научно-технический прогресс и высокие темпы развития различных отраслей науки и мирового хозяйства в XIX – XX вв. привели к резкому
- Оборудование для мерсеризации ткани
- Оборудование для ориентации полупроводниковых пластин
- Оборудование производства ИУ
СодержаниеСодержание.............................................................................................. 1Задание....................................................................................................
- Обработка давлением
Глава 4. Введение. Обработка давлением один из основных способов получения заготовок и деталей в приборостроении. Широкое применение з
- Обработка деталей на шлифовальном станке
Министерство образования РФ.НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ.Курсовая работа по предмету “Технология отрасли”
- Обработка материалов электрическим током и лазером
Министерство транспорта РФКостромской автотранспортный техникумСпециальность 1705РефератНа тему:«Обработка материалов электрическим
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

