Методы защиты от коррозии металлов и сплавов
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ МЕТАЛЛОВ И СПЛАВОВ
Основным условием противокоррозийной защиты металлов и сплавов является уменьшение скорости коррозии. Уменьшить скорость коррозии можно, используя различные методы защиты металлических конструкций от коррозии. Основными из них являются:
1 Защитные покрытия.
2 Обработка коррозионной среды с целью снижения коррозионной активности (в особенности при постоянных объемах коррозионных сред).
3 Электрохимическая защита.
4 Разработка и производство новых конструкционных материалов повышенной коррозионной устойчивости.
5 Переход в ряде конструкций от металлических к химически стойким материалам (пластические высокомолекулярные материалы, стекло, керамика и др.).
6 Рациональное конструирование и эксплуатация металлических сооружений и деталей.
1. Защитные покрытия
Защитное покрытие должно быть сплошным, равномерно распределенным по всей поверхности, непроницаемым для окружающей среды, иметь высокую адгезию (прочность сцепления) к металлу, быть твердым и износостойким. Коэффициент теплового расширения должен быть близким к коэффициенту теплового расширения металла защищаемого изделия.
Классификация защитных покрытий представлена на рис. 43

Защитные покрытия

![]() Неметаллические Металлические
Неметаллические Металлические
![]()
![]()
![]() покрытия покрытия
покрытия покрытия
Неорганические Органические Катодные Анодные
![]()
Неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. | Лакокрасочные покрытия, покрытия смолами, покрытия пластмассами, покрытия полимерными пленками, резиной | |
Рисунок 43 - Схема классификации защитных покрытий
1.1 Металлические покрытия
Нанесение защитных металлических покрытий – один из самых распространенных методов борьбы с коррозией. Эти покрытия не только защищают от коррозии, но и придают их поверхности ряд ценных физико-механических свойств: твердость, износоустойчивость, электропроводность, паяемость, отражательную способность, обеспечивают изделиям декоративную отделку и т.д.
По способу защитного действия металлические покрытия делят на катодные и анодные.
Катодные покрытия имеют более положительный, а анодные - более электроотрицательный электродные потенциалы по сравнению с потенциалом металла, на который они нанесены. Так, например, медь, никель, серебро, золото, осажденные на сталь, являются катодными покрытиями, а цинк и кадмий по отношению к этой же стали – анодными покрытиями.
Необходимо отметить, что вид покрытия зависит не только от природы металлов, но и от состава коррозионной среды. Олово по отношению к железу в растворах неорганических кислот и солей играет роль катодного покрытия, а в ряде органических кислот (пищевых консервах) служит анодом. В обычных условиях катодные покрытия защищают металл изделия механически, изолируя его от окружающей среды. Основное требование к катодным покрытиям – беспористость. В противном случае при погружении изделия в электролит или при конденсации на его поверхности тонкой пленки влаги обнаженные (в порах или трещинах) участки основного металла становятся анодами, а поверхность покрытия катодом. В местах несплошностей начнется коррозия основного металла, которая может распространяться под покрытие (рис. 44 а).
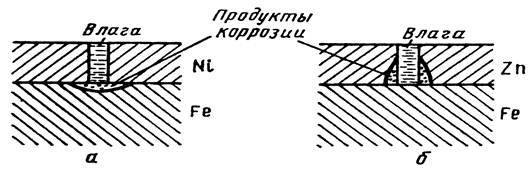
Рисунок 11 Схема коррозии железа с пористым катодным (а) и анодным (б) покрытием
Анодные покрытия защищают металл изделия не только механически, но главным образом электрохимически. В образовавшемся гальваническом элементе металл покрытия становится анодом и подвергается коррозии, а обнаженные (в порах) участки основного металла выполняют роль катодов и не разрушаются, пока сохраняется электрический контакт покрытия с защищаемым металлом и через систему проходит достаточный ток (рис.4 б). Поэтому степень пористости анодных покрытий в отличие от катодных не играет существенной роли.
В отдельных случаях электрохимическая защита может иметь место при нанесении катодных покрытий. Это происходит, если металл покрытия по отношению к изделию является эффективным катодом, а основной металл склонен к пассивации. Возникающая анодная поляризация пассивирует незащищенные (в порах) участки основного металла и затрудняет их разрушение. Такой вид анодной электрохимической защиты проявляется для медных покрытий на сталях 12Х13 и 12Х18Н9Т в растворах серной кислоты.
Основной метод нанесения защитных металлических покрытий – гальванический. Применяют также термодиффузионный и механотермический методы, металлизацию распылением и погружением в расплав.Разберем каждый из методов более подробно.
1.2 Гальванические покрытия.
Гальванический метод осаждения защитных металлических покрытий получил очень широкое распространение в промышленности. По сравнению с другими способами нанесения металлопокрытий он имеет ряд серьезных преимуществ: высокую экономичность (защита металла от коррозии достигается весьма тонкими покрытиями), возможность получения покрытий одного и того же металла с различными механическими свойствами, легкую управляемость процесса (регулирование толщины и свойств металлических осадков путем изменения состава электролита и режима электролиза), возможность получения сплавов разнообразного состава без применения высоких температур, хорошее сцепление с основным металлом и др.
Недостаток гальванического метода – неравномерность толщины покрытия на изделиях сложного профиля.
Электрохимическое осаждение металлов проводят в гальванической ванне постоянного тока (рис 45). Покрываемое металлом изделие завешивают на катод. В качестве анодов используют пластины из осаждаемого металла (растворимые аноды) или из материала, нерастворимого в электролите (нерастворимые аноды).
Обязательный компонент электролита – ион металла, осаждающийся на катоде. В состав электролита могут также входить вещества, повышающие его электропроводность, регулирующие протекание анодного процесса, обеспечивающие постоянство рН, поверхностно-активные вещества, повышающие поляризацию катодного процесса, блескообразующие и выравнивающие добавки и др.
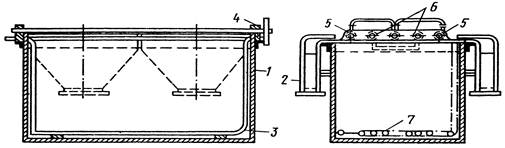
Рисунок 5 Гальваническая ванна для электроосаждения металлов:
1 – корпус; 2 – вентиляционный кожух; 3 – змеевик для обогрева; 4 – изоляторы; 5 – анодные штанги; 6 – катодные штанги; 7 – барботер для перемешивания сжатым воздухом
В зависимости от того, в каком виде ион разряжающегося металла находится в растворе, все электролиты делятся на комплексные и простые. Разряд комплексных ионов на катоде происходит при более высоком перенапряжении, чем разряд простых ионов. Поэтому осадки, полученные из комплексных электролитов, более мелкозернисты и равномерны по толщине. Однако у этих электролитов ниже выход металла по току и более низкие рабочие плотности тока, т.е. по производительности они уступают простым электролитам, в которых ион металла находится в виде простых гидратированных ионов.
Распределение тока по поверхности изделия в гальванической ванне никогда не бывает равномерным. Это приводит к разной скорости осаждения, а следовательно, и толщине покрытия на отдельных участках катода. Особенно сильный разброс по толщине наблюдается на изделиях сложного профиля, что отрицательно сказывается на защитных свойствах покрытия. Равномерность толщины осаждаемого покрытия улучшается с увеличением электропроводности электролита, ростом поляризации с ростом плотности тока, уменьшением выхода металла по току при повышении плотности тока, увеличении расстояния между катодом и анодом.
Способность гальванической ванны давать равномерные по толщине покрытия на рельефной поверхности называется рассеивающей способностью. Наибольшей рассеивающей способностью обладают комплексные электролиты.
Для защиты изделий от коррозии используют гальваническое осаждение многих металлов: цинка, кадмия, никеля, хрома, олова, свинца, золота, серебра и др. Применяют также электролитические сплавы, например Cu – Zn, Cu – Sn, Sn – Bi и многослойные покрытия.
Наиболее эффективно (электрохимически и механически) защищают черные металлы от коррозии анодные покрытия цинком и кадмием.
Цинковые покрытия применяются для защиты от коррозии деталей машин, трубопроводов, стальных листов. Цинк – дешевый и доступный металл. Он защищает основное изделие механическим и электрохимическим способами, так как при наличии пор или оголенных мест происходит разрушение цинка, а стальная основа не корродирует.
Покрытия из цинка занимают доминирующее положение. С помощью цинка защищают от коррозии примерно 20 % всех стальных деталей, и около 50% производимого в мире цинка расходуется на гальванические покрытия.
В последние годы получили развитие работы по созданию защитных гальванических покрытий из сплавов на основе цинка: Zn – Ni (8 – 12% Ni), Zn – Fe, Zn – Co (0,6 – 0,8% Co). При этом удается повысить коррозионную стойкость покрытия в 2-3 раза.
Цинкование проводят в кислых, цианидных и цинкатных электролитах. Осаждение цинка происходит с высоким выходом по току. Цинковые покрытия отличаются высокой степенью чистоты, химической стойкостью и хорошими механическими свойствами.
Применение цианидных электролитов обеспечивает получение более мелкозернистых покрытий. Их используют для обработки деталей сложной формы. Однако эти электролиты экологически опасны. В некоторых случаях цианидные электролиты заменяют на щелочные цинкатные.
Все большее распространение получают цинковые комбинированные электрохимические покрытия (КЭП). Из сульфатного электролита получают КЭП с включениями корунда до 0,4 – 0,5 масс. %. Из цинкатного электролита с порошком карбонильного никеля получают КЭП с содержанием никеля 6 – 12 масс. %. На основе цинка получают также покрытия с частицами полимеров – капрона и полиамида, содержание которых в КЭП 0,9 – 3,1 масс. %. Эти покрытия в 1,5 раза более стойки к воздействию кислот, чем чистые цинковые покрытия.
Кадмий имеет более близкий потенциал к железу, чем цинк. Характер защиты кадмием зависит от коррозионной среды. Во влажной атмосфере в присутствии хлор-ионов потенциал кадмия становится электроотрицательнее потенциала железа, и кадмий электрохимически защищает металл от коррозии.
Необходимо учитывать высокую токсичность и дефицитность кадмия. Поэтому его применяют только для защиты особо важных деталей.
Для цинкования и кадмирования предложены электролиты, в которых металлы находятся в виде простых солей или в виде комплексных соединений. Наибольшее применение получили сульфатные электролиты. Их состав, г/л:
| Цинкование | Кадмирование |
Zn SO4 – 200 – 250 | Cd SO4 – 40 – 60 |
Na2 SO4 – 50 – 100 | (NH4)2SO4 – 240 – 250 |
Al2 (SO4)3 – 20 – 30 | Препарат ОС-20 – 0,7 – 1,2 |
| Декстрин – 8 – 10 | Диспергатор НФ – 50 – 100 |
рН = 3,5 | Уротропин – 15 – 20 |
Катодная плотность тока для цинкования 100 – 400 А/м2. Температура электролита для обоих процессов – 15 – 30 ºС.
Очень распространены никелевые покрытия. Их широко применяют для защиты изделий от коррозии и для декоративной отделки в машиностроении, приборостроении, автомобилестроительной, медицинской, электронной промышленности, при изготовлении предметов бытового потребления. Никелевые покрытия весьма стойки в атмосфере, растворах щелочей и некоторых органических кислот, что обусловлено сильно выраженной способностью никеля к пассивации в этих средах.
Никель в паре с железом является катодом, так как имеет более электроположительный потенциал, чем железо. Никель может защищать сталь только механическим путем, следовательно, покрытие не должно иметь пор и должно иметь большую толщину – 20 – 25 мкм. Существуют несколько разновидностей никелевых покрытий.
Никелирование матовое – нанесение на поверхность металлических деталей матового слоя никеля. Основным компонентом электролитов для получения матовых осадков никеля является сульфат никеля. В раствор вводят также сульфат натрия или магния для получения пластичных и полируемых покрытий, а также борную кислоту для поддержания устойчивого значения рН.
Блестящее никелирование используют для защитно-декоративной отделки поверхности. Блестящий никель можно наносить на детали со сложным профилем, он обладает пониженной коррозионной стойкостью по сравнению с матовыми покрытиями.
Никелирование черное – электролитическое нанесение на поверхность металлических изделий слоя никеля черного цвета. Такое покрытие используют как с защитно-декоративной целью, так и для уменьшения коэффициента отражения света. Оно нашло применение в оптической промышленности и в некоторых отраслях машиностроения. У черного никеля низкие показатели коррозионной стойкости, пластичности и прочности сцепления с поверхностью. Поэтому применяют предварительное оловянирование или осаждение матового никеля. Если применить предварительное цинкование, а затем осадить черный никель, то покрытия приобретают такую же коррозионную стойкость, как если бы они были покрыты только цинком. Часто черный никель наносят на изделия из меди или латуни.
Применяют также химический способ нанесения никеля на поверхность металлических изделий. Химически восстановленный никель отличается повышенной коррозионной стойкостью и твердостью. Он позволяет получать равномерные по толщине осадки, отличающиеся высокими декоративными свойствами и малой пористостью.
Усовершенствование процессов никелирования идет по пути создания новых электролитов и сплавов на основе никеля. Разработаны новые метансульфоновые растворы, из которых получают пластичные никелевые покрытия с низкими внутренними напряжениями.
Многослойные в два-три слоя никелевые покрытия обладают большей коррозионной стойкостью, чем однослойные. Первый слой никеля осаждают из простого никелевого электролита, а 2-й слой из электролита, содержащего серу, в составе органических добавок. Потенциал никеля, содержащего серу имеет более отрицательное значение, чем потенциал никеля без включений серы. Поэтому второй слой электрохимически защищает от коррозии первый слой никеля. Таким образом обеспечивается более высокая защита основного изделия.
Используют также двухслойное покрытие, называемое «сил-никель». Оно состоит из первого блестящего слоя никеля. Второй слой получают из электролита, содержащего в виде суспензии каолин. В ходе электролиза каолин осаждается вместе с никелем и включается в осадок.
Покрытия из сплавов Ni – W используются при изготовлении пуансонов штампов для производства телевизионных трубок. Совершенствуются процессы соосаждения Ni с фторопластом и MoS2. Введение в матрицу покрытия алмазных и других неметаллических составляющих позволяет существенно повысить твердость и износостойкость никелевых покрытий.
Использование многослойных никелевых покрытий обеспечивает значительную экономию никеля и повышает их эксплуатационные свойства.
Хромовые покрытия широко применяют для защиты от коррозии и механического износа различных машин и аппаратов.
Хромовые покрытия бывают защитно-декоративные и функциональные. Хром по отношению к стали является катодом, и при их контакте разрушаться будет сталь. Поэтому хромовые покрытия на стали должны быть сплошными и беспористыми.
Стальные изделия могут быть защищены от коррозии в атмосферных условиях однослойным хромовым покрытием толщиной не менее 40 мкм.
Для деталей из меди и медных сплавов осаждают хром по никелевому подслою. Детали из цинковых, алюминиевых, магниевых сплавов покрывают хромом после нанесения многослойного покрытия.
Основными компонентами электролитов для хромирования являются оксид хрома (VI) CrO3 и серная кислота. В водном растворе соединения Cr (VI) образуют смесь, состоящую из кислот H2Cr2O7 и H2CrO4. В растворе эти кислоты находятся в динамическом равновесии:
2H2 Cr O4 Û H2 Cr2 O7 + H2O
При электролизе на катоде одновременно происходит восстановление Cr+2 до Cr+3 и до металлического хрома, а также разряд ионов водорода. Выход по току хрома не превышает 15 – 25%. Хромирование – очень сложный процесс. Хром выделяется на катоде только при очень высоких плотностях тока (1000 – 3000 А/м2). Причем для каждой температуры имеется минимум плотности тока, ниже которого хром не осаждается.
Изменяя режим электролиза, можно получить блестящие, матовые (серые) или «молочные» осадки хрома. Блестящие осадки имеют наиболее высокую твердость, хорошее сцепление с основным металлом и наименьшую хрупкость. Матово-серые осадки отличаются высокой хрупкостью. Покрытия «молочным» хромом имеют высокую твердость, пластичность, значительно меньшую пористость и более высокую защитную способность.
Стальные детали приборов и машин, работающих в жестких условиях эксплуатации , покрывают двумя слоями хрома: нижний - молочный и верхний – блестящий. Это обеспечивает хорошую защиту от коррозии и высокую износостойкость при необходимых декоративных качествах.
Хромирование черное применяется для защитно-декоративной отделки деталей, поверхность которых наряду с коррозионной стойкостью должна иметь низкий коэффициент отражения света. По сравнению с другими покрытиями черного цвета черное хромовое покрытие отличается повышенной коррозионной стойкостью. Наносят черный хром по подслою молочного или блестящего хрома или никеля. Черные хромовые покрытия состоят на 75% из металлического хрома и на 25% из оксидов хрома.
Традиционные процессы получения хромовых покрытий из растворов, содержащих соединения Cr (VI), экологически опасны. ПДК для Cr (VI) равно 0,02 мг/л, а для Cr (III) – 0,07 мг/л. В связи с этим отработанные гальваностоки проходят сложную систему очистки. Первоначально соединения Cr(VI) восстанавливают до Cr(III). Если процесс восстановления проводят химическим путем, то применяют гидросульфит натрия – Na HS O3. Для полного восстановления соединений Cr (VI) требуется 5-7-кратный избыток гидросульфита и рН = 2 - 2,5. В процессе очистки часть Na HSO3 разлагается с выделением SO2, что приводит к дополнительному загрязнению атмосферы. Заключительная стадия очистки состоит в подщелачивании раствора до рН = 8,0-8,5 и осаждении Сг (ОН)3 вместе с другими примесями в осадок.
С целью улучшения экологической ситуации очень привлекательно выглядит идея получения осадков хрома из электролитов, содержащих соединения Сr (III). На этом пути возникают трудности, связанные с низким рН гидратообразования Сr(ОН)з, инертностью аквакомплексов Сr(Н2О)63+, образованием прочных внутриорбитальных комплексов и сложной конструкцией электролизера.
Разработанные электролиты на основе соединений Сr(III) не позволяли получить толстые слои. При достижении толщины в несколько микрон выделение хрома прекращается. Введение в раствор слабых лигандов, таких, как муравьиная или малоновая кислоты, а также ряда добавок позволяет получать толстые осадки хрома (до 100-200 мкм). Использование новых электролитов дало возможность проводить осаждение хрома с выходами по току до 25-45 % и скоростью 0,8-1,6 мкм/мин вне зависимости от времени.
В процессе электролиза растворов, содержащих ионы Сr3+, соединения Сr (VI) оказывают вредное влияние. Это требует усложнения конструкции электролизера и разделения диафрагмой или мембраной анодного и катодного пространства, так как шестивалентные ионы хрома (Сr6+) в основном образуются в результате химического взаимодействия с озоном, выделяющимся на аноде. Применение новых оксидных материалов, имеющих высокое перенапряжение для реакции образования соединений Сr (VI), позволило резко снизить выход по току Сrб+ и избежать конструктивного усложнения электролизера.
Таким образом, открываются перспективы для промышленного освоения новых передовых технологий нанесения защитных хромовых покрытий.
Оловянные покрытия применяют главным образом
для защиты от коррозии в растворах органических кислот и солей, содержащихся в пищевых продуктах, а также от атмосферной коррозии в приборостроении, где наряду с защитными свойствами необходимо обеспечить
паяемость изделия.
Олово в контакте со сталью является катодом, так как его потенциал имеет более положительное значение по отношению к железу. Однако в среде органических кислот олово образует комплексные соединения, и потенциал его становится более электроотрицательным.
В этих средах олово выступает как анод.
Около 50% добываемого олова расходуется на изготовление белой жести. С целью повышения коррозионной устойчивости производят оплавление оловянных покрытий. Блестящее оловянирование – это нанесение на поверхность металлических изделий блестящего слоя олова. По пористости и коррозионной стойкости они не отличаются от матовых покрытий, но обладают повышенной твердостью.
Для оловянирования применяют кислые и щелочные электролиты. Кислые электролиты просты по составу и работают при комнатной температуре. Они применяются для покрытия деталей простой конфигурации. Состав кислого электролита для покрытия оловом, г/л: Sn SO4 — 20-25; H2SO4 — 50-100; препарат ОС-20 — 2-5. Температура 15-30°С, плотность тока— 100-200 А/м2.
Для покрытия оловом сложных деталей применяют щелочной электролит состава, г/л: Na2Sn(OH)6 — 45-90; NaOHсвoб — 7-17; CH3COONa — 15. Температура 60-80 °С, плотность тока — 50-200 А/м2.
Свинец устойчив в среде серной кислоты и ее соединений. Свинец, как и олово, не может защищать стальные изделия электрохимически. Поэтому применяют свинцовые беспористые покрытия большой толщины (до 300 мкм), которые механически защищают детали из черных металлов в средах, содержащих серную и хромовые кислоты и их соли. Необходимо учитывать высокую токсичность свинца.
Для покрытия изделий свинцом в промышленности применяют борфтористоводородные или фенолсульфоновые электролиты. Осадки хорошего качества получают только в присутствии органических добавок. Состав электролитов, г/л:
| Борфтористоводородный | Фенолсульфоновый |
Pb (BF4)2 — 125-200 | Рb(НОС6Н4SОз)2 — 170-180 |
HBF4 — 40-600 | НО Сб Н4 S0з Н своб —20-25 |
| Клей столярный — 0,5-1,0 | Клей столярный — 0,4-0,5 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Методы извлечения и очистки родия
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими опе
- Методы определения концентрации растворённого кислорода в воде
- Методы определения содержания свинца, цинка, серебра в питьевой воде
- Методы определения хлорид-ионов
Защите окружающей среды от возрастающей антропогенной нагрузки в настоящее время уделяется все большее внимание во всем мире. Развитие
- Производство и переработка масличного сырья
- Производство кальцинированной соды
- Пространственное движение одной частицы
О математическом описании многомерных системКонфигурационное пространствоОзнакомившись со свойствами волновых функций и уровней одн
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

