Методы извлечения и очистки родия
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими операциями. Это неизбежно: родий относится к числу наиболее редких элементов. К тому же он рассеян, собственных минералов не имеет. Находят его вместе с самородной платиной и осмистым иридием. Данная курсовая работа посвящена способам извлечения родия из отработанных катализаторов.
Глава 1. ИЗВЛЕЧЕНИЕ РОДИЯ И ЕГО ОЧИСТКА
Извлечение родия и очистка его от неблагородных и благородных примесей связана с исключительно сложными, длительными и трудоемкими операциями. Это неизбежно: родий относится к числу наиболее редких элементов. К тому же он рассеян, собственных минералов не имеет. Находят его вместе с самородной платиной и осмистым иридием.
Однако содержание в них родия невелико: обычно оно составляет доли процента в самородной платине и несколько процентов в осмистом иридии. Известна, правда, редчайшая разновидность осмистого иридия – родистый невьянскит. В нем до 11,3% родия. Это самый богатый родием минерал.
Технология выделения родия зависит прежде всего от вида и состава перерабатываемого сырья. Расскажем для примера, как извлекают родий из самородной платины.
С приисков сырая платина поступает на аффинажный завод, где отделяют благородные металлы от неблагородных примесей и разделяют сами драгоценные металлы. Делается это так.
Сырую, платину загружают в фарфоровые котлы и обрабатывают царской водкой. Процесс идет при нагревании в течение суток. Родий, а вместе с ним почти вся платина, палладий, неблагородные металлы (железо, медь и другие), частично рутений и иридий переходят в раствор, а в осадке остаются осмистый иридий, кварц, хромистый железняк и другие минеральные примеси.
Сначала на него действуют хлористым аммонием, чтобы осадить и отделить платину. Оставшийся раствор упаривают: образуется осадок, который состоит из нескольких солей. В нем до 6% родия; присутствуют также палладий, рутений, иридий, платина (всю ее с помощью NH4Cl отделить не удается) и неблагородные металлы. Этот осадок растворяют в воде и еще раз тем же способом отделяют платину. А раствор, в котором остались родий, рутений и палладий, по мере накопления направляют на очистку и разделение.
Родий извлекают разными способами. Например, по способу, предложенному советским ученым В.В. Лебединским в 1932 г., вначале нитритом натрия NaNO2 осаждают и отделяют от раствора осадок гидроокисей неблагородных металлов; родий при этом остается в растворе в форме Na3(Rh(NO2)6). После этого с помощью NH4Cl из раствора на холоду выделяют родий; он уходит в виде малорастворимого комплекса (NH4)2Na(Rh(NO2)6). Однако при этом вместе с родием в осадок переходит и иридий; другие же платиновые металлы – рутений, палладий и остатки платины – остаются в растворе. Итак, родий в осадке, и нас теперь интересует уже только этот осадок. Что с ним происходит дальше?
Осадок растворяют в разбавленном едком натре и из этого раствора действием аммиака и NH4Cl снова осаждают родий – теперь уже в форме другого комплексного соединения (Rh(NH3)3(NO2)3). Осадок отделяют и тщательно промывают раствором хлористого аммония.
На этом очистка родия еще не закончена. Осадок снова загружают в котел с соляной кислотой и нагревают несколько часов. Происходит реакция:
2(Rh(NH3)3(NO2)3) + 6HCl → 2(Rh(NH3)3Cl3) +3NO2 + 3NO + 3H2O
с образованием нового комплексного соединения родия ярко-желтого цвета. Это триаминтрихлорид родия. Его тщательно промывают водой и только после этого приступают к выделению металлического родия.
Соль загружают в печь и прокаливают несколько часов при 800...900°C. Комплексное соединение разлагается и образуется порошкообразный продукт смеси родия с его окислами. После охлаждения порошок еще раз тщательно промывают разбавленной царской водкой для удаления оставшегося незначительного количества неблагородных примесей, а затем снова загружают в печь и восстанавливают до металла, прокаливая в атмосфере водорода.
Следует иметь в виду, что в нашем рассказе путь этот еще упрощен и укорочен: опущены второстепенные, не несущие самостоятельной «химической нагрузки» стадии. Но в действительности на всех стадиях родиевого производства нет «мелочей». Температурные режимы, концентрация реагентов, продолжительность операций, материалы аппаратуры – все важно. Управление всеми процессами требует больших знаний и громадного опыта.
Сейчас родий вместе с другими платиновыми металлами добывают также из сульфидных медноникелевых руд. Содержание элемента №45 в этих рудах исчисляется миллиграммами на тонну руды. Поэтому собственно аффинажу родия предшествуют сложные технологические операции отделения основных количеств цветных металлов и получения концентрата благородных металлов.
Глава 2. ПРИМЕНЕНИЕ РОДИЯ
Металлы платиновой группы довольно широко используются в промышленности, но содержащие их части аппаратуры, будем надеяться, не выбрасываются на помойку, а находятся на строгом учете. Самое легкодоступное сырье для извлечения платины и палладия это, наверное, ненужные радиодетали - микросхемы и керамические конденсаторы.
В каталитических нейтрализаторах отработавших газов автомобилей. Современный катализатор - это керамический монолит, пронизанный множеством каналов, поверхность которых покрыта слоем алюминия, а на него, в свою очередь, нанесены химически активные драгоценные металлы (родий, палладий, платина). На долю последних приходится до 60% себестоимости устройства. Именно благодаря им происходят необходимые химические реакции - окисление монооксида углерода (СО) и несгоревших углеводородов (СН), а также сокращение количества окиси азота (NOx). В трехкомпонентном нейтрализаторе платина и палладий вызывают окисление СО и СН, а родий "борется" с NOx. Кстати, родий - субпродукт при получении платины - наиболее ценный в этой троице. И именно его в первую очередь "отравляет" свинец, содержащийся в бензине. В конструкции катализатора используют другие химические элементы, повышающие эффективность трех основных, - никель, участвующий в реакции с NOx, железо, а также церий.
Платина и родий применяется в термоэлектрических преобразователях (термопарах) Существует несколько типов термопар. Самые распространенные термопары - хромель-алюмель ХА(К) и хромель-копель ХК(L). Другие типы - платина-платинородий ПП(S и R), железо-константан ЖК(J), медь-константан МК(T), вольфрам-рений ВР, другие менее распространены.
Платина - в отечественных термосопротивлениях, которые обозначаются маркировкой "ТСП" (с маркировкой "ТСМ" используется медь). Импортные платиновые резистивные элементы для измерения температуры делятся на обмоточные и тонкослойные и имеют следующие термосопротивления маркировки:T 600, DT 600, G 600, DG 600, T 800, DT 800, PA 200, PB 200, PtpS. У обмоточных элементов из платиновой проволоки обмотка или уложена в капиллярах цилиндрических керамических корпусов или намотана на внешней стороне корпусов и покрыта керамической эмалью или стеклоэмалью. Проволочные выводы этих элементов имеют сечение 0.3 или 0.35 мм, длина выводов от 10 до 50 мм. У тонкослойных элементов обмотка заменена споем сопротивления, нанесённым на основную пластину из корундовой керамики. Проволочные выводы этих элементов имеют сечение 0,25 мм, длина выводов 15 мм.
Исключительно высокая стойкость платины по отношению к кислотам обеспечивает ей радушный прием в химических лабораториях, где она служит материалом для тиглей, чашей, сеток, трубок, электродов и других лабораторных атрибутов. Большое количество платины требуется также для производства кислото- и жароупорной аппаратуры химических заводов. В технике довольно широко применяют платиновые термометры.
В платиновых тиглях разлагают горные породы – чаще всего, сплавляя их с содой или обрабатывая плавиковой кислотой.
Платиновой посудой пользуются при особо точных и ответственных аналитических операциях.
Платина – лучший катализатор реакции окисления аммиака до окиси азота NO в одном из главных процессов производства азотной кислоты. Катализатор здесь предстает в виде сетки из платиновой проволоки диаметром 0,05...0,09 мм. В материал сеток введена добавка родия (5...10%). Используют и тройной сплав – 93% Pt, 3% Rh и 4% Pd. Добавка родия к платине повышает механическую прочность и увеличивает срок службы сетки, а палладий немного удешевляет катализатор и немного (на 1...2%) повышает его активность. Срок службы платиновых сеток – год-полтора. После этого старые сетки отправляют на аффинажный завод на регенерацию и устанавливают новые. Производство азотной кислоты потребляет значительные количества платины.
Платиновые катализаторы ускоряют многие другие практически важные реакции: гидрирование жиров, циклических и ароматических углеводородов, олефинов, альдегидов, ацетилена, кетонов, окисление SO2 в SO3 в сернокислотном производстве. Их используют также при синтезе витаминов и некоторых фармацевтических препаратов.
Не менее важны платиновые катализаторы в нефтеперерабатывающей промышленности. С их помощью на установках каталитического риформинга получают высокооктановый бензин, ароматические углеводороды и технический водород из бензиновых и лигроиновых фракций нефти. Здесь платину обычно используют в виде мелкодисперсного порошка, нанесенного па окись алюминия, керамику, глину, уголь. В этой отрасли работают и другие катализаторы (алюминий, молибден), но у платиновых – неоспоримые преимущества: большая активность и долговечность, высокая эффективность.
Из сплава платины с 5...10% родия делают фильеры для производства стеклянного волокна. В платиновых тиглях плавят оптическое стекло, когда особенно важно ничуть не нарушить рецептуру. В химическом машиностроении платина и ее сплавы служат превосходным коррозионностойким материалом. Аппаратура для получения многих особо чистых веществ и различных фторсодержащих соединений изнутри покрыта платиной, а иногда и целиком сделана из нее.
Из сплавов золота с платиной делают детали оборудования для получения синтетического волокна, которые по условиям производства должны обладать исключительной стойкостью к воздействию химических веществ.
Иридий - из этого металла изготовляют лабораторные тигли для проведения опытов с грозным фтором и его агрессивными соединениями. Из иридия делают также мундштуки для выдувания тугоплавкого стекла. Для измерения высоких температур (2000–2300 °С) сконструирована термопара, электроды которой выполнены из иридия и его сплава с рутением или родием.
Сплав палладия с другими металлами (главным образом, серебром) используют в зубоврачебной технике – из него делают отличные протезы.
Палладием покрывают особо ответственные контакты электронной техники, телефонных аппаратов и других электротехнических приборов. В оптике сплавы золота с палладием применяются чаще, чем золотоплатиновые сплавы, это связано с тем, что палладий сравнительно дешев – его цена в пять раз меньше, чем платины.
Глава 3. РОДИЙ И ЕГО СВОЙСТВА
Ро́дий (лат. Rhodium; обозначается символом Rh) — элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 45. Простое вещество родий (CAS-номер: 7440-16-6) — твёрдый переходный металл серебристо-белого цвета. Благородный металл платиновой группы.
Родий содержится в платиновых рудах, в некоторых золотых песках Южной Америки. До 43 % родия содержится в мексиканском золоте. Также содержится в изоморфной примеси минералов группы осмистого иридия (до 3,3 %), в медноникелевых рудах. Редкая разновидность осмистого иридия — родиевый невьянскит — самый богатый родием минерал.
Физические свойства
Родиевая фольга и проволока
Родий — твёрдый металл, серебристо-серого цвета. Имеет высокий коэффициент отражения электромагнитных лучей видимой части спектра, поэтому широко используется для изготовления «поверхностных» зеркал.
Изотопы родия
Природный родий состоит из изотопа 103Rh. Наиболее долгоживущие изотопы
Изотоп | Период полураспада |
101Rh | 3,3 года |
102Rh | 207 дней |
102mRh | 2,9 года |
99Rh | 16,1 дней |
Химические свойства
Родий — благородный металл, по химической стойкости в большинстве коррозионных сред превосходит платину.
Металлический родий растворяется в царской водке при кипячении, а также электрохимически, анодно — в смеси перекиси водорода и серной кислоты.
Родий характеризуется высокой химической устойчивостью. С неметаллами он взаимодействует только при температуре красного каления. Мелко измельчённый родий медленно окисляется только при температуре выше 600 °C:
4Rh + 3O2 = 2Rh2O3.
При нагревании родий медленно взаимодействует с концентрированной серной кислотой, раствором гипохлорита натрия и бромоводорода. При спекании реагирует с расплавами гидросульфата калия KHSO4, пероксида натрия Na2O2 и пероксида бария BaO2:
2Rh + 6KHSO4 = 2K3Rh(SO4)3 + 3H2↑,
2Rh + 3BaO2 = Rh2O3 + 3BaO.
В присутствии хлоридов щелочных металлов, когда есть возможность образовывать комплексы (RhX3)3−, родий взаимодействует с хлором, например:
2Rh + 6NaCl + Cl2 = 2Na3(RhCl6).
При действии на водные растворы солей и комплексов родия (III) щелочами образуется осадок гидроксида родия Rh(OH)3:
Na3(RhCl6) + 3NaOH = Rh(OH)3↓ + 6NaCl.
Гидроксид и оксид родия (III) проявляют основные свойства и взаимодействуют с кислотами с образованием комплексов Rh (III):
Rh2O3 + 12HCl = 2H3RhCl6 + 3H2O,
Rh(OH)3 + 6HCl = H3RhCl6 + 3H2O.
Высшую степень окисления +6 родий проявляет в гексафториде RhF6, который образуется при прямом сжигании родия во фторе. Соединение неустойчиво. В отсутствие паров воды гексафторид окисляет свободный хлор или оксид азота (II) NO:
2RhF6 + 3Cl2 = 2RhF3 + 6ClF.
В низших степенях окисления +1 и +2 родий образует комплексные соединения.
Применение
Катализаторы
· Родий применяется в катализаторах, в том числе в каталитических фильтрах-нейтрализаторах выхлопных газов автомобилей
· Сплав родия с платиной очень эффективный катализатор для производства азотной кислоты окислением аммиака воздухом и до сих пор его применению нет альтернативной замены.
Конструкционный материал
· при производстве стекла (сплав платина-родий — фильеры для стеклонитей, для жидкокристаллических экранов). В связи с ростом производства жидкокристаллических устройств потребление родия быстро растёт (в 2005 в производстве стекла было использовано 1,55 тонны родия, в 2003 — 0,81 тонны).
· Металлический родий используется для производства зеркал подвергающихся сильному нагреву (калению) для мощных лазерных систем (например фтороводородных лазеров), а также для производства дифракционных решеток к приборам для анализа вещества (спектрометры).
· Тигли из платино-родиевых сплавов используются в лабораторных исследованиях и для выращивания некоторых драгоценных камней и электрооптических кристаллов.
Термопары
· Термопары платина-родий и др., в качестве очень эффективного и долговечного измерения высоких (до 2200 °C) температур нашли широкое применение сплавы родия с иридием (например ИР 40\60).
Материал контактных пар
Благодаря высокой стойкости к электроэрозии родий и его сплавы применяются в качестве материала для контактов (герконы, разъёмы, скользящие контакты).
Ювелирное дело
Используются гальванические электролиты родирования (преимущественно сульфатные, сульфаматные и фосфатные) для получения износостойких и коррозионноустойчивых покрытий.
Холодный белый блеск родия хорошо сочетается с бриллиантами, фианитами и др. вставками. Так же родий добавляют в качестве легирующей, укрепляющей добавки в платину и палладий. Нанесение на ювелирное изделие родиевого покрытия уменьшает износ и увеличивает твердость изделия, защищая от царапин, и придает яркий блеск.
Биологическая роль и физиологическое воздействие
Родий не играет биологической роли.
Соединения родия довольно редко встречаются в повседневной жизни и их воздействие на человеческий организм до конца не изучено. Несмотря на это, они являются высоко токсичными и канцерогенными веществами. LD50 хлорида родия для крыс — 12,6 мг/кг. Соли родия способны сильно окрашивать человеческую кожу.
Глава 4. ИЗВЛЕЧЕНИЕ РОДИЯ ИЗ ОТРАБОТАННЫХ КАТАЛИЗАТОРОВ
Значительные количества родия используются в катализаторах процессов гидроформилирования (оксосинтеза). Этот процесс заключается во взаимодействии олефинов с окисью углерода и водородом при повышенных температурах и давлениях в присутствии некоторых карбонилов металлов, продуктом реакции являются альдегиды:
![]()
В этом уравнении R означает органический радикал.
Для проведения этой реакции часто используются кобальтсодержащие катализаторы; при этом процесс проводят при относительно высоких температурах, что приводит к увеличению образования изоальдегидов, как правило являющихся нежелательными продуктами. Применение родийсодержащего катализатора позволяет проводить процесс при значительно более мягких условиях с получением более высоких выходов н-альдегидов. Однако в промышленности эти катализаторы находят лишь ограниченное применение, поскольку извлечение и регенерация дорогостоящего металла связаны со значительными трудностями.
Как в периодическом, так и в непрерывном процессе более легко летучие компоненты реакционной смеси, в том числе и продукты реакции, отделяют путем дистилляции; при этом катализатор накапливается в высококипящем остатке от дистилляции. Этот остаток в принципе может быть возвращен в процесс гидроформилирования. Однако не удается рециркулировать весь остаток, поскольку его количество в ходе процесса постепенно возрастает, а активность катализатора постепенно снижается. Таким образом извлечение и регенерация дорогостоящих родиевых катализаторов являются весьма важными для повышения экономичности процессов; однако применявшиеся до настоящего времени методы извлечения не могут считаться удовлетворительными.
Метод включает обработку остатков дистилляции процесса гидроформилирования кислородсодержащими минеральными кислотами и перекисями, в результате чего получается водный раствор родиевой соли. Этот водный раствор обрабатывают катионитом, последний отделяют от раствора и абсорбированные ионы родия десорбируют соляной кислотой. Растворы гексахлорродината, содержащие соляную кислоту, подвергают в присутствии водорастворимого органического растворителя и третичного фосфина PR3 взаимодействию с оксидом углерода или с соединениями, отщепляющими оксид углерода, при температурах 0—150 °С и давлениях 0,1— 0,5 МПа. В результате получают комплексы I или, если процесс проводят в условиях гидрирования, комплексы II, которые выделяют из смеси.
Процесс предназначен для выделения родия из раствора, содержащего карбонильный комплекс родия, образующийся при карбонилировании спиртов, олефиновых или ацетиленовых соединений окисью углерода и водой. Процесс включает перевод выделенного родия в растворимый карбонильный комплекс родия и обработку полученного раствора водородом в присутствии носителя при температуре 25—300 °С и давлении 0,1—70,0 МПа.
После удаления родия раствор отделяют, а родий, осажденный на носителе, переводят в растворимый родиевый карбонильный комплекс действием оксида углерода в присутствии растворителя и соединения, которое может заменять оксид углерода в качестве лиганда; реакцию проводят при температуре 20—300 С и давлении 0,1—70,0 МПа.
Выделение родия происходит из присутствующего в кубовых остатках процесса гидроформилирования ненасыщенных углеводородов, в котором используется родий и триарилфосфит в качестве лиганда. Процесс выделения включает следующие стадии:
Предварительную обработку кубовых остатков совместно органическим растворителем или смесью растворителей, водой в количестве не менее 5 мл на 100 г кубового остатка, газообразным кислородом или соединением, выделяющим кислород и основанием в количестве достаточном для получения величины рН.
1.реакционной смеси после осаждения родия на стадиях 2—7.
2.Нагревание до температуры 0—80 °С с целью окисления триарилфосфитного лиганда в соответствующее фосфатное соединение.
3.Нагревание смеси, полученной на стадии 2, в течение 15—120 мин при 115— 175°С для осаждения металлического родия; в случае необходимости очистка полученного осадка родия на следующих стадиях.
4.Отделение осадка родия.
5.Промывка осадка родия кислотным растворителем при рН = 3-5-4.
6.Обработка осадка родия щелочным раствором восстановителя для восстановления примесей трехвалентного родия в металл.
7.Обработка родия ледяной уксусной кислотой.
8. Отделение родия
9. Промывка родия, кислым раствором при рН = 3-10. Сушка родия в инертной атмосфере при 250—400 "С.
11. Окисление родия при температуре 300—900 °С, в результате чего родий пре вращается в RhOs.
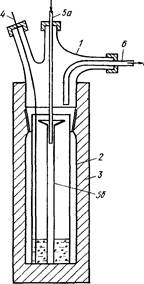
Родий извлекают из высококипящих смолистых остатков дистилляции, получаемых при переработке реакционных смесей, образующихся при превращении органических соединений в присутствии гомогенных комплексных родиевых катализаторов. В качестве примера таких реакций могут быть упомянуты гидроформилирование, гидрокарбоксилирование, изомеризация, димеризация или олигомеризация. Выделение катализатора проводят путем пропускания тока не окисляющего, предпочтительно восстанавливающего газа, например водорода или f водородсодержащего газа, через остатки от дистилляции при повышенной температуре. В результате достигается селективное удаление органических компонентов и получается гетерогенный остаток, содержащий родий. Этот остаток растворяют в неорганической кислоте, получая водорастворимое соединение родия, которое может быть использовано для приготовления комплексного родиевого катализатора. Предпочтительно в качестве неорганической кислоты применять олеум и после его смешивания с гетерогенным остатком проводить частичное упаривание. На рис. 3 представлен лабораторный аппарат, который может быть использован для проведения этого процесса.
Гомогенный раствор, в состав которого входит родиевый комплекс, и высококипящие остатки от дистилляции, нагревают в реакторе, через который непрерывно проходит поток газа. На схеме применены следующие обозначения: 1 — верхняя часть стеклянного реактора; 2 —- нижняя часть стеклянного реактора; 3 — нагреватель; 4 — термопара; 5а — металлический капилляр со стеклянной входной трубкой; 56 — стеклянный капилляр; 6 — трубка для выхода продуктов. Все компоненты кубового остатка и продукты, образующиеся в результате пиролиза, выносятся из реактора током газа, а получающийся металл остается в реакционной камере.
Ниже приводится конкретный пример осуществления данного процесса. Нагревают 500 г н-валерьянового альдегида при 300 °С в течение 72 ч в автоклаве с поршневой мешалкой. Затем отгоняют низкокипящие продукты поликонденсации в высоком вакууме. Растворяют 300 мг HRh(CO)(PR3)3 и 1200 мг РРп3 в 15 мл остатка, образовавшегося при дистилляции, при =;100°С с пропусканием водорода. Водород подают с постоянной скоростью 0,4 л/мин.
После выхода из реакционной камеры газовый поток пропускают через две последовательно соединенные промывные склянки — с вышеупомянутыми продуктами поликонденсации и с толуолом. Реактор нагревают при температуре 300 °С в течение 90 мин и затем охлаждают. В реакторе образуется 169 мг твердого остатка.
Ни в одной из промывных склянок родий не обнаруживается; таким образом, весь имеющийся родий входит в состав твердого остатка.
В реактор добавляют 15 г 10 %-ного олеума и 25 % этого количества выпаривают при =г300°С. Образующиеся нары отводят при небольшом вакууме, пропуская их через промывную склянку с водой. Промывная вода не содержит родия. Оставшуюся кислоту, содержащую металл, разбавляют 162 мл воды с получением 7 %-ной серной кислоты. Полученный раствор имеет темно-коричневую окраску. Здесь родий, введенный в систему, находится в растворе.
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Методы определения концентрации растворённого кислорода в воде
- Методы определения содержания свинца, цинка, серебра в питьевой воде
- Методы определения хлорид-ионов
Защите окружающей среды от возрастающей антропогенной нагрузки в настоящее время уделяется все большее внимание во всем мире. Развитие
- Производство и переработка масличного сырья
- Производство кальцинированной соды
- Пространственное движение одной частицы
О математическом описании многомерных системКонфигурационное пространствоОзнакомившись со свойствами волновых функций и уровней одн
- Ректификационная установка непрерывного действия для разделения смеси: ацетон - изопропиловый спирт - вода
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

