Нитрование n-нитроацетанилид
Нитрования – один из важнейших процессов в химической промышленности. Продукты, получаемые за счёт нитрования, являются полуфабрикатами для производства многих товаров различных назначений от взрывчатых веществ до продукции фармацевтической промышленности. Чаще всего нитросоединения являются промежуточными продуктами производство азокрасителей и других веществ. В данной работе рассмотрены способы получения нитросоединений, химические свойства, таутометрия соединений, а также применение нитросоединений в народном хозяйстве.
Целью УИРС является синтез n-нитроацетанилида.
n-Нитроацетанилид - аморфное вещество бледно-желтого цвета, трудно растворимое в большинстве органических растворителей, т. пл. 206 ... 207 0С.
Литературный обзор
1. Нитрование и способы получения нитросоединений
Нитрование - введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; активные частицы в этих реакциях - соответственно катион нитрония NO2, нитрит - ион NO2 и радикал NO2. нитрование может осуществляться по атомам С, N, О замещением атома водорода (прямое нитрование) или других функциональных групп (заместительное нитрование) либо в результате присоединения группы NO2; по кратной связи.
Нитрогруппу в молекулу ароматического углеводорода можно вводить различными путями; главным из них является нитрование углеводородов смесью азотной и серной кислот (нитрующая смесь) в жидкой фазе, последняя одновременно является катализатором процесса, водоотнимающим средством и веществом, способствующим более полному использованию азотной кислоты и препятствующим окислительным процессам. Но по механизму все способы нитрования ароматических углеводородов идут по электрофильному замещению.
Нитрования как процесс принято называть взаимодействие органического соединения с азотной кислотой или её производными, в результате которого атом водорода при одном или нескольких атомах углерода замещается нитрогруппой. В общем случае для процесса нитрования ароматических углеводородов (в ароматическое кольцо) можно написать уравнение:
ArH + NO2+ Ar-NO2 +H+
При нитровании только азотной кислотой реакция может быть выражена уравнением
ArH + HONO2 Ar-NO2 +H2O
Это уравнение даёт лишь общее представление о ходе реакции, но не характеризует всего сложного процесса нитрования, протекающего в несколько стадий; в действительности в реакцию с ароматическими углеводородами вступает не сама азотная кислота, а продукты её превращения.
Как видно из приведённого уравнения, при нитровании азотной кислотой введение каждой нитрогруппы в молекулу углеводорода сопровождается образованием молекулы воды. Это значительно уменьшает концентрацию азотной кислоты и понижает её нитрующую способность, а образующаяся слабая азотная кислота увеличивает степень окисления углеводородов. Поэтому нитрование углеводородов только азотной кислотой осуществляют крайне редко; в том случае необходим избыток азотной кислоты по сравнению с теоретически требуемым, а реакцию надо проводить при низких температурах, чтобы ослабить протекание нежелательных окислительных процессов.
Для связывания воды, выделяющейся в процессе нитрования, применяют водоотнимающие вещества – серную кислоту, полифосфорные кислоты, уксусных ангидрид, трёхфтористый бор. Серная кислота – наиболее доступное и дешёвое вещество для этих целей. Она эффективно связывает воду и переводит азотную кислот в активную нитрующую форму; это позволяет резко снизить расход азотной кислоты почти до теоретического.
Роль серной кислоты заключается не только в связывании реакционной воды. Ещё в 1889 г. В. В. Марковников установил, что наличие в реакционной среде серной кислоты ускоряет реакцию нитрования. Следовательно, серную кислоту можно рассматривать как катализатор этой реакции. Заводская практика подтвердила, что нитрование ароматических углеводородов смесью азотной и серной кислот протекает значительно быстрее, чем при действии безводной азотной кислоты, даже взято в большом избытке.
Для промышленных процессов нитрования (и сульфирования) в качестве водоотнимающего средства предложен трёхфтористый бор BF3 . при добавлении достаточного количества трёхфтористого бора реакции сульфирования и нитрования можно проводить стехиометрическими количествами соответствующих кислот (серной и азотной). Полагают, что реакции протекают по следующим схемам:
ArH + HNO3 + BF3 Ar-NO2 + BF3·H2O
ArH + H2SO4 + BF3 Ar-SO3H + BF3·H2O
По окончании реакции добавляют воду; при этом моногидрат фтористого бора превращается в дигидрат BF3·2H2O, который можно отогнать в вакууме. Далее его обрабатывают фтористым кальцием
2BF3·2H2O + CaF2 Ca(BF4)2 + 4H2O
и при нагревании регенерируют BF3:
Ca(BF4)2 2BF3 + CaF2
Особенности проведения нитрования зависят как от использующихся реагентов, так и от субстрата реакции.
Реагенты для проведения реакции нитрования
1. HNO3 (63-65%, d 1.35 г/мл, товарный продукт) + H2SO4 (96%). Наиболее распространенный.
2. HNO3 (98%, d 1.5 г/мл, также товарный продукт) + H2SO4 (96%-100 %). Для мало реакционноспособных соединений.
3. HNO3 (98%) + SO3 (4-63%), олеум. Для очень мало реакционноспособных соединений.
4. К(Na)NO3 или NH4NO3 + H2SO4 (96%). Распространенный реагент для получения полинитропроизводных.
5. HNO3 (98%, d 1.5 г/мл) + (CH3CO)2O (или СН3СООН). Для реакционноспособных соединений, селективный реагент. Реагент дорогой, поэтому необходимо обосновать экономическую целесообразность его использовании.
6. HNO3 (d 1,3 - 1,5). Для реакционноспособных соединений. Осложнение – побочная реакция окисления.
2. Химические свойства нитросоединений
Нитрогруппа отличается высокой стабильностью по отношению к электрофильным реагентам и разнообразным окислителям. Большинство нуклеофильных агентов за исключением литий- и магнийорганических соединений, а также литийалюминийгидрида не действуют на нитрогруппу. Нитрогруппа относится к числу превосходных нуклеофильных групп в процессах активированного ароматического нуклеофильного замещения ( SNAr). Так, например, нитрогруппа в 1,2,4- тринитробензоле легко замещается под действием гидроксид-, алкоксид-ионов или аминов.
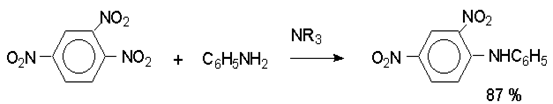
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н.Н.Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.

Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250-300о и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97-98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину. палладий или никель Ренея.
Другим методом восстановления нитросоединений является восстановление металлом в кислой или щелочной среде.
Восстановление нитрогруппы до аминогруппы происходит в несколько стадий, последовательность которых сильно различается в кислой и щелочной среде. Рассмотрим последовательно процессы, протекающие при восстановлении нитросоединений в кислой и щелочной среде.
При восстановлении в кислой среде в качестве восстановителя применяют железо, олово, цинк и соляную кислоту. Эффективным восстановителем нитрогруппы является хлорид олова (II) в соляной кислоте. Этот реагент особенно эффективен в тех случаях, когда в ароматическом нитросоединении есть другие функциональные группы : CHO, COR, COOR и др., чувствительные к действию других восстановителей.
Восстановление нитросоединений до первичных аминов в кислой среде происходит ступенчто и включает три стадии с переносом двух электронов на каждой стадии.
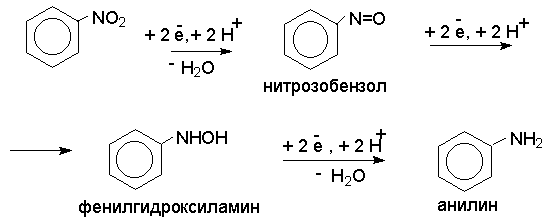
В кислой среде каждый из промежуточных продуктов быстро востанавливается до конечного продукта анилина и их не удается выделить в индивидуальном виде. Однако, в апротонных растворителях в нейтральной среде можно зафиксировать промежуточные продукты восстановления.
При восстановлении нитробензола натрием или калием в ТГФ сначала образуется анион-радикал нитробензола за счет переноса одного электрона от щелочного металла.
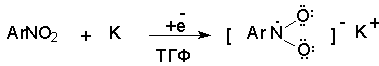
Катион щелочного металла связан в контактную ионную пару с атомом кислорода нитрогруппы анион-радикала. При дальнейшем восстановлении анион-радикал превращается в дианион, который после протонирования дает нитрозобензол.
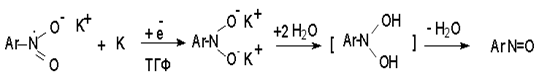
Нитрозобензол, также как и другие ароматические нитрозосоединения, обладает высоким окислительным потенциалом и очень быстро восстанавливается до N-фенилгидроксиламина. Поэтому нитрозобензол не удается выделить в качестве промежуточного продукта восстановления, хотя данные электрохимического восстановления однозначно указывают на его образование.
Дальнейшее восстановление нитрозосоединений до N-арилгидроксиламина включает две аналогичные стадии одноэлектронного восстановления до анион-радикала и далее до дианиона нитрозосоединения, который при протонировании превращается в N-арилгидроксиламин.
![]()
Последняя стадия восстановления арилгидроксиламина до первичного амина сопровождается гетеролитическим расщеплением связи азот-кислород после протонирования субстрата.
![]()
В нейтральном водном растворе можно получить фенилгидроксиламин в качестве продукта восстановления нитробензола. Фенилгидроксиламин получается при восстановлении нитробензола цинком в водном растворе хлорида аммония.
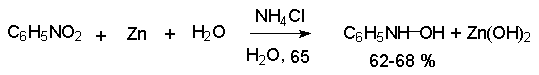
Арилгидроксиламины легко восстанавливаются в амины при обработке железом или цинком и соляной кислотой.
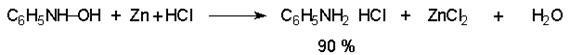
Поскольку фенилгидроксиламин является промежуточным продуктом восстановления, его можно не только восстановить до анилина, но и окислить до нитрозобензола.
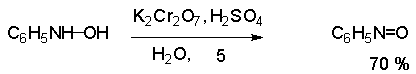
Это, вероятно, один из лучших методов получения ароматических нитрозосоединений, которые не удается иным способом выделить в качестве промежуточного продукта восстановления нитросоединений.
Ароматические нитрозосоединения легко димеризуются в твердом состоянии, причем их димеры бесцветны. В жидком и газообразном состоянии они мономерны и окрашены в зеленый цвет.
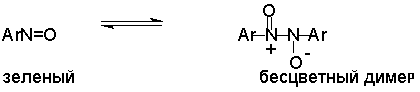
Восстановление нитросоединений металлами в щелочной среде отличается от восстановления в кислой среде. В щелочной среде нитрозобензол быстро взаимодействует со вторым промежуточным продуктом восстановления фенилгидроксиламином с образованием азоксибензола. Эта реакция по существу подобна присоединению азотистых оснований к карбонильной группе альдегидов и кетонов.
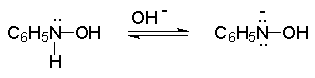
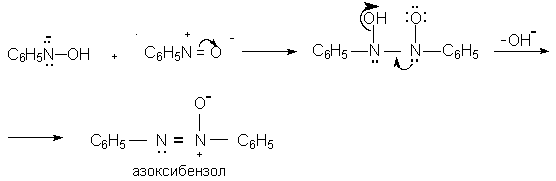
В лабораторных условиях азоксибензол с хорошим выходом получается при восстановлении нитросоединений боргидридом натрия в ДМСО, метилатом натрия в метиловом спирте или старым способом при использовании в качестве восстановителя As2O3 или глюкозы.
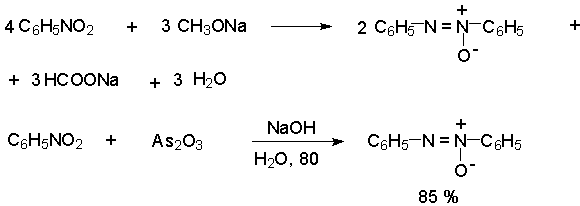
Азоксибензол при действии цинка в спиртовом растворе щелочи восстанавливается сначала до азобензола, а при действии избытка цинка далее до гидразобензола.
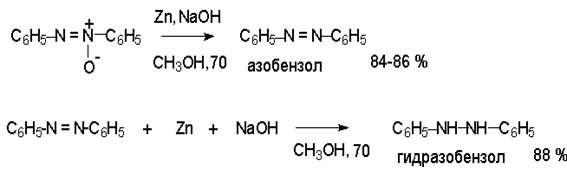
В синтетической практике производные азоксибензола могут быть восстановлены до азобензола под действием триалкилфосфита в качестве восстановителя. С другой стороны, азобензол легко окисляется до азоксибензола перкислотами.
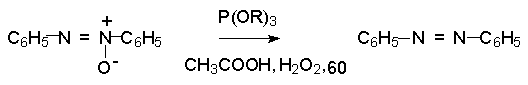
Азобензол существует в виде цис- и транс- изомеров. При восстановлении азоксибензола получается более стабильный транс-изомер, который при облучении УФ-светом превращается в цис-изомер.
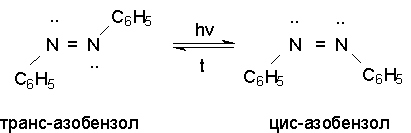
Несимметричные производные азобензола получаются при конденсации нитрозосоединений и первичных ароматических аминов.
![]()
При восстановлении ароматических нитросоединений алюмогидридом лития в эфире также образуются азосоединения с выходом, близким к количественному.
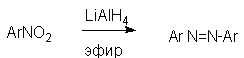
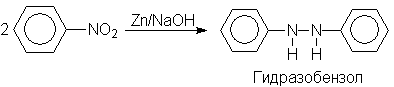
Азобензол восстанавливается цинковой пылью и спиртовой щелочью до гидразобензола. Гидразобензол является, таким образом, конечным продуктом восстановления нитробензола металлом в щелочной среде. На воздухе бесцветный гидразобензол легко окисляется до окрашенного в оранжево-красный цвет азобензола. Вместе с тем гидразобензол, также как и азобензол и азоксибензол, восстанавливается до анилина под действием дитионита натрия в воде или хлорида олова (II) в соляной кислоте.
![]()
Суммарный процесс восстановления ароматических нитросоединений металлами в кислой и щелочной среде может быть представлен в виде следующей последовательности превращений.
В кислой среде
![]()
В щелочной среде
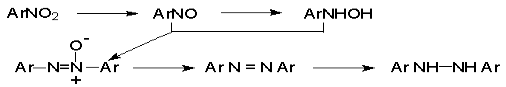
В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты.
![]()
Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине.
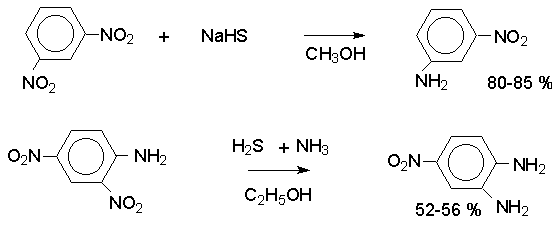
При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи.
![]()
Высокая щелочность среды приводит к образованию азокси- и азосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гиросульфид натрия, где щелочь не образуется.
3. Реакции нитросоединений
3.1 Таутомерия алифатических нитросоединений
Вследствие сильных электроноакцепторных свойств нитрогруппы, a-атомы водорода обладают повышенной подвижностью и поэтому первичные и вторичные нитросоединения являются С-Н-кислотами. Так, нитрометан является довольно сильной кислотой (pKa 10,2) и в щелочной среде легко превращается в резонансностабилизированный анион:
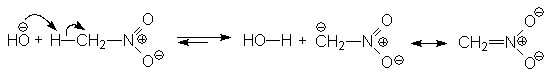
Нитрометан pKa 10,2 Резонансностабилизированный анион
3.2 Конденсация алифатических нитросоединений с альдегидами и кетонами
Нитрогруппа может быть введена в алифатические соединения альдольной реакцией между анионом нитроалкана и альдегидом или кетоном. В нитроалканах a-атомы водорода даже более подвижны, чем в альдегидах и кетонах и поэтому они могут вступать с альдегидами и кетонами в реакции присоединения и конденсации предоставляя свои a-атомы водорода. С алифатическими альдегидами обычно проходят реакции присоединения, а с ароматическими – исключительно конденсации.
Так, нитрометан присоедняется к циклогексанону
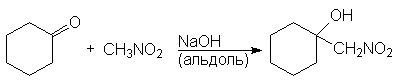
1-Нитрометилциклогексанол но конденсируется с бензальдегидом
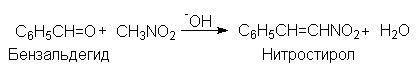
В реакции присоединения с формальдегидом участвуют все три атома водорода нитрометана и образуется 2-гидроксиметил-2-нитро-1,3-динитропропан или триметилолнитрометан.
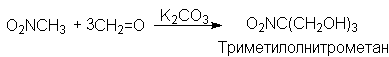
Конденсацией нитрометана с гексаметилентетрамином мы получили 7 нитро-1,3,5-триазаадамантан
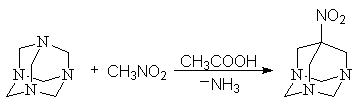
3.3 Восстановление нитросоединений
Нитрогруппу восстанавливают в аминогруппу различными восстановителями (11.3.3). Гидрированием нитробензола под давлением в присутствии никеля Ренея в промышленных условиях получают анилин
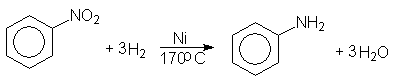
Анилин
В лабораторных условиях вместо водорода можно использовать гидразин, разлагающийся в присутствии никеля Ренея с выделением водорода.
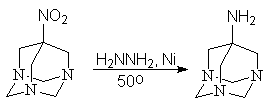
7-нитро-1,3,5-триазаадамантан 7-амино-1,3,5-триазаадамантан
Нитросоединения восстанавливают металлами в кислой среде с последующим подщелачиванием
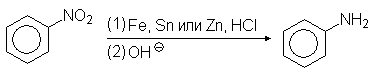
В зависимости от рН среды и используемого восстановителя могут быть получены различные продукты. В нейтральной и щелочной среде активность обычных восстанавливающих агентов по отношению к нитросоединениям меньше, чем в кислой среде. Характерным примером может служить восстановление нитробензола цинком. В избытке соляной кислоты цинк восстанавливает нитробензол в анилин, в то время как в буферном растворе аммонийхлорида - в фенилгидроксиламин/
таутометрия нитросоединение лаборатория
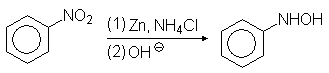
В кислой среде арилгидроксиламины подвергаются перегруппировке:
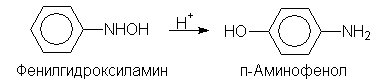
п-Аминофенол используется в качестве проявителя в фотографии. Фенилгидроксиламин далее может быть окислен до нитрозобензола:
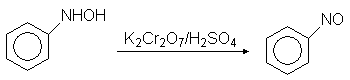
Нитрозобензол
Восстановлением нитробензола хлоридом олова (II) получают азобензол, а цинком в щелочной среде – гидразобензол.
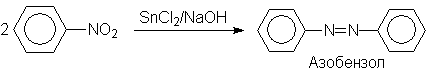
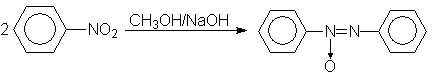
Обработкой нитробензола раствором щелочи в метаноле получают азоксибензол, при этом метанол окисляется в муравьиную кислоту.
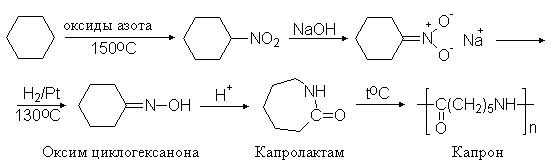
Известны методы неполного восстановления и нитроалканов. На этом основан один из промышленных методов получения капрона. Нитрованием циклогексана получают нитроциклогексан, который восстановлением переводят в оксим циклогексанона и далее с помощью перегруппировки Бекмана - в капролактам и полиамид - исходное вещество для приготовления волокна – капрона
Восстановление нитрогруппы продуктов альдольного присоединения (7) является удобным способом получения b-аминоспиртов.
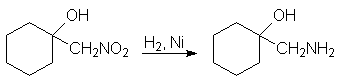
1-Нитрометилциклогексанол 1-Аминометилциклогексанол
Использование в качестве восстановителя сероводорода позволяет восстанавливать одну из нитрогрупп в динитроаренах
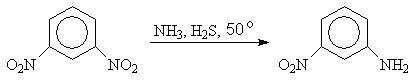
м-Динитробензол м-Нитроанилин
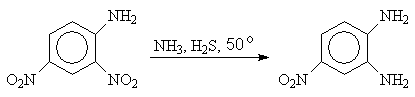
2,4-Динитроанилин 4-Нитро-1,2-диаминобензол
4. Применение нитросоединений в народном хозяйстве
Нитросоединения широко применяются в нефтеперерабатывающей и фармацевтической промышленности, в производстве полимерных материалов, взрывчатых веществ и порохов, а также в ряде других отраслей промышленности и сельского хозяйства.
Опыт. Синтез. n-нитроацетанилид
Пара-нитроацетанилид


![]()
 NHCOCH3 NHCOCH3
NHCOCH3 NHCOCH3![]()

![]()
![]() + HONO2
+ HONO2
- H2O O2N
Реактивы: ацетанилид – 3,5 г;
азотная кислота (ρ = 1,36) – 3 мл;
серная кислота (ρ = 1,84) – 9,5 мл;
этанол
Аппаратура: химический стакан на 200мл; баня со льдом; колба Бунзена; воронка Бюхнера.
Ход работы
Опыт №1.
В фарфоровый стакан емкостью 200 мл всыпают 3,5 г тонко измельченного сухого ацетанилида, приливают 7,5 мл концентрированной серной кислоты и размешивают стеклянной палочкой до образования прозрачного раствора. Температура смеси при этом не должна подниматься выше 25˚С во избежание частичного омыления ацетанилида. Раствор охлаждают до +2˚С в бане со снегом и постепенно при помешивании приливают нитрующую смесь, содержащую 3 мл азотной кислоты и 2 мл концентрированной серной кислоты. Во время реакции нитрования температура реакционной массы не должна превышать 15˚С с целью снижения содержания нитроацетанилида.
После прибавления всей нитрирующей смесираствор продолжают перемешивать еще в течении получаса. Затем реакционную смесь выливают в стакан с холодной водой (10 мл) и снегом (10г) и хорошо перемешивают. Образующийся осадок и нитроацетанилида отделяют фильтрованием на воронке Бюхнера и промывают на фильтре несколько раз холодной водой и сушат.
Опыт №2.
В работе также был проделан еще раз вышеописанный опыт, но с измененными условиями: объем азотной кислоты был увеличен с 3 мл до 7 мл.
Результаты проделанных опытов сводим в таблицу.
| Исходные вещества | Количество получаемого вещества | Потери, % | |||||||
| Названия формула вещества | Mr | tпл | tкип | ρ г/м3 | сод. % | по теории, вещества, г | Теоретический выход, г | Практический выход, г | |
| Ацетанилид | 135,17 | 144 | 305 | 1,082 | 100 | 3,5 | |||
Азотная кислота | 63,01 | -42 | 83,8 | 1,36 | 57,6 | 4,89 | |||
| Паранитро ацетанилид | 180,16 | 215 | - | - | - | 10,49 | 3,4 | 67,8 | |
| Опыт №2 | 6,0 | 42,8 | |||||||
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Производство аммиака: краткая характеристика
Общей экономической задачей каждого химического предприятия является получение химических веществ высокого качества и в достаточном
- Реакції комплексоутворення
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИСУМСЬКИЙ ДЕРЖАВНИЙ ПЕДАГОГІЧНИЙ УНІВЕРСИТЕТ Ім. А.С. МАКАРЕНКАКафедра хімії та методики навчання х
- Сировинна база хімічної промисловості
- Хіміко-технологічні процеси - складова хімічного виробництва. Кінетичні закономірності гетерогенних хіміко-технологічних процесів
- Бериллий и сплавы, содержащие бериллий. Свойства, применение в химической технологии
Применяемые в промышленности и быту металлические изделия редко состоят из чистых металлов, примером является алюминиевая или медная
- Висмут и его соединения в природе
1. ОБЩИЕ СВЕДЕНИЯ О ВИСМУТЕ 1.1 Происхождение висмута1.2 Физические свойства1.3 Химические свойства1.4 Получение висмута2. НАХОЖДЕНИЕ В ПРИР
- Влияние состава растворителя на микроволновый синтез нанопорошка CuInSe2
Нанотехнология в последние годы стала одной из наиболее важных и захватывающих областей знаний на переднем крае физики, химии, биологи
Copyright © https://referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

