Непредельные углеводороды ряда ацетилена (алкины)
Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов). Это видно из сравнения числа атомов водорода в ряду:
С2Н6 C2H4 С2H2
этан этилен ацетилен
(этен) (этин)
Алкины образуют свой гомологический ряд с общей формулой, как и у диеновых углеводородов СnH2n-2
1. Строение алкинов
Первым и основным представителем гомологического ряда алкинов является ацетилен (этин) С2Н2. Строение его молекулы выражается формулами:
Н—СºС—Н или Н:С:::С:Н
структурная электронная
формула формула
По названию первого представителя этого ряда — ацетилена — эти непредельные углеводороды называют ацетиленовыми.
В алкинах атомы углерода находятся в третьем валентном состоянии (sp-гибридизация). В этом случае между углеродными атомами возникает тройная связь, состоящая из одной s- и двух p-связей. Длина тройной связи равна 0,12 нм, а энергия ее образования составляет 830 кДж/моль. Модели пространственного строения ацетилена представлены на рис. 1.
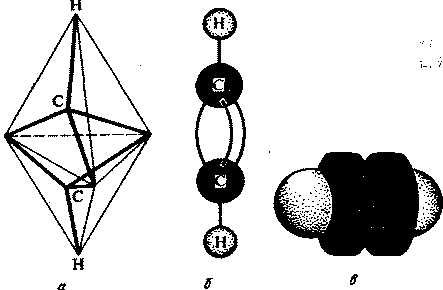
Рис.1. Модели пространственного строения молекулы ацетилена:
а - тетраэдрическая; б - шаростержневая; в -по Бриглебу
2. Номенклатура и изомерия
Номенклатура. По систематической номенклатуре ацетиленовые углеводороды называют, заменяя в алканах суффикс -ан на суффикс -ин. В состав главной цепи обязательно включают тройную связь, которая определяет начало нумерации. Если молекула содержит одновременно и двойную, и тройную связи, то предпочтение в нумерации отдают двойной связи:
СН3
Н—СºС—СН2—СН3 Н3С—СºС—СН3 Н2С=С—СН2—СºСН
бутин-1 бутин-2 2-метилпентен-1-ин-4
(этилацетилен) (диметилацетилен)
По рациональной номенклатуре алкиновые соединения называют, как производные ацетилена.
Непредельные (алкиновые) радикалы имеют тривиальные или систематические названия:
Н—СºС— - этинил;
НСºС—СН2— -пропаргил
Изомерия. Изомерия алкиновых углеводородов (как и алкеновых) определяется строением цепи и положением в ней кратной (тройной) связи:
Н—СºС—СН—СН3 Н—СºС—СН2—СН2—СН3 Н3С—С=С—СН2—СН3
СН3
3-метилбутин-1 пентин-1 пентин-2
3. Получение алкинов
Ацетилен в промышленности и в лаборатории можно получать следующими способами:
1. Высокотемпературным разложением (крекинг) природного газа — метана:
2СН4 1500°C® НСºСН + 3Н2
или этана:
С2Н61200°C® НСºСН + 2Н2
2. Разложением водой карбида кальция СаС2, который получают спеканием негашеной извести СаО с коксом:
СаО + 3C 2500°C® CaC2 + CO
СаС2 + 2Н2O ® НСºСН + Са(ОН)2
3. В лаборатории производные ацитилена можно синтезировать из дигалогенопроизводных, содержащих два атома галогена при одном или соседних углеродных атомах, действием спиртового раствора щелочи:
Вr
Н3С—СН—СН—СН3 + 2КОН ® Н3С—СºС—СН3 + 2KBr + 2Н2О
Br
2,3-дибромбутан бутин-2
(диметилацетилен)
4. Физические и химические свойства
физические свойства. Ацетиленовые углеводороды, содержащие в молекуле от двух до четырех углеродных атомов (при обычных условиях), — газы, начиная с C5H8 — жидкости, а высшие алкины (с С16Н30 и выше) — твердые вещества. Физические свойства некоторых алкинов показаны в табл. 1.
Таблица 1. Физические свойства некоторых алкинов
| Название | Формула | t пл,°С | t кип,°С | d204 |
| Ацетилен (этан) | HCºCH | - 81,8 | -84,0 | 0,6181* |
| Метилацетилен (пропин) | НСºС—СН3 | -101,5 | -23,2 | 0,7062** |
| Этилацетилен (бутин-1) | НСºС—С2Н5 | -125,7 | +8,1 | 0,6784 |
симм-Диметилацетилен (бутин-2) | Н3C—CºС—CH3 | -32,3 | +27,0 | 0,6510 |
| Пропилацетилен (пентин-1) | НСºС— (СН2)2—СН3 | -90,0 | +40,2 | 0,6900 |
| Метилэтилацетилен (пентин-2) | Н3С—СºС—С2Н5 | -101,0 | +56,1 | 0,7107 |
| Бутилацетилен (гексин-1) | НСºС— (СН2)3—СН3 | -131,9 | +71,3 | 0,7155 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Ионометрическое титрование
Немировский А.М.Процедура ионометрического титрования несложна. В анализируемую пробу, в которую погружены ионоселективный электрод
- Ионометрия. Метод добавок
Интерес к методу добавок в ионометрии вызывается тем, что он играет более значительную роль, чем метод добавок в других методах анализа
- Ионометрия и электродинамика
Немировский А.М.Глубокое знакомство с литературными источниками, посвященными ионометрии, выявляет фатальную склонность авторов испо
- Ионометрическое определение хлоридов в растворах хроматов
Немировский А.М.Задача определения хлоридов в хроматных растворах пришла от гальваников. Дело в том, что в травильных ваннах необходим
- Химический метод Винклера для определения растворенного кислорода
Каверин А.В.Среди методов определения концентрации растворенного кислорода самым старым, но до сих пор не потерявшим своей актуальнос
- Химико-аналитические свойства ионов d-элементов
Ионы d-элементов 1В группыРеакции обнаружения ионов меди Сu2+Действие группового реагента H2S. Сероводород образует в подкисленных раств
- Угарный газ
Физические свойства.Монооксид углерода представляет собой бесцветный и не имеющий запаха газ, малорастворимый в воде.t пл. 205 °С, t кип.
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

