Ионометрическое титрование
Немировский А.М.
Процедура ионометрического титрования несложна. В анализируемую пробу, в которую погружены ионоселективный электрод и электрод сравнения, добавляется титрант, который связывает определяемое вещество. После каждой добавки записываются показания электродов. Кривая титрования в координатах E (потенциал электродов) от V (объем титранта) имеет ярко выраженный S-образный вид. Точка перегиба этой кривой является точкой эквивалентности (см. рис.1а). Если в анализируемом растворе присутствуют несколько определяемых ионов, то кривая имеет ступенчатый вид с несколькими точками перегиба. Каждая точка перегиба соответствует эквивалентному связыванию соответствующего определяемого иона (см. рис.1б).
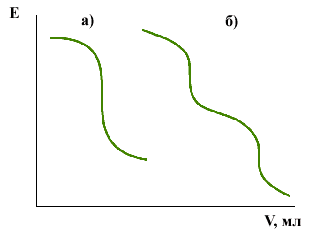
Рис.1.
Помимо специфического вида кривых титрования, ионометрическое титрование носит характерные черты, о которых следует упомянуть.
Во-первых, процедура ионометрического титрования занимает гораздо больше времени, чем процедура классического титрования. Это связано с дополнительными кинетическими факторами, которые вносит пара электродов, так как на установление стабильного значения потенциала в окрестности точки эквивалентности уходит существенно больше времени, чем вне этой окрестности. Если не дожидаться установления стабильного значения потенциала, то погрешность анализа может быть большой.
Во-вторых, если стехиометрия вещества, образуемого в результате титрования, равна 1:1, кривая титрования должна быть центральносимметрична относительно точки эквивалентности. Это свойство является важным, так как большая часть аналитических методик разработана для соединений такого рода. Кривая титрования для соединений другой стехиометрии выглядит асимметрично.
В-третьих, ионометрическое титрование применяется для анализа в следующих случаях:
для определения с погрешностью меньшей 0,5%;
для определения нескольких ионов одновременно;
для проведения анализа в присутствии таких количеств мешающих ионов, при которых определение методам градуировочного графика и стандартных добавок невозможно.
Важное место в процедуре титрования составляют математические методы нахождения точки эквивалентности. Наибольшее распространение получили 2 способа определения положения точки эквивалентности.
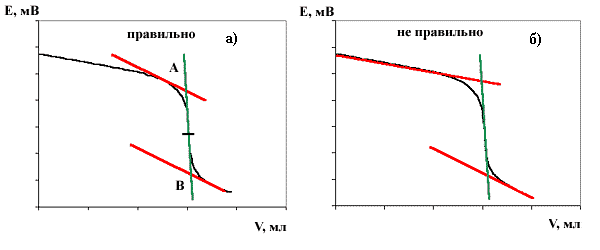
Первый способ состоит в нахождении центра симметрии кривой титрования, исходя из того, что в окрестности точки эквивалентности кривая центральносимметрична. Для нахождения центра симметрии проводится 3 прямые. Две прямые параллельны друг другу и являются касательными к некоторым участкам кривой титрования (см. на рис.2а красные линии). Чем ближе эти прямые будут находиться к точке эквивалентности, тем лучше. Третья прямая аппроксимирует точки около точки эквивалентности (см. зеленую линию). Если получившийся отрезок АB разделить пополам, то найденная точка является искомой точкой эквивалентности. Некоторые экспериментаторы предпочитают обрабатывать кривые титрования так, как это показано на рисунке 2б. Когда кривая титрования не идеально симметрична, то такая обработка результатов ошибочна, так как теряется математический смысл операции, а значит погрешность определения может быть ощутимой.
|
| Рис.2. |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Ионометрия. Метод добавок
Интерес к методу добавок в ионометрии вызывается тем, что он играет более значительную роль, чем метод добавок в других методах анализа
- Ионометрия и электродинамика
Немировский А.М.Глубокое знакомство с литературными источниками, посвященными ионометрии, выявляет фатальную склонность авторов испо
- Ионометрическое определение хлоридов в растворах хроматов
Немировский А.М.Задача определения хлоридов в хроматных растворах пришла от гальваников. Дело в том, что в травильных ваннах необходим
- Химический метод Винклера для определения растворенного кислорода
Каверин А.В.Среди методов определения концентрации растворенного кислорода самым старым, но до сих пор не потерявшим своей актуальнос
- Химико-аналитические свойства ионов d-элементов
Ионы d-элементов 1В группыРеакции обнаружения ионов меди Сu2+Действие группового реагента H2S. Сероводород образует в подкисленных раств
- Угарный газ
Физические свойства.Монооксид углерода представляет собой бесцветный и не имеющий запаха газ, малорастворимый в воде.t пл. 205 °С, t кип.
- Полярографическое определение цинка в присутствии меди
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.