Изучение взаимодействия в системе NaF-Bi2O3-BiF3 при 600 и 650 градусах Цельсия
Московский государственный университет
имени М.В. Ломоносова
Химический факультет
Изучение взаимодействия в системе
NaF-Bi2O3-BiF3при 600 и 650°С.
Курсовая работа
по неорганической химии
студента 102 группы
Домбровского Е.Н.
Научные руководители:
асп. 1 г/о Серов Т.В.
к.х.н. Ардашникова Е.И.
Преподаватель:
к.х.н. Ардашникова Е.И.
Москва 1999 год
Содержание.
I Введение ......................................................................стр. 3
II Обзор литературы .................................................................. 5
Структура флюорита ........................................................... 5
Фторид натрия .................................................................... 6
Строение.................................................................... 6
Свойства .................................................................... 6
Получение ................................................................... 7
3. Оксид висмута .................................................................... 8
Строение.................................................................... 8
Свойства ..................................................................... 10
Получение .................................................................... 10
4. Фторид висмута ................................................................... 11
Строение ..................................................................... 11
Свойства ..................................................................... 12
Получение .................................................................... 12
Система BiF3-Bi2O3 ............................................................. 13
Система NaF-BiF3 ............................................................... 16
Система NaF-Bi2O3 ............................................................. 18
Система NaF-Bi2O3-BiF3 ..................................................... 19
III Экспериментальная часть ....................................................... 21
Исходные вещества ............................................................ 21
Получение BiF3 .................................................................. 21
Приготовление образцов ..................................................... 22
Методы исследования ......................................................... 23
Основные результаты и их обсуждение ................................. 25
IV Выводы ................................................................................ 43
V Список литературы ................................................................. 44
Введение.
Твердые электролиты представляют собой вещества, проводящие электрический ток в твердом состоянии, промежуточные в строении между твердыми кристаллическими телами с фиксированным положением каждого атома или иона и жидкими электролитами, в которых нет упорядоченной структуры и все частицы подвижны.
Благодаря разупорядочению одной из подрешеток (катионной или анионной) такие вещества в определенном температурном интервале проявляют высокую ионную проводимость в твердом состоянии, что позволяет им находить широкое применение в хозяйстве: они используются как источники тока, топливные элементы (1), газовые сенсоры (например, фторпроводящие образцы системы SrF2-LaF3, легированные SrO, рекомендованы как перспективные сенсоры по кислороду (2)), генераторы кислорода (например, сложные оксидные кислородпроводящие образцы предложено использовать для отделения кислорода от других газов (3)), в качестве элементов памяти вычислительных устройств и в других областях.
В последние десятилетия высокая проводимость по ионам фтора обнаружена у ряда неорганических фторидов. По своим свойствам они не уступают многим известным твердым электролитам. Их недостаточная изученность обусловлена в большой степени значительной химической активностью при высоких температурах, а также склонностью к пирогидролизу.
Исследования в этой области привели к обнаружению в сложных фторидных системах, содержащих катионы Bi и щелочных металлов, фторпроводящих соединений и твердых растворов со структурой флюорита (4,5). Их высокая проводимость объясняется легкой поляризуемостью катионов Bi3+, что увеличивает подвижность фторид-ионов. Показано также, что замена части анионов фтора на кислород еще сильнее повышает проводимость за счет появления дополнительных вакансий в анионной подрешетке. К тому же оксофторидные материалы заметно лучше сохраняются на воздухе, тогда как чисто фторидные электролиты чрезвычайно склонны к гидролизу.
Оксофториды висмута и калия, исследованные несколько лет назад (6), менее удобны в применении, чем с натрием вследствие их гигроскопичности.
Поэтому, большой практический интерес представляет система
NaF-Bi2O3-BiF3, которой и посвящена данная работа.
Целью настоящей работы стало изучение взаимодействия в системе NaF-Bi2O3-BiF3при температурах 600 и 650°С в областях, примыкающих к BiOF и b-BiOyF3-2y.
Обзор литературы.
Структура флюорита.
Структура флюорита (природный минерал CaF2) построена из кубических гранецентрированных элементарных ячеек (рис. 1). Параметр а = 5,462 � (7). Катионы занимают положения в вершинах куба и в центрах его граней. Куб из анионов вписан в большой куб из катионов. Таким образом катионы имеют КЧ = 8 (куб), а анионы КЧ = 4 (тетраэдр).
Рис. 1. Структура флюорита.
2. Фторид натрия.
2.1 Строение.
Фторид натрия кристаллизуется в структуре типа NaCl. Пространственная группа Fm3m, параметр элементарной ячейки а = 4,634(4) � (8).
Элементарная ячейка кубическая гранецентрированная (рис. 2). При размещении ионов одного сорта в вершины и центры граней элементарной ячейки ионы другого сорта занимают середины ребер и центр куба. Анионы и катионы в такой структуре имеют шестерную координацию. Координационный полиэдр – октаэдр.
2.2 Свойства.
Фторид натрия представляет собой белое кристаллическое вещество.
Тпл = 997°С, Ткип = 1785°С.
DfH°298 = -569 кДж/моль (9).
Хорошо растворим в воде (41,3 г/л воды (10)). Взаимодействует почти со всеми фторидами металлов III – VII групп и Be с образованием фторметаллатов натрия, например:
3NaF + AlF3![]() Na3AlF6.
Na3AlF6.
При растворении в HF, а также при взаимодействии с газообразным фтороводородом образует бифторид натрия NaHF2:
NaF + HF = NaHF2.
В природе NaF встречается в виде минерала виллиомита.
2.3 Получение.
а) Нейтрализация плавиковой кислотой растворов NaOH или Na2CO3до слабокислой реакции:
Na2CO3 + 2HF = 2NaF + CO2 + H2O.
При упаривании выделяется безводный NaF.
б) Термическое разложение бифторида натрия при температуре выше 270°С (10): NaHF2![]() NaF + HF.
NaF + HF.
NaHF2 разлагается без плавления, в отличие от KHF2.
Для получения чистого NaF продажный препарат достаточно выдержать в течение нескольких часов в сушильном шкафу при температуре 150 – 200°С (11).
Рис. 2. Структура NaCl.
3. Оксид висмута (III).
3.1 Свойства.
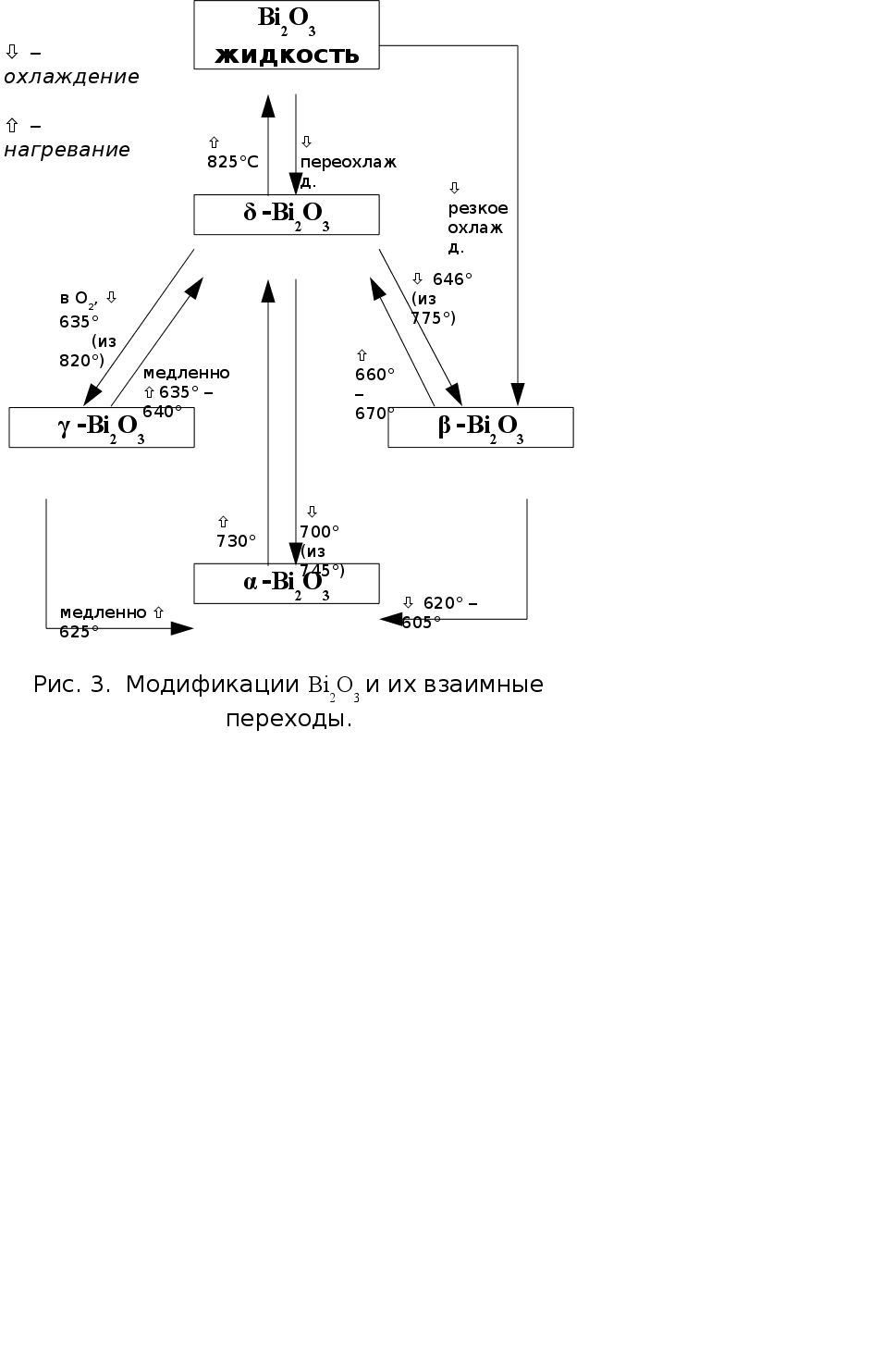
Для оксида висмута (III) известны две стабильные (a и d) и две метастабильные (b и g) модификации (рис. 3) (12).
Стехиометрическая a-форма бледно-желтого цвета устойчива при стандартных условиях и вплоть до температуры 730°С. Имеет моноклинную решетку; пр. гр. Р21/с, параметры элементарной ячейки а = 5,848 �, b = 8,166 �, c = 7,510 �, b = 113° (12).
При постепенном нагревании до 730°С a-Bi2O3 претерпевает полиморфный переход, теряя часть кислорода, и превращается в d-форму (формула Bi2O3-x, где х = 0,045-0,37). Эта модификация оранжевого цвета характеризуется кубической решеткой с параметром а = 5,66 �, пр. гр. Pn3m.
Ярко-желтая g-форма отличается избытком кислорода (формула Bi2O3+x) и представляет собой твердый раствор кислорода в оксиде висмута. Решетка его также кубическая, но по сравнению с d-Bi2O3 элементарная ячейка увеличена вдвое по всем трем направлениям. а = 10,76 � (12) (10,2501(5) � в (13)), пр. гр. I23. Наиболее устойчива g-форма при высоких давлениях кислорода. Ее можно также стабилизировать легированием оксидами кремния или свинца в форме соединений M2Bi24O39, где М = Si, Pb (12). Получить ее можно при охлаждении d-модификации под давлением О2.
b-Bi2O3, также желтого цвета, можно получить нагреванием висмутита (BiO)2CO3 или охлаждением d-формы до температуры около 640°С. При дальнейшем охлаждении она легко переходит в a-модификацию. b-Bi2O3 кристаллизуется в тетрагональной сингонии, параметры элементарной ячейки: а = 3,85 �, с = 12,25 �. Пр. гр. I4/mm. b-форма является аниондефицитной по отношению к формуле Bi2O3.
В работе (14) масс-спектральным методом исследована область гомогенности оксида висмута (III) при 1070 К. Изучением равновесия "газ – твердая фаза" в платиновой ячейке установлено, что при этой температуре оксид висмута может иметь состав от Bi2O2,8 до Bi2O3,11. Конгруэнтной сублимации при этой температуре отвечает состав Bi2O2,92±0,04.
3.2 Свойства.
d-Bi2O3 плавится при 825°С (12). Для температуры кипения в (9) приводится значение 1890°С.
DfH°298 (a-Bi2O3) = – 577 кДж/моль (9).
Оксид висмута (III) нерастворим в воде и растворах щелочей. Кислотами переводится в соли висмута (III):
Bi2O3 (тв) + 6HCl (р) = 2BiCl3 (p) + 3H2O.
b-, g- и d-модификации оксида висмута являются анионными проводниками с незначительным вкладом электронной проводимости, тогда как a-Bi2O3 – полупроводник (11).
3.3 Получение.
Наилучшим способом получения оксида висмута считается взаимодействие растворов солей висмута (III), например нитрата Bi(NO3)3 или сульфата Bi2(SO4)3, с избытком раствора щелочи:
Bi(NO3)3 + 3NaOH = Bi(OH)3Ї +3NaNO3.
В осадок выпадает гидроксид висмута, который затем обезвоживают прокаливанием:
2Bi(OH)3![]() Bi2O3 + 3H2O.
Bi2O3 + 3H2O.
4. Фторид висмута (III).
4.1 Строение.
Трифторид висмута существует в виде двух полиморфных модификаций. Устойчивой при стандартных условиях является ромбическая модификация
R-BiF3, при давлении 15±3 кбар переходящая в тисонитоподобную (Т-BiF3). При атмосферном давлении Т-BiF3 неустойчив и при отжиге легко переходит в R-BiF3 (16).
Параметры элементарной ячейки для первой из модификаций (по (15)): а = 6,565(7) �, b = 7,016(7) �, c = 4,841(5) �. R-BiF3 изоструктурен фториду иттрия (пр. гр. Pnma, Z = 4).
Атом Bi в R-BiF3 окружен восемью ближайшими атомами фтора на расстояниях 2,217 – 2,502 Г, девятый атом фтора находится на расстоянии 3,100 Г (рис. 3). Такое искажение координационной сферы атома висмута объясняется наличием стереохимически активной пары электронов на атоме висмута.
Рис. 4. Окружение атома Bi в R-BiF3.
4.2 Свойства.
Фторид висмута на воздухе малоустойчив. Уже при комнатной температуре во влажном воздухе он начинает гидролизоваться, а при повышенных температурах пирогидролиз идет до конца по схеме:
BiF3 + H2O![]() BiOyF3-2y
BiOyF3-2y![]() BiOF
BiOF![]() Bi2O3
Bi2O3
Поэтому препараты фторида висмута следует хранить без доступа влаги – в эксикаторе над Р2О5.
Температура плавления (в токе HF) составляет 757°С (16). Температура кипения – 900°С (9).
DfH°298 (BiF3) = - 899 кДж/моль (9).
4.3 Получение.
Основные способы получения чистого трифторида висмута сводятся к взаимодействию Bi2O3 или Bi(OH)3 с сильными фторирующими агентами, в качестве которых были предложены SF4, BrF3 (15) и др.
В работе (17) было предложено обрабатывать оксид или гидроксид висмута концентрированной плавиковой кислотой в платиновой чашке при нагревании. Получающийся гидрат трифторида висмута затем дегидратируют в платиновых тиглях в токе сухого фтороводорода при 300°С.
В той же работе (17) приведена еще одна методика. Трибромид висмута, получаемый прямым взаимодействием элементов, обрабатывают фторидом аммония в метанольном растворе по реакции:
BiBr3 + 4NH4F = NH4BiF4 + 3NH4Br.
Выпавший осадок тетрафторвисмутата (III) аммония отделяют, промывают эфиром и сушат при 60°С. Прокаливая его при 300°С можно получить безводный BiF3:
NH4BiF4![]() BiF3 + NH3 + HF.
BiF3 + NH3 + HF.
5. Система BiF3-Bi2O3.
Наиболее подробно данная система изучалась в (15,18). Построена фазовая диаграмма (рис. 5). В области, богатой фторидом висмута образуется твердый раствор a со структурой тисонита LaF3 с содержанием оксида 0,7 – 3,45 моль. % (0,02ЈyЈ0,1 в формуле BiOyF3-2y). По мере увеличения доли Bi2O3 параметры гексагональной ячейки изменяются следующим образом: а уменьшается от 7,076(7) � до 7,053(7) �, а "с" увеличивается от 7,313(7) � до 7,338(7) �. При содержании оксида 3,45 – 6 моль. % образуется ряд упорядоченных фаз со структурой, производной от тисонита. Индицирование их рентгенограмм затруднено вследствие близости их строения. На диаграмме (рис. 5) для легкости восприятия вся область составов 0,7 – 6 % Bi2O3 изображена как твердый раствор a (15).
В области содержания оксида 20 – 33 мольных % образуется ряд упорядоченных фаз со структурой, производной от флюорита. В работе (15) перечислены их составы: 20; 21; 22,5; 25 и 33 моль. % Bi2O3 и рассчитаны параметры элементарных ячеек, приведенные в таб. 1. В работе (19) уточнен состав последней из них – Bi7F11O5 (31,25 моль. % Bi2O3). Эта фаза построена из упорядоченных колончатых кластеров (19). При температурах 290 – 410°С все фазы претерпевают полиморфный переход (происходит разупорядочение), образуя анионизбыточный флюоритовый твердый раствор, т.н. b-фазу. Закалить ее, то есть получить при комнатной температуре авторам (15) не удалось. b-фаза – самое тугоплавкое соединение в системе: максимальная температура плавления составляет 995°С (15).
При эквимолярном соотношении Bi2O3 и BiF3 образуется стехиометрический оксофторид BiOF, изоструктурный PbFCl. Соединение кристаллизуется в тетрагональной сингонии с параметрами элементарной ячейки а = 3,750(5) �, с = 6,228(9) �. Авторы (15) предполагают наличие полиморфного перехода BiOF в кубическую флюоритоподобную модификацию при 620°С.
Таб. 1. Рентгенографические характеристики оксофторидных фаз висмута со структурой, производной от флюорита.
Доля Bi2O3, | Сингония | Параметры | |||
моль. % | a, � | b, � | c, � | , ° | |
20* | моноклинная | 4,09(1) | 5,89(1) | 4,13(1) | 90,3(1) |
21* | ромбическая | 4,14(1) | 4,16(1) | 5,88(1) | — |
22,5* | тетрагональная | 4,14(1) | — | 5,82(1) | — |
25* | ромбическая | 4,12(1) | 4,10(1) | 5,83(1) | — |
33* | ромбическая | 5,760(9) | 5,569(8) | 6,120(9) | — |
31,25** | моноклинная | 13,5238(3) | 5,5285(1) | 9,1886(2) | 96,171(1) |
* по (15). ** по (19).
В области содержания оксида висмута 60-68% при температурах выше 450°С образуется гексагональный твердый раствор g. Он имеет две модификации – g и g', обратимо переходящие одна в другую при 590-595°С. Для состава, содержащего 67 моль. % Bi2O3, закаленного от 650°С, в (15) приводятся параметры гексагональной решетки а = 8,33(1) �, с = 19,03(1) �.
При мольной доле Bi2O3, равной 75%, образуется стехиометрическое соединение Bi7O9F3 (единственный из оксофторидов висмута желтого цвета). Для него известны как минимум два полиморфных перехода при температурах 505 и 565°С. В работе (20) это соединение изучено особенно подробно. Установлена его электропроводность, составляющая при 500К s = 5·10-5 Ом-1см-1. Указано, что с повышением температуры электропроводность быстро растет. Показано также, что проводимость обеспечена практически в равной степени ионами фтора и кислорода. Структура соединения не описана.
Из состава, содержащего 80 моль. % Bi2O3 выше 515°С образуется соединение Bi3O4F. Проиндицировать его рентгенограммы авторам (15) не удалось, его структура также не определена.
При температурах выше 620°С значительные количества (до примерно 14 моль. % при 790°С) фторида висмута растворяются в d-Bi2O3, стабилизируя его и образуя твердый раствор d-BiOyF3-2y.
Рис. 5. Фазовая диаграмма системы BiF3-Bi2O3.
6. Система NaF-BiF3.
Подробное изучение сложных фторидов висмута и щелочных металлов проводилось неоднократно (4,5,15) (рис. 6).
Соединение NaBiF4 впервые было получено авторами (21) отжигом соответствующей смеси NaF и BiF3 в платиновом тигле в атмосфере гелия при 450°С. Тетрафторвисмутат натрия изоструктурен гагариниту b-NaYF4, параметры элементарной ячейки его гексагональной решетки: а = 6, 144 �, с = 3,721 �. По данным (15) соединение имеет узкую область гомогенности (от 49 до 51 моль. % BiF3), в пределах которой "а" увеличивается от 6,131(5) � до 6,147(4) �, а "с" уменьшается от 3,720(3) � до 3,706(3) �.
При 450°С NaBiF4 претерпевает полиморфный переход, образуя кубический флюоритоподобный твердый раствор Na1-xBixF1+2x. Впервые этот раствор был исследован в (4).
По данным (15) границы области гомогенности лежат в пределах 49 – 70 моль. % BiF3. Для образцов, закаленных от 500°С, параметр элементарной ячейки растет от 5,686(4) � для состава, содержащего 60% BiF3, до 5,763(4) � (70 моль. % BiF3). Образцы с долей BiF3 50 – 60 моль. % при закаливании дают две фазы: флюоритоподобный твердый раствор и NaBiF4.
Интересно, что соединения МBiF4 для М = К, Rb, Tl имеют структуру флюорита при любых температурах от комнатной до плавления (5). Вещества были изучены в работе (5) в качестве анионных проводников. Получали образцы изотермическим отжигом при 550°С в течение 12 часов.
Рис. 6. Фазовая диаграмма системы NaF-BiF3.
7. Система NaF-Bi2O3.
Данных по системе в литературе не обнаружено.
8. Система NaF-Bi2O3-BiF3.
Подробное исследование данной системы проведено в работе (11). Изучено изотермическое сечение системы при температуре 450°С (рис. 7). Предложена схема триангуляции.
Основным объектом изучения стала обширная область гомогенности флюоритоподобного твердого раствора, имеющая избыток анионов по отношению к формуле МХ2, (названная Ф) на основе чисто фторидного раствора Na1-xBixF1+2x. Область простирается в направлении b-BiOyF3-2y до содержания оксида висмута примерно 35 моль. %. Минимальное содержание NaF в Ф при данной температуре – около 13 моль. %. При более низком содержании NaF образцы двухфазны.
Методом импедансной спектроскопии измерена проводимость образцов. По своим проводящим характеристикам эти вещества не уступают многим используемых твердых электролитов, а работать с ними можно при достаточно низких температурах. Поэтому авторы (11) предложили использовать эти вещества в качестве твердых анионпроводящих материалов.
Началом исследования системы послужила работа (22). В ней исследованы образцы разреза Bi2O3-NaBiF4, закаленные от 400°С (рис. 8). Показано, что в треугольнике NaF-BiOF-NaBiF4 новых фаз не образуется, а разрезы NaF-BiOF и BiOF-NaBiF4 являются квазибинарными. Заметной области гомогенности (і3 моль. % Bi2O3) на основе NaBiF4 не обнаружено.
В работе (23) исследована каталитическая активность соединений NaBi3O4Г2 (где Г – F, Cl, Br) к избирательному окислению метана до высших углеводородов. Указано, что образцы данного состава, приготовленные твердофазным синтезом в платиновых ампулах при температурах 750 – 900°С из смесей Na2O, NaГ и BiOГ, были однофазными. Каталитические свойства образцов изучали при 600 – 750°С, причем фторидные образцы показали сравнительно худшие свойства. Фазы имеют слоистую структуру типа Силлена, параметры более подробно даны в материалах конгресса (24), которые найти не удалось.
Рис.7. Схема изотермического сечения
системы NaF-Bi2O3-BiF3 при 450°С.
Экспериментальная часть.
1. Исходные вещества.
В качестве исходных веществ использовались NaF и Bi2O3 марки «чда», Bi(OH)3 марки «хч» и BiF3, синтезированный нами.
NaF предварительно обезвоживали при 200°С в течение суток (11).
Продажный препарат a-Bi2O3 выдерживали 12 часов в сушильном шкафу при температуре 800°С до полного удаления следов влаги.
Исходные вещества хранили в закрытых бюксах в эксикаторе над P2O5. Идентификация проводилась методом РФА.
2. Получение BiF3.
В качестве исходного препарата висмута был взят гидроксид. Вещество нагревали с концентрированной плавиковой кислотой в течение нескольких часов. В результате реакции:
Bi(OH)3 + 3HF = BiF3·aqЇ + 3H2O
после упаривания оставался осадок гидратированного фторида висмута, который обезвоживали в токе сухого HF в течение 4 часов при температуре 350°С в приборе (рис. 8), состоящем из источника фтористого водорода (медная реторта с NaHF2), медной трубки, расположенной в ней никелевой лодочки с веществом и поглотительной системы, заполненной твердой щелочью.
Идентификация безводного BiF3 была проведена методом РФА.
Вещество также хранили в закрытом бюксе в эксикаторе над P2O5.
Рис. 8. Прибор для обезвоживания гидратированного фторида висмута в токе газообразного HF.
3. Приготовление образцов.
Образцы для изучения системы NaF-Bi2O3-BiF3 были приготовлены методом твердофазного синтеза. Навески исходных веществ, взятые в необходимых соотношениях (таб. 2), взвешивали на аналитических весах "Sartorius" с точностью 0,2 мг.
Отпрессованные в таблетки образцы отжигали в запаянных медных ампулах, заполненных аргоном, с закаливанием путем опускания ампул в холодную воду. Условия отжигов приведены в таб. 3.
Нумерация образцов, проставленная на рентгенограммах, является сквозной для нескольких работ лаборатории, соответствия номеров показаны в таб. 4.
Таблица 2. Навески для приготовления образцов.
Мольные % | Массы, г | Анион. | |||||
| № | NaF | BiO1.5 | BiF3 | NaF | BiO1.5 | BiF3 | изб. |
1 | 15 | 22,67 | 62,33 | 0,0056 | 0,0470 | 0,1474 | 0,36 |
2 | 10 | 36 | 54 | 0,0036 | 0,0724 | 0,1240 | 0,26 |
3 | 10 | 32 | 58 | 0,0036 | 0,0646 | 0,1336 | 0,32 |
4 | 10 | 29,33 | 60,67 | 0,0036 | 0,0588 | 0,1390 | 0,36 |
5 | 5 | 36 | 59 | 0,0017 | 0,0685 | 0,1279 | 0,36 |
6 | 5 | 38,67 | 56,33 | 0,0018 | 0,0777 | 0,1292 | 0,32 |
7 | 5 | 42,67 | 52,33 | 0,0017 | 0,0821 | 0,1150 | 0,26 |
8 | 5 | 30 | 65 | 0,0017 | 0,0566 | 0,1400 | 0,45 |
9 | 10 | 23,33 | 66,67 | 0,0036 | 0,0464 | 0,1515 | 0,45 |
10 | — | 49,33 | 50,67 | — | 0,0917 | 0,1074 | 0,26 |
11 | — | 42,67 | 57,33 | — | 0,0785 | 0,1205 | 0,36 |
12 | — | 66,67 | 33,33 | — | 0,1266 | 0,0723 | 0 |
13 | 5 | 63,33 | 31,67 | 0,0018 | 0,1244 | 0,0710 | — |
14 | 5 | 57,14 | 37,86 | 0,0018 | 0,1112 | 0,0842 | — |
4. Методы исследования.
Исследование фазового состава образцов было проведено методом рентгенофазового анализа (РФА). РФА проводили в камере-монохроматоре типа Гинье с эффективным сечением 228 мм, излучение Cu Ka1.
Рентгенограммы некоторых образцов промеряли на компараторе с точностью 0,001 мм. Интенсивность линий определяли визуально по пятибалльной шкале.
Индицирование методом подбора изоструктурного соединения и уточнение параметров элементарной ячейки методом наименьших квадратов проводили с использованием программ Powder.
В качестве внутреннего стандарта при индицировании использовался германий (параметр кубической решетки типа алмаза – а = 5,658 � (7)).
Таблица 3. Условия отжигов и результаты РФА.
№ образца | № отжига | Время отжига, ч | Температура, °С | Фазовый состав |
| 1 | I | 6 | 600 | Ф |
| 2 | I | 6 | 600 | Ф |
| 3 | I | 6 | 600 | Ф |
| 4 | I | 6 | 600 | Ф |
| 5 | I | 6 | 600 | Ф |
| 6 | I | 6 | 600 | Ф |
| 7 | I | 12 | 600 | Ф + М |
II | 12 + 14* | 600 + 650* | Ф + М | |
| 8 | I | 12 | 600 | Ф + М |
II | 12 + 14* | 600 + 650* | Ф | |
| 9 | I | 12 | 600 | Ф + М |
II | 12 + 14* | 600 + 650* | Ф + М | |
| 10 | I | 6 | 600 | М + … |
II | 6 + 14* | 600 + 650* | М + … | |
| 11 | I | 6 | 600 | М + … |
II | 6 + 14* | 600 + 650* | М + … | |
| 12 | I | 12 | 600 | М + … |
II | 12 + 14* | 600 + 650* | М + … | |
III | 12 + 17* | 600 + 500* | М + … | |
| 13 | I | 12 + 14* | 600 + 650* | Ф' |
II | 12 + 17* | 600 + 500* | Ф' + М | |
| 14 | I | 12 + 14* | 600 + 650* | Ф' + М |
II | 12 + 17* | 600 + 500* | М |
* Дополнительный отжиг. Первое время соответствует первой температуре, второе – второй.
Таблица 4. Соответствия нумераций образцов.
Номер в данной работе | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| Номер на рентгенограммах | 34 | 28 | 44 | 45 | 46 | 47 | 39 | 40 | 41 | 48 | 49 | 4 | 42 | 43 |
5. Основные результаты и их обсуждение.
Результаты РФА всех синтезированных образцов приведены в таб. 3.
По результатам РФА образцы №№ 1-6 после шестичасового отжига при 600°С стали однофазными, тогда как при более низкой температуре (450°С) образцы № 1 и № 2 давали две фазы (Ф и твердый раствор на основе b-BiOyF3-2y) (11). Таким образом обнаружено расширение области гомогенности флюоритоподобного твердого раствора Ф по сравнению с 450°С (11) в направлении b-BiOyF3-2y (рис. 9).
Образцы №№ 7, 8 и 9 после I отжига были многофазными. После II отжига образец № 8 содержал только фазу Ф, а №№ 7 и 9 – две фазы (для образца № 9 проведен визуальный РФА, результаты РФА для № 7 в таб. 5). Т.е. при дальнейшем повышении температуры область гомогенности Ф расширяется еще сильнее (рис. 9).
Таблица 5. Рентгенографические данные
для образца № 7(II).
N | L(N) | 2*TH | D | Q | I/I0 | Фаза |
| 1 | 57.206 | 26.584 | 3.35025 | 890.93 | 5 | Ф |
| 2 | 62.878 | 29.410 | 3.03436 | 1086.09 | 0 | М |
| 3 | 65.668 | 30.800 | 2.90049 | 1188.65 | 2 | Ф, М |
| 4 | 68.802 | 32.362 | 2.76403 | 1308.93 | 0 | М |
| 5 | 90.617 | 43.225 | 2.09123 | 2286.62 | 0 | М |
6 | 92.437 | 44.131 | 2.05039 | 2378.64 | 3 | Ф, М |
7 | 105.271 | 50.516 | 1.80516 | 3068.82 | 0 | М |
| 8 | 108.755 | 52.249 | 1.74929 | 3267.96 | 2 | Ф, М |
9 | 113.814 | 54.765 | 1.67473 | 3565.43 | 0 | Ф |
10 | 132.772 | 64.188 | 1.44973 | 4758.05 | 0 | Ф, М |
11 | 145.874 | 70.696 | 1.33137 | 5641.59 | 0 | Ф, М |
Рис. 9. Схема расположения образцов
на сечении системы NaF-Bi2O3-BiF3.
Результаты индицирования рентгенограмм образцов №№ 1, 4, 5, 7(II) и 8(II), лежащих на разрезах NaxBi1-x(O,F)2.36 и Na0.05Bi0.95(O,F)2+y приведены в таблицах 6–10. Были рассчитаны параметры элементарной кубической ячейки фазы Ф, помещенные в таб. 11,12.
Параметр элементарной ячейки кубической фазы Ф в образцах №№ 1 и 4 хорошо укладывается в линейную зависимость параметра от состава, полученную в (11) (рис. 10), тогда как параметр элементарной ячейки образца № 5 не лежит на этой прямой. Но параметр его ячейки в пределах ошибки совпадает с параметром четвертого образца. Границу твердого раствора Ф, таким образом, следует провести через точку пересечения двух линий, т.е. при мольной доле NaF, равной примерно 11%. При меньших же концентрациях NaF образцы, по-видимому, двухфазны. Состав твердого раствора Ф в них не изменяется и соответствует граничной концентрации. Вероятно, незначительное количество примесной фазы, присутствующая в образцах № 4 и 5, не дает рефлексов на рентгенограмме, т.к. чувствительность метода РФА не превышает 8 масс. %.
Параметры элементарной кубической ячейки фазы Ф в образцах № 5, 7(II) и 8(II) (по разрезу Na0.05Bi0.95(O,F)2+y) изменяются незначительно (толстая линия на графике, рис. 11), что в целом укладывается в общую закономерность – с уменьшением содержания натрия влияние анионного избытка на изменение параметра ослабевает (11) (рис. 11). Вероятно, это взаимное влияние катионов Na и внедренных анионов связано с возникновением ассоциатов Na и избыточных анионов.
Образцы №№ 10 и 11 и после первого, и после повторного отжига (таб. 3) по данным визуального РФА были многофазными. В образцах присутствует фаза на основе моноклинного Bi7F11O5 (19), обозначенная М. Таким образом закалить предположительно кубический высокотемпературный твердый раствор на основе b-BiOyF3-2y (15) не удалось.
Единственная фаза в образце № 14(II), а также одна из двух фаз в образцах № 7(I), № 14(I) и № 13(II), проиндицирована в моноклинной сингонии с параметрами, близкими к данным в (19) для фазы Bi7F11O5. Результаты индицирования приведены в таб. 16, 17, 18 и 19 соответственно, параметры – в таб. 20. Параметры ее ячейки в образцах различаются, из чего следует, что на основе фазы Bi7F11O5 образуется твердый раствор М.
Таблица 6. Результаты индицирования рентгенограммы фазы Ф в образце № 1.
Сингония – кубическая.
Параметр ячейки: а= 5.785(1) �
N | 2*TH | D | I/I0 | Qobs | h | k | l | Qcalc | dQ |
| 1 | 26.651 | 3.34190 | 5 | 895.39 | 1 | 1 | 1 | 896.5 | -1.1 |
| 2 | 30.884 | 2.89282 | 3 | 1194.97 | 0 | 0 | 2 | 1195.3 | -0.3 |
| 3 | 44.242 | 2.04548 | 4 | 2390.07 | 0 | 2 | 2 | 2390.6 | -0.5 |
| 4 | 52.407 | 1.74440 | 4 | 3286.31 | 1 | 1 | 3 | 3287.1 | -0.7 |
| 5 | 54.943 | 1.66973 | 2 | 3586.82 | 2 | 2 | 2 | 3585.9 | 0.9 |
| 6 | 64.382 | 1.44583 | 1 | 4783.73 | 0 | 0 | 4 | 4781.2 | 2.6 |
| 7 | 70.942 | 1.32736 | 3 | 5675.77 | 1 | 3 | 3 | 5677.6 | -1.9 |
Таблица 7. Результаты индицирования рентгенограммы фазы Ф в образце № 4.
Сингония – кубическая.
Параметр ячейки: а= 5.799(1) �
N | 2*TH | D | I/I0 | Qobs | h | k | l | Qcalc | dQ |
| 1 | 26.577 | 3.35103 | 5 | 890.52 | 1 | 1 | 1 | 892.1 | -1.6 |
| 2 | 30.814 | 2.89928 | 4 | 1189.65 | 0 | 0 | 2 | 1189.5 | 0.2 |
| 3 | 37.976 | 2.36729 | 0 | 1784.41 | 1 | 1 | 2 | 1784.2 | 0.2 |
| 4 | 44.135 | 2.05017 | 4 | 2379.14 | 0 | 2 | 2 | 2379.0 | 0.2 |
| 5 | 52.270 | 1.74864 | 5 | 3270.40 | 1 | 1 | 3 | 3271.1 | -0.7 |
| 6 | 54.788 | 1.67409 | 3 | 3568.16 | 2 | 2 | 2 | 3568.5 | -0.3 |
| 7 | 64.172 | 1.45005 | 2 | 4755.93 | 0 | 0 | 4 | 4758.0 | -2.0 |
| 8 | 70.775 | 1.33009 | 3 | 5652.49 | 1 | 3 | 3 | 5650.1 | 2.4 |
Таблица 7. Результаты индицирования рентгенограммы фазы Ф в образце № 5.
Сингония – кубическая.
Параметр ячейки: а= 5.799(1) �
N | 2*TH | D | I/I0 | Qobs | h | k | l | Qcalc | dQ |
| 1 | 26.587 | 3.34980 | 5 | 891.17 | 1 | 1 | 1 | 892.0 | -0.8 |
| 2 | 30.816 | 2.89904 | 4 | 1189.85 | 0 | 0 | 2 | 1189.3 | 0.5 |
| 3 | 37.963 | 2.36811 | 0 | 1783.18 | 1 | 1 | 2 | 1784.0 | -0.8 |
| 4 | 44.136 | 2.05013 | 4 | 2379.23 | 0 | 2 | 2 | 2378.6 | 0.6 |
| 5 | 52.288 | 1.74807 | 5 | 3272.53 | 1 | 1 | 3 | 3270.6 | 1.9 |
| 6 | 54.776 | 1.67440 | 3 | 3566.80 | 2 | 2 | 2 | 3567.9 | -1.1 |
| 7 | 64.179 | 1.44990 | 2 | 4756.88 | 0 | 0 | 4 | 4757.2 | -0.4 |
| 8 | 70.751 | 1.33048 | 3 | 5649.14 | 1 | 3 | 3 | 5649.2 | -0.1 |
Таблица 9. Результаты индицирования рентгенограммы фазы Ф в образце № 7(II).
Сингония – кубическая.
Параметр ячейки: а= 5.801(1) �
N | 2*TH | D | I/I0 | Qobs | h | k | l | Qcalc | dQ |
| 1 | 26.584 | 3.35025 | 5 | 890.93 | 1 | 1 | 1 | 891.4 | -0.4 |
| 2 | 30.800 | 2.90049 | 2 | 1188.65 | 0 | 0 | 2 | 1188.5 | 0.2 |
| 3 | 44.131 | 2.05039 | 3 | 2378.64 | 0 | 2 | 2 | 2377.0 | 1.6 |
| 4 | 52.249 | 1.74929 | 2 | 3267.96 | 1 | 1 | 3 | 3268.4 | -0.4 |
| 5 | 54.765 | 1.67473 | 0 | 3565.43 | 2 | 2 | 2 | 3565.5 | -0.1 |
| 6 | 64.188 | 1.44973 | 0 | 4758.05 | 0 | 0 | 4 | 4754.0 | 4.1 |
| 7 | 70.696 | 1.33137 | 0 | 5641.59 | 1 | 3 | 3 | 5645.4 | -3.8 |
Таблица 10. Результаты индицирования рентгенограммы фазы Ф в образце № 8(II).
Сингония – кубическая.
Парамет
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Изучение химического равновесия и принципа Ле Шателье в 9 классе с использованием компьютера
Е.А.Алферова, Е.Ю.Раткевич, Г.Н.МансуровИзучение химического равновесия и принципа Ле Шателье в 9 классе с использованием компьютераОдни
- Инертные газы
Британская Международная ШколаРеферат по химии“Инертные газы и их свойства”Ученика 9б классаСоколенко Алексея Руководитель: Черныше
- Использование альтернативных источников энергии
Во второй половине ХХ столетия перед человечеством восстала глобальное проблема – это загрязнение окружающей среды продуктами сгоран
- Исследование свойств хрома и его соединений
Министерство образования Российской ФедерацииГИМНАЗИЯ №1Кафедра ХимииТВОРЧЕСКАЯ РАБОТАИССЛЕДОВАНИЕ СВОЙСТВ ХРОМА И ЕГО СОЕДИНЕНИЙП
- Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах
Министерство общего и профессионального образованияРоссийской ФедерацииКабардино-Балкарский Ордена Дружбы народов Государственный
- Исследование способов введения белковых компонентов в синтетический полиизопрен
Министерство Образования Российской ФедерацииМосковская Государственная АкадемияТонкой Химической ТехнологииИм. М. В. ЛомоносоваКаф
- Исследование электрохимического поведения ионов самария в хлоридных и хлоридно-фторидных расплавах
Министерство общего и профессионального образования РФКабардино-Балкарский Государственный Университет им. Х.М. БербековаХимико-биол
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

