Изучение химического равновесия и принципа Ле Шателье в 9 классе с использованием компьютера
Е.А.Алферова, Е.Ю.Раткевич, Г.Н.Мансуров
Изучение химического равновесия и принципа Ле Шателье в 9 классе с использованием компьютера
Одним из приемов активизации мыслительной деятельности учащихся на уроках химии является моделирование химического эксперимента на базе компьютерной технологии (1-5). Это ни в коем случае не заменяет традиционные практические и лабораторные работы, предусмотренные школьной программой по химии, а лишь дополняет экспериментальную часть обучения, дает возможность более рационально и доходчиво организовать изучение таких тем по химии, для которых демонстрационный эксперимент невозможен в условиях школьной практики (выделение вредных, ядовитых веществ, отсутствие дорогостоящих, редких реактивов, демонстрация взрывчатых веществ, моделирование промышленных реакторов для производства химических веществ и др.). Применение компьютера в такой ситуации может оказаться тем единственным техническим средством, которое позволит обеспечить оптимальные условия восприятия изучаемого материала.
В качестве примера применения комплексного моделирования рассмотрим проведение урока на тему «Обратимые химические реакции» (9 класс). Учитель сообщает, что реакции могут быть необратимые и обратимые. Необратимые реакции протекают в одном направлении до полного превращения взятых в стехиометрическом соотношении исходных веществ в продукты реакции. При обратимых химических процессах образующиеся продукты реакции немедленно начинают превращаться в исходные вещества, т.е. реакции протекают одновременно в двух направлениях - прямом (со скоростью v1) и обратном (со скоростью v2). При выравнивании скоростей протекания этих реакций (v1=v2) в системе устанавливается химическое равновесие. Примером такого равновесия является реакция синтеза аммиака из водорода и азота:
![]()
Следовательно, в состоянии равновесия две реакции - прямая (синтез аммиака) и обратная (разложение аммиака) протекают одновременно и с одинаковыми скоростями, а концентрации исходных веществ и продуктов реакции не изменяются во времени. Схематически изменение скорости прямой и обратной реакций во времени, а также достижение состояния химического равновесия можно представить в следующем виде (рис.1):
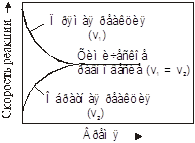
Рис.1. Достижение состояния химического равновесия в системе.
В зависимости от внешних воздействий (изменение концентрации одного или нескольких компонентов реакции, температуры или давления) рассматриваемая реакция может смещаться как в сторону синтеза, так и в сторону разложения (диссоциации) аммиака.
Посмотрим, например, как влияет изменение концентрации реагентов на состояние химического равновесия. После изменения концентрации какого-либо компонента равновесной системы (осуществляется нажатием соответствующих кнопок клавиатуры компьютера) на экране монитора можно наблюдать процесс смещения равновесия. Допустим, мы уменьшили концентрацию водорода. Скорость прямой реакции (v1) уменьшилась, а скорость обратной (v2) - увеличилась; равновесие сместилось влево. Если же уменьшить концентрацию аммиака, то, на экране монитора мы увидим, что равновесие сместится вправо, т.е. в сторону синтеза аммиака.
Задаем учащимся вопрос: за счет чего система самопроизвольно может восстановить равновесие, если в результате внешнего воздействия уменьшилась концентрация одного из компонентов? Проанализировав наблюдаемую на экране монитора динамику смещения равновесия, учащиеся без труда придут к заключению, что равновесие смещается в направлении той реакции при которой это удаленное вещество образуется. Эта реакция равновесной системы будет как бы противодействовать внешнему воздействию.
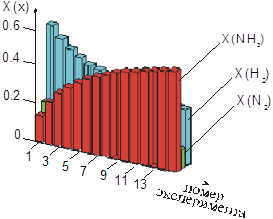
Затем обращаем внимание учащихся на то, как влияет изменение давления на систему, находящуюся в состоянии равновесия. Нажатием клавиши на клавиатуре компьютера учитель подает команду на повышение давления в системе - учащиеся наблюдают на экране монитора динамику построения гистограммы (рис.2)(1) в процессе установления равновесия при каждом последующем повышении давления и графика влияния давления на содержание реагирующих веществ и продуктов реакции после достижения состояния равновесия (рис.3). Анализируя рисунки 2 и 3, учащиеся приходят к выводу, что с увеличением давления молярная доля аммиака (X(NH3)) увеличивается, а водорода (Х(H2)) и азота (Х(N2)) - уменьшается, т.е. равновесие смещается в сторону синтеза аммиака.
|
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Инертные газы
Британская Международная ШколаРеферат по химии“Инертные газы и их свойства”Ученика 9б классаСоколенко Алексея Руководитель: Черныше
- Использование альтернативных источников энергии
- Исследование свойств хрома и его соединений
- Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах
- Исследование способов введения белковых компонентов в синтетический полиизопрен
- Исследование электрохимического поведения ионов самария в хлоридных и хлоридно-фторидных расплавах
Министерство общего и профессионального образования РФКабардино-Балкарский Государственный Университет им. Х.М. БербековаХимико-биол
- Исследования электролитов кадмирования
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.