Производство синтетического пантотената кальция (витамина В3)
Пантотеновая кислота (витамин В3) открыта Р. Вильямсом в 1933 г. Она была им охарактеризована как стимулятор роста дрожжей. Название свое витамин В3 получил от греческого термина "вездесущий", так как пантотеновая кислота была обнаружена почти во всех растительных и животных тканях. Хорошими источниками витамина В3 являются дрожжи, отруби риса, печень. В печени содержание пантотеновой кислоты составляет 10 мг в 1 кг. В 1939 г. было установлено, что цыплячий фактор и пантотеновая кислота идентичны. При недостатке пантотеновой кислоты цыплята заболевают пеллагрой; вследствие этого пантотеновая кислота вначале была названа цыплячьим фактором . Установлено, что добавление в рацион домашней птицы этого фактора приводит к значительному увеличению их массы и к повышению яйценоскости. В 1945—1947 гг. Липманом с сотрудниками был открыт коэнзим А (от слова ацетилирование), участвующий в ацетилировании холина в ацетил-холин и в других реакциях ацетилирования, причем было доказано, что зтот коэнзим содержит пантотеновую кислоту. Дальнейшее изучение показало, что в состав молекулы коэнзима А входят монофосфорный эфир пантотеновой кислоты, адениннуклеотид и 2-меркаптоэтиламин. Кофермент А также участвует в окислительном распаде жирных кислот и играет большую роль в образовании фосфолипидов. Пантотеновая кислота благоприятно влияет на водный обмен, на усвоение глюкозы. Имеется также указание на ее защитные действия при радиоактивном облучении. Таким образом, пантотеновая кислота имеет широкие перспективы применения в профилактической и клинической практике, а также в сельском хозяйстве. Суточная потребность человека в пантотеновой кислоте составляет 5—12 мг . При конденсации пантотеновой кислоты с b-меркаптоэтиламином образуется пантотетин, который в 100 раз активнее пантотеновой кислоты
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ВИТАМИНА В3
Пантотеновая кислота представляет собой производное b-аланина и пан-толактона (a-окси-b,b-диметил-g-бутиролактона).
Химическая формула пантотеновой кислоты
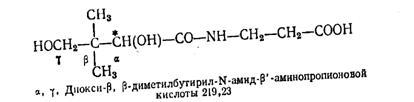
Пантотеновая кислота имеет один асимметрический атом углерода (обозначен звездочкой), вследствие чего она имеет два оптических антипода D(+) и L(-) и рацемат.
Биологической активностью обладает правовращающая D(+)-пантотеновая кислота, левовращающая - биологически неактивна. Рацематическая пантотеновая кислота обладает 50% активности правовращающей пантотеновой кислоты.
D(+)-Пантотеновая кислота — маслянистое вещество, растворимое в воде., спирте, уксусной кислоте, нерастворима в хлороформе, бензоле удобнее употреблять в виде кристаллических солей натрия и кальция. D-Пантотенат кальция имеет температуру плавления 193,5—195° С; хорошо растворим в воде, нерастворим в органических растворителях, мало в спирте. Кристаллы обладают гигроскопичностью.
D-Пантотенат натрия представляет собой сильно гигроскопические иглы с температурой плавления 121—122° С (с разложением)/
Пантотеновая кислота была идентифицирована следующими реакциями: этерификация ее метиловым спиртом или диазометаном дает сложный эфир, который омыляется с освобождением пантотеновой кислоты
![]()
Образование монометилового эфира указывает на то, что пантотеновая кислота одноосновная. При ее ацилировании образуется диацильное производное, что свидетельствует о наличии в молекуле двух гидроксильных групп:
![]()
При щелочном гидролизе пантотеновая кислота расщепляется на b-аланин и a, g-диокси-b, b-диметилмасляную кислоту по схеме:
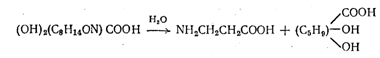
Диоксикислота была выделена в виде кристаллического оксилактона после нагревания подкисленного раствора н его экстракции . Строение оксилактона, как a-окси-b, b-диметил-g-бутиролактон, было доказано превращением его в а, а-димстнл-р-окснпронионопую кислоту.
Таким образом, к 1940 г. было окончательно установлено строение пантотеновой кислоты. В соответствии со своей химической структурой пантотеновая кислота может образовать простые и сложные эфиры по окси- и карбоксильным группам, хлор ангидриды, амиды и другие соединения. С холином образует комплекс, обладающий; биологическими свойствами обоих витаминов. Устойчива к кислороду воздуха. Наиболее важное биокаталитическое действие пантотеновая кислота проявляет в составе коферментных и ферментных систем (реакции ацетилирования хо-лина, уксуоной кислоты, аминов, спиртов). Простейшим биологически активным коферментом является пантетеин, который представляет собой продукт конденсации пантотеновой кислоты и 2-меркапто-этиламина и имеет следующую химическую структуру
![]()
Пантетеин является ростовым фактором молочнокислых бактерий .
Самым ответственным и наиболее сложным по химической структуре биологически активным производным пантотеновой кислоты является кофермент А, катализирующий различные реакции переноса и присоединения ацильных остатков в процессах жирового и углеводного обмена. Активной группой кофермента, осуществляющей эти реакции, является сульфогидрильная группа 2-меркаптоэтиламина. Строение кофермента А было изучено реакциями его гидролитического расщепления; на основании полученных данных установлена следующая химическая формула:
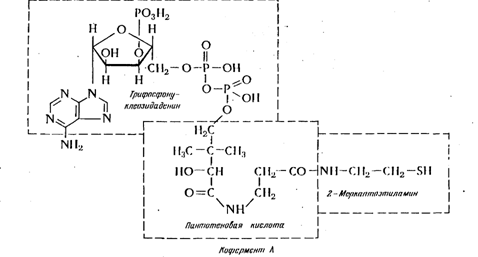
Из химической формулы видно, что в коферменте А пантотеновая кислота карбоксильной группой связана с 2-меркаптоэтиламином, а g-оксигруппой с трифосфонуклеозидаденином.
МЕТОДЫ СИНТЕЗА ПАНТОТЕНОВОЙ КИСЛОТЫ И ВЫБОР РАЦИОНАЛЬНОГО МЕТОДА ДЛЯ ПРОИЗВОДСТВА
Наивысшей биологической активностью (100%) обладает правовращающая (+)-пантотеновая кислота; а рацемическая имеет лишь 50% активности. В связи с этим целесообразно рассмотреть вопрос о выборе схем синтеза обоих препаратов.
Установлено строение пантотеновой кислоты как аланида, a, g-диокси-b, b-диметил масляной кислоты и осуществлен синтез. В основу синтеза принята реакция конденсации двух компонентов — эфиров или солей b-аланина и алифатической диоксикислоты - a,g-диокси-b,b-диметил-g-бутиролактона (пантолактона).
В полученном продукте реакции b-аланин связан с безазотистой частью молекулы пептидной связью. Синтез пантотеновои кислоты был одновременно осуществлен различными исследователями но этой же рсакцнн .
Таким образом, синтез пантотеноион кислоты сводится к следующим стадиям: а) синтезу b-аланина, б) синтезу пантолактона и в) конденсации этих веществ. Особо стоит вопрос о синтезе D(—)-пантолактона, необходимого для синтеза Д(+) пантотеновой кислоты. Рассмотрим известные варианты указанных стадии синтеза пантотеновой кислоты.
СИНТЕЗ b-АЛАНИНА (b-АМИНОПРОПИОНОВОЙ КИСЛОТЫ)
Существует несколько методов синтеза b-аланина, различающихся по реакции образования аминогруппы, а именно:
1. Из имида янтарной кислоты (сукцинимида) по реакции Гофмана при взаимодействии с гипохлоритом или гипобромитом натрия или калия в присутствии щелочи по схеме:
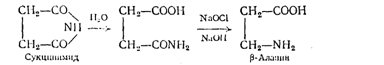
Выход b-аланина, низкий и составляет 41-45% .
2. Из циануксусного эфира путем каталитического гидрирования и омыления его гидратом окиси бария по схеме:
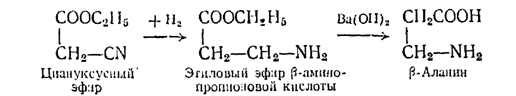
Выход р-аланина достигает 72%, но циануксусный эфир дорог.
3. Из галогенопропионовой кислоты аммонолизом по схеме:
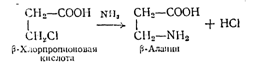
b-Аланин получают в смеси с иминодипропионовой кислотой, из которой его выделяют с выходом и 50%. Метод дает недостаточный выход и усложнен как выделением b-алаиина из реакционной массы, так и синтезом хлорпропионовой кислоты (из акрилонитрила и соляной кислоты).
4. Из акрилонитрила аммонолизом с последующим гидролизом b-аминопропионитрила соляной кислотой или щелочью по следующей схеме:
![]()
Однако реакция цианэтилирования аммиака идет не однозначно с образованием смеси первичного, вторичного и третичного аминов, что снижает выход b-аланина. Для сдвига равновесной системы в сторону образования первичного амина была изучена зависимость выхода b-аланина от концентрации раствора аммиака, относительного количества акрилонитрила и температуры проведения процесса. b-аланин с максимальным выходом получают при температуре 154—158°С. Однако прямой выход b-аланина составляет 40—44%. В последнее время разработан метод превращения смеси вторичного и третичного аминов в b-аланин. При этом выход повышается до 65—67%. Метод этот представляет интерес, но нуждается в практической отработке.
5. Из акрилонитрила аминированием фталимидом в присутствии катализатора с получением в качестве промежуточного продукта фталимидопропионитрила по следующей схеме:
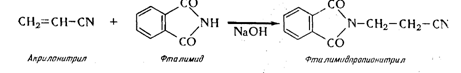
В качестве катализаторов известны: этилат натрия, триметилфенил-аммоний , спиртовой 1%-ный раствор едкого натра. При использовании последнего выход полученного составил 77,8%.
Выделение свободного b-аланина или его соли. Метод выделения зависит от того, в виде какой соли получают b-аланин при гидролизе. Если этот процесс осуществляют соляной кислотой, то получают хлор гидрат b-аланина. Для выделения из этой соли свободного b-аланина предложены различные реагенты: гидрат окиси лития , окись свинца, а затем обработка водородом . Эти реагенты либо дороги, либо требуют сложной обработки во вредных условиях. Наиболее эффективным является метод ионообмена на катионите КУ-2 с элюированием 2%-ным раствором аммиака с последующим выпариванием и кристаллизацией. Выход 92,0%. Возможен и другой вариант — омыление серной кислотой с последующим выделением ее окисью кальция в виде гипса, а b-аланина в виде кальциевой соли по следующей схеме: .
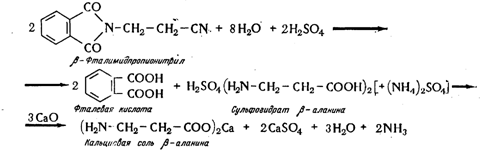
При изучении режима омыления установлена оптимальная концентрация серной кислоты в 25%, а рН при нейтрализации кислоты - 6,8—7,0, а для получения кальциевой соли около 8,0. Недостатком метода гидролиза серной кислотой с выделением ее в виде гипса и с получением кальциевой соли b-аланина является трудность получения последней в чистом виде, что отрицательно влияет на качество пантетоната кальция.
Из анализа изложенных методов следует отдать предпочтение двум методам синтеза b-аланина: 1) аммонолиз акрилонитрила под давлением 2) аминированием акрилонитрила фталимидом с выделением свободного b-аланина на ионитах или в виде кальциевой соли.
СИНТЕЗ ПАНТОЛАКТОНА
Вторым компонентом молекулы пантотеновой кислоты является пантолактон или (другое название) — a, g-диокси-b, b-диметилмасляная кислота. Синтез пантолактона осуществлен, исходя из изомасляного альдегида, общим методом получения a-окси кислот—циангидринным синтезом по следующей схеме :
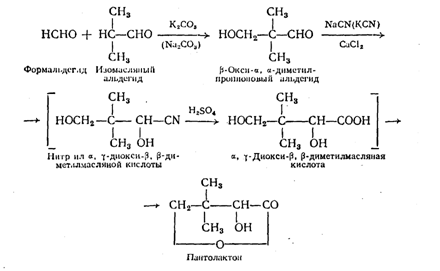
Химизм процессов заключается в альдольной конденсации иэомасляного альдегида и формальдегида в присутствии поташа или соды в b-окси-a, a-диметилпропиоповый альдегид; последний конденсируют с синильной кислотой или цианистым калием в присутствии хлористого кальция или с цианистым натрием и получают a, g-диокси-b, b-диметилмасляную кислоту и при ее лактонизации — рацемический пантолактон. Дальнейшее усовершенствование синтеза пантолактона привело к упрощению технологического процесса в результате замены цианирующего агента - цианистого калия — ацетонциангидрином и других технологических усовершенствований. В результате четырехстадийный синтез пантолактона стали осуществлять в одну стадию. Таким образом, исходным сырьем для получения пантолактона является изомасляный альдегид, который может быть получен различными методами синтеза :
1) гидратацией хлористого диметилэтилена с последующим омылением и дегидратацией:
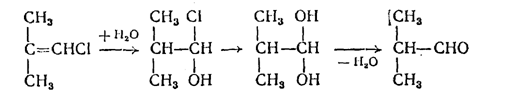
2) гидролизом с одновременной дегидратацией эфиров:
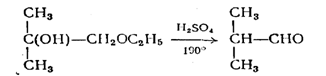
3) окислением изобутилового спирта хромовой смесью:
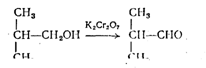
Первые два метода для промышленного применения не приемлемы из-за дефицитности сырья. Что касается третьего метода, то недостатком его является побочная реакция, обусловливающая дальнейшее окисление альдегида в изомасляную кислоту и этерификация ее нзобутиловым спиртом, не вошедшим в реакцию. В результате этой реакции образуется в значительном количестве изобутиловый эфир масляной кислоты, что значительно снижает выход изомасляного альдегида (около 40%). Кроме того, бихромат калия также дорог и дефицитен. Наилучшую перспективу для промышленного применения имеет метод синтеза изомасляного альдегида путем каталитического дегидрирования изобутилопого спирта кислородом воздуха на медном или серебряном катализаторе при температуре 230— 300° С с выходом 80—90%. В дальнейшем было показано, что серебряный катализатор, нанесенный на пемзу, при температуре 500 - 600° С более эффективен по сравнению с медным. По-видимому, вопрос о выборе катализатора для данного процесса должен быть дополнительно изучен. В качестве промышленного метода может быть осуществлен оксосинтез:
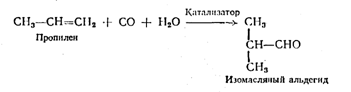
Из изложенного можно сделать заключение, что наиболее рациональным методом синтеза пантолактона является одностадийный метод, предложенный Е. Жданович и Е. Бялой, заключающийся в альдольной конденсации изомасляного альдегида и формальдегида с цианированием аце-тонциангидрином и дальнейшим омылением и лактонизацисй. Этим методом получают рацемический D, L-пантолактон. Для синтеза оптически активной Д(+)-пантотеновой кислоты считают более целесообразным конденсировать левовращающий D(—)-пантолактон с b-аланином, чем расщепление на свои антиподы D, L-пантотеновой кислоты. Для получения D(—)-пантолактона необходимо пантолактон-рацемат разложить на оптические антиподы. Для этого на рацемат действуют каким-либо оптически деятельным органическим основанием-алколоидом, например, хинином, бруцином или оптически деятельными синтетическими аминами, как, например, a-фенилэтиламином. Если право- и левовращаю-щие пантолактоны обладают одинаковыми свойствами, за исключением вращения плоскости поляризации и кристаллизации в эпантиаморфных формах, т. е. с различной пространственной ориентировкой атомов, то полученные соли с алколоидами вследствие вхождения в их молекулы нового асимметрического углеродного атома обладают различными свойствами, как, например, растворимостью. Поэтому мы получаем возможность их разделить дробной кристаллизацией. Разделив эти соли и разложив их кислотой, мы получаем стереизомеры в чистом виде. Таким путем удается из пантолактона рацемата выделять D(—)-пантолактон.
СИНТЕЗ D(+)-ПАНТОТЕНОВОЙ КИСЛОТЫ ИЛИ ЕЕ РАЦЕМАТА
Последней стадией синтеза является конденсация D(-) или D, L-пантолактона с b-аланином. Этот процесс осуществляют различными путями:
а) при нагревании до 70° С D(—)-пантолактона с этиловым или метиловым эфиром b-аланина с последующим омылением с выходом D(+)-пантотеновой кислоты 50% по схеме:
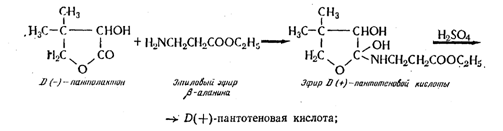
б) лучшие результаты получают при конденсации пантолактона с натриевой или кальциевой солью b-аланина в среде безводного спирта;
в) при конденсации сухой натриевой соли b-аланина с D-(—)-пантолак-тоном при температуре 100—105° С получают пантотенат натрия с высоким выходом (92%). Имеются указания, что при использовании в реакции конденсации свободного р-аланина выход пантотеновой кислоты весьма низок;
г) однако выход значительно повышается, если конденсацию вести в среде вторичных или третичных аминов в присутствии окиси кальция или этилата натрия Н. Жданович указывает, что кальциевая соль пантотеновой кислоты была получена при конденсации b-аланина и D, L-пантолактоиа в среде метилового спирта в присутствии диэтиламина с обработкой реакционной массы окисью кальция с выходом в 90,2%.
Из всего изложенного можно прийти к технологической схеме производства D(+)-пантотеновой кислоты или ее рацемата, заключающейся в следующих стадиях синтеза:
получение b-аланина аммонолизом акрилонитрила в одну стадию;
одностадийный синтез D, L-пантолактона путем альдольной конденсации изомасляного альдегида и формальдегида и цианирования b-окси-a, a-диметилпропионового альдегида ацетонциангидрином и последующего омыления и лактонизации;
расщепление D, L-пантолактона-рацемата и выделение D(-) пантолактона с помощью L(+) треоамина;
конденсация D(—)-пантолактона и b-аланина в среде метилового спирта в присутствии диэтиламина.
ПЕРСПЕКТИВНЫЕ ПУТИ СИНТЕЗА Д-(—)-ПАНТОЛАКТОНА
Основными недостатками процесса получения медицинского витамина В3 является стадия разделения на оптические антиподы D, L-пантолактона.
В настоящее время идет интенсивный поиск методов синтеза D-(—) -пантолактона, исключающих трудоемкий процесс разделения рацемата.
Решение этой задачи возможно сейчас двумя путями асимметрического синтеза D-(—)-пантолактона из 3-оксо-4,4-диметил-g-бутиролактона (кетопантолактона):
1) Способ асимметрического гидрирования (Япония).
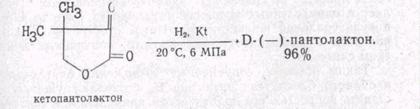
В качестве катализатора используют RhCIs (с лигандом М-ацилфенилпирролидинфосфином).
2) Способ асимметрического биосинтеза.
Некоторые микроорганизмы содержат специфический фермент—кетопантолактонредуктазу, катализирующий реакцию восстановления кетопантолактона в пантолактон:
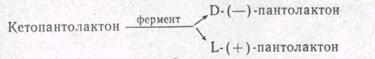
Соотношение изомеров зависит от вида штаммов применяемых микроорганизмов.
Некоторые дрожжи и грибы, например, Rhodotorula mi-nutaIFO 0920 и Aspejrg'illus niger могут выполнять стереонаправленное превращение кетопантолактона в D-(—)-пантолактон, который далее превращают в Д-(+)-пантоте-новую кислоту. Установлено, что кетопантолактон за 48 ч трансформируется в D-(—)-пантолактон с выходом 86—87% при исходном содержании в среде 45 г/л. При этом производительность ферментера объемом 20 м3— 1 кг/м3ч.
Среди других вариантов синтеза витамина В3 с использованием методов биотехнологии наиболее перспективным представляется получение паитотеновой кислоты из се структурных компонентов с помощью иммобилизованных бактериальных клеток некоторых штаммов. Иммобилизованные -клетки синтезируют Д-(+)-пантотеновую кислоту из (b-аланина и пантоата калия в присутствии АТФ, КС1 и сульфата магния.
Важнейшей коферментной формой D- ( ) -пантотеновой кислоты является кофермент ацилирования — КоА (кофермент А). Химический синтез его очень сложен, метод же биосинтеза с применением сухих бактериальных клеток является более простым по сравнению с химическим синтезом и позволяет в определенных условиях накапливать КоА до 115 г/л в культуральной жидкости. Исходным субстратом при этом является 4-фосфопантотсновая кислота, получаемая химическим синтезом.
Таким образом, современные достижения биотехнологии в области биосинтеза витамина В3 позволяют уже сегодня ставить вопросы о его практическом применении, в частности, для стереонаправленного синтеза D-(-)-пантолактона и получения коферментной формы витамина В3—кофермента А — комбинированным химико-ферментативным способом.
Как было отмечено ранее, применение современных достижений биотехнологии в органической связи с химической технологией возможно и для производства других витаминов, важнейшим из которых является производство аскорбиновой кислоты (витамина С).
Литература
1. Shrimton D. H. (2008)Микронутриенты и их взаимодействие. Российский медицинский журнал. Т. 16., № 7.
2. Морозкина Т.С. Витамины – М.:Медкнига, 2002
3. Лифляндский В. Г. Витамины и минералы. – М.:Эксмо, 2010
4. Малахов Г. П. Витамины и минералы в повседневном питании. – М.:Просвещение, 2009
5. Скальный А.А. Микроэлементы – М.:Промкнига, 2002
6. Ула Унгер-Гебель. Витамины. – М.:Эксмо, 2003
7. Тюкавкина И.Р. Органическая химия для студентов медицинских вузов. – М.:Медкнига, 2000
8. Энциклопедия витаминов и БАД
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
- Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
- Теоретические основы электрохимической коррозии
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошл
- Химический элемент калий
- Влияние концентрации аниона хлора на адсорбцию органического соединения реакционной серии оксиазометина на цинковом электроде
Министерство образования и науки Российской ФедерацииФедеральное государственное образовательное учреждение высшего профессиональ
- Проектирование вертикального аппарата с приводом и мешалкой
Московская государственная академия тонкой химической технологии им. М.В. ЛомоносоваКафедра прикладной механики и основ конструирован
- Производство азотной кислоты
До начала 20-го века HNO3 получали из природной натриевой (чилийской) селитры:NaNO3 + H2SO4 = NaHSO4 + HNO3 (1)При использовании 95-97% H2SO4 и 96% NaNO3 получали 96-
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

