Особенности фармакологического действия нейропептидных препаратов
Глаукома
Описание основных групп нейропротекторов
Молекулярный механизм действия актовегина
Нимодипин
Ферментные антиоксиданты
Неферментные антиоксиданты
Эмоксипин
Вещества, влияющие на систему ГАМК
Общие принципы действия ноотропов
Цераксон
Нейропептиды
Ретиланамин
Кортексин
Фармакокинетика
Заключение
Список литературы
Введение
Актуальность исследования различных видов церебральной патологии и разработки методов их лечения не требует детального обоснования. Последнее десятилетие уходящего века не случайно было объявлено Всемирной организацией здравоохранения "десятилетием мозга". Церебральные патологии по распространённости занимают третье место среди населения стран Европейского союза и Американского континента, уступая лишь заболеваниям сердечно-сосудистой системы и злокачественным новообразованиям. Заболевания головного мозга деструктивного и дегенеративного характера приводят не только к уменьшению продолжительности жизни населения, но и ограничивают социальную активность человека в силу развития когнитивного дефицита, ограничивая способность индивидуума к мышлению, обучению, адекватному восприятию информации и принятию решений. Список церебральных патологий, сопровождающихся нарушениями когнитивных функций, достаточно велик и включает в себя травму мозга, хроническую церебро-васкулярную недостаточность, постгипоксическую энцефалопатию, нейроинфекции, хронический алкоголизм, задержку развития у детей, поражения мозга нейродегенеративного характера (21). Нарушение когнитивных и ассоциативных функций в условиях церебральных патологий протекают на фоне выраженных структурных изменений тканей мозга за счёт угнетения процессов биоэнергетики, развития глутаматной "эксайтотоксичности", гиперпродукции активных форм кислорода, снижения активности антиоксидантных систем, приводящих, в конечном итоге, к развитию апоптоза. Именно активация апоптоза, по мнению многих исследователей, является первопричиной развития стойких нарушений когнитивно-мнестических функций ЦНС (12,13,14). Биохимические и морфоцитологические признаки апоптоза выявляются в большом спектре экспериментальных нейродегенеративных расстройств: транзиторной церебральной ишемии, вызванной окклюзией церебральной артерии; интрацеребральной геморрагии; на моделях эпилептогенных судорог; локальном термическом повреждении мозга. Апоптоз включается в патологии любых проявлений ишемических и травматических повреждений нервной ткани, включая нарушения спинного мозга, деменциальные изменения, связанные с развитием болезней Альцгеймера, Паркинсона, сенильной деменцией, врожденными патологиями мозга и др. Таким образом, можно говорить о нейроапоптозе как новом патобиохимическом механизме нейродегенеративных расстройств широкого спектра (12,15). Основное свойство апоптоза как принципиально нового морфо-биохимического процесса, отличного от некроза - это включение специализированных биохимических механизмов, в результате которых происходит повреждение молекулы ДНК и уничтожение белоксинтезирующих структур. Вот почему такой важной и актуальной для современной науки и медицины является проблема разработки высокоэффективных и безопасных препаратов для лечения данных патологий.
С физиологической и биохимической точки зрения нарушение кровоснабжения структур мозга вносит серьезный дисбаланс в соотношение систем биорегуляторов и является источником патологических процессов, развивающихся на нейрональном и субклеточном уровнях. Нейрохимические процессы, происходящие при цереброваскулярной ишемии, представляют собой комплекс реакций, включающих интенсивное накопление экстрацеллюлярного глутамата, нарушение ионного гомеостаза, активизация кальцийзависимых внутриклеточных протеаз (кальпаин), образование токсических свободных радикалов и активных форм кислорода, неизбежно ведущих к некротической или/и апоптической гибели нейронов. Поэтому можно предположить, что вещества, блокирующие компоненты этого каскада, антагонисты рецепторов глутамата, ингибиторы протеаз и каспаз, нейтрализаторы свободных радикалов и активаторы репаративных процессов могут рассматриваться как потенциальные средства терапии церебральной ишемии. Представленная в общем виде картина свидетельствует о том, что распространенная некогда концепция монотерапевтического подхода для лечения цереброваскулярных ишемией, представляющая собой неотложную реперфузию тромболитическими препаратами, оказывается несостоятельной. Мультитерапевтический подход, учитывающий многостадийность и степень тяжести ишемических расстройств мозга, должен включать:
вазоактивную терапию, обеспечивающую функционально необходимый метаболизм в тканях мозга;
компенсаторную (заместительную) терапию, направленную на ликвидацию нейротрансмиттерного дефицита в поврежденных структурах мозга;
нейротрофическую коррекцию ростовыми факторами, необходимыми для раннего поддержания биохимических сигнальных и трансляционных процессов в нервной клетке;
торможение образования продуктов перекисного окисления липидов;
торможение активности кальпаинов, ферментов протеолиза;
торможение экспрессии и активности каспаз, ферментов апоптоза.
Такая полифункциональная активность наблюдается у ноотропов нового поколения - препаратов нейропептидной природы (Семакс, Цереброзин, Кортексин). По сравнению с реперфузией (тромболизисом), такое направление лечения цереброваскулярных патологий, как нейропротективная терапия, практически не имеет противопоказаний и каких-либо ограничений (сахарный диабет, высокое артериальное давление). Нейропротекцию условно разделяют на первичную, направленную на прерывание быстрых реакций глутамат-кальциевого каскада, свободно-радикальных механизмов, что позволяет увеличить период "терапевтического окна" для активной реперфузии, и вторичную, обеспечивающую прерывание отсроченных механизмов смерти клеток. К группе препаратов, обеспечивающих как первичную, так и вторичную нейропротекцию, относят широко применяющихся в последние годы в клинической практике пептидные препараты - Семакс, Церебролизин, Кортексин.
Целью работы является изучение молекулярно-биохимических основ терапевтического действия данных препаратов.
Задачи:
На основе анализа прочитанной литературы охарактеризовать химическое строение нейропептидных препаратов, сформулировать особенности фармакологического действия.
Подробно рассмотреть механизм действия.
Ознакомиться с основными терапевтическими эффектами.
Нейропротекция и виды нейропротекции.
Нейропротекторы.
Нейропротекторы - (греч. neuron - нерв + лат. protec-tio - защита) - лекарственные средства, защищающие нервные клетки от повреждения свободными радикалами и токсинами, от кислородной недостаточности и других неблагоприятных факторов, активизирующие метаболические процессы в головном мозге. (2)
Нейропротекторы имеют ноотропный компонент воздействия. Классификация, предложенная Т.А. Ворониной и С.Б. Середениным (1998), показывает, насколько гетерогенна и значительна группа лекарств с ноотропным компонентом действия, применяемая в медицине. (3)
В настоящее время - это наиболее перспективная и динамично развивающаяся группа лекарств. Ниже приведены лишь некоторые препараты указанной группы.
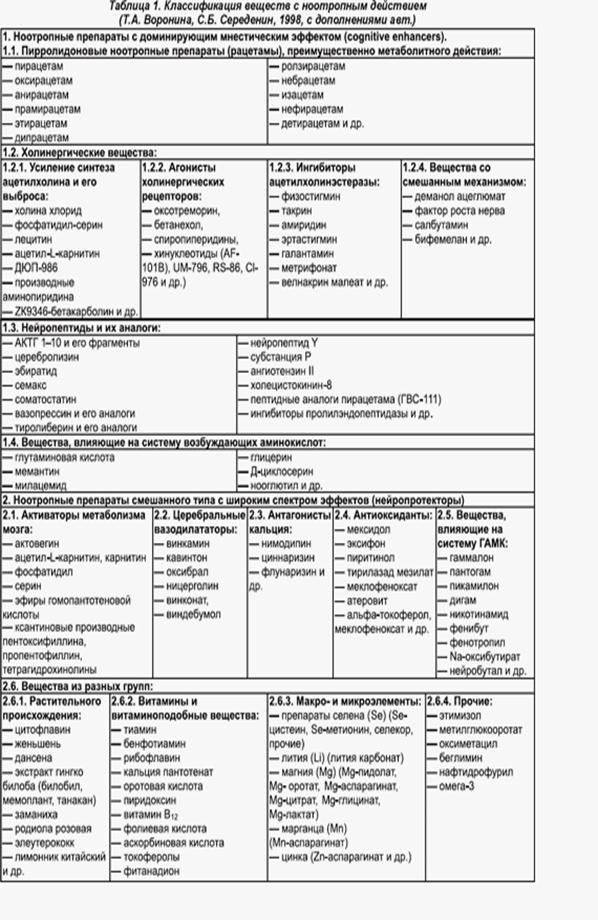
Механизм действия нейропротекторов:
В первую очередь они воздействуют на известные нам патохимические реакции, возникающие при патологических процессах, в т. ч. и на гипоксию.
Слово "гипоксия" всем привычно и знакомо, но как лечить это состояние - большая проблема. Ведь до конца не расшифрованы механизмы патохимических реакций, возникающих при гипоксии. Критические состояния порождают мощное и многопричинное снижение скорости гликолиза, и как следствие - дефицит энергии и гипоксию. Воздействие на промежуточный обмен веществ представляется удобной "точкой отсчета" при медикаментозном лечении критических состояний. реди наиболее перспективных зарубежных препаратов отмечен лубелузол, проходящий сейчас третью фазу клинических испытаний, глиатилин. Среди российских - комбинированный препарат цитофлавин, который уже применяется. (2)
Применение:
Нейропротекция, рассматриваемая в качестве средства защиты нейронов при сосудистой патологии головного мозга, является важным аспектом фармакотерапии нейродегенеративных, цереброваскулярных и других заболеваний ЦНС.
В комплексной терапии больных с хронической недостаточностью мозгового кровообращения.
ОНМК.
ДЦП и ЧМТ.
Болезни Альцгеймера.
Постгипоксическая энцефалопатия.
Болезнь Паркинсона.
Нарушения когнитивных функций вследствие травмы головного мозга.
Эпилепсия.
Тяжелые психические заболевания (шизофрения), олигофрения.
При неврологических осложнениях сахарного диабета.
Глаукома
Нейропротекция - защита нервных клеток от повреждения свободными радикалами и токсинами, от кислородной недостаточности и других неблагоприятных факторов.
Выделяют два вида нейропротекции: первичная и вторичная.
Основным направлением первичной нейропротекции является прерывание быстрых механизмов глутаматкальциевого каскада с целью коррекции дисбаланса возбуждающих и тормозных нейротрансмиттерных систем и активации естественных тормозных процессов. Этот вид нейропротекции должен начинаться с первых минут ишемии и продолжаться на протяжении первых трех дней инсульта, особенно активно - в первые 12 часов. Антагонисты NMDA - рецепторов уменьшают поток ионов Са2+ в клетки через агонистзависимые кальциевые каналы. Они были первыми нейропротективными препаратами, которые в экспериментальных условиях значительно (на 40-70%) ограничивали область инфаркта мозга, прежде всего за счет сохранения живой зоны "ишемической полутени". Блокада рецепторов может осуществляться неконкурентными антагонистами. Единственными безопасными и (по результатам 2-й фазы испытаний) эффективными неконкурентными антагонистами NMDA - рецепторов на сегодняшний день являются препараты магния, регулирующий кальциевый ток через вольтажчувствительные каналы. При церебральной ишемии уменьшается содержание глутаматных рецепторов в коре, что вызывает перевозбуждение или даже смерть нейронов, так как потеря этих субъединиц АМРА - глутаматными рецепторами приводит к повышению проницаемости мембраны нейрона для ионов кальция и уменьшению митохондриального пула ионов магния, а также к повышению уровня свободного цитозольного магния в нейроне - признанного маркера индукции апоптоза. В состоянии покоя устье АМРА - рецептора заблокировано ионами магния. При ишемии АМРА - рецептор теряет ионы магния из устья и не препятствует усиленному току ионов цинка также лишается металла. Кроме того, магний как микроэлемент участвует в формирование каталитических центров и стабилизации регуляторных сайтов в составе многочисленных ферментов нервной и глиальной ткани в процессе синтеза и деградации нейромедиаторов и нейропептидов в головном мозге в формировании пространственной конфигурации и внутримолекулярной стабилизации эндорфинов гипоталамических рилизинг - факторов вещества Р, нейропептида Y. Магний вовлечён в различные антиоксидантные функции нейронов глиальных элементов.
Восполняя дефицит магния и витамина В6 препарат не только оказывает протективное действие, но и реализует седативные, анальгетические и антипароксизмальные эффекты магнийсодержащих препаратов, что связанно с важнейшей способностью ионов магния регулировать процессы торможения и возбуждения в головном мозге.
Продолжаются клинические испытания ремацемида - низкоаффинного антагониста NMDA - рецепторов, обладающих способностью ингибировать и потенциалзависимые кальциевые каналы. Первые клинические исследования выявили слабовыраженные побочные эффекты препарата (двоение и сонливость).
Лубелузол - соединение бензотиазола, являющейся блокатором натриевых каналов. Препарат предотвращает пресинаптическое высвобождение глутамата, снижая концентрацию нейротрансмиттера во внеклеточном пространстве периинфарктной зоны мозга, а также тормозит глутаматиндуцированнную нейротоксичность оксида азота снижая активность фермента NO - синтаза.
Глиатилин - холиномиметик центрального действия; нейропротектор, ноотроп.
Глиатилин является новым соединением, в составе структурной формулы которого содержится 40,5% метаболически защищенного холина. Попадая в организм, глиатилин всасывается в кровь и попадает в головной мозг, где под воздействием ферментов разлагается на холин и глицерофосфат. Холин является одним из компонентов ацетилхолина и принимает участие в его синтезе, в результате чего возрастает скорость передачи возбуждения в нервных синапсах. Глицерофосфат является предшественником фосфолипидов (фосфатдихолина) мембраны нейронов, способствует улучшению обменных процессов в нервных клетках., Клиническая эффективность глиатилина связана с распределением холинергических структур в центральной нервной системе. Ацетилхолин представлен в различных отделах нервной системы широко, основное его местонахождения в ЦНС - базальные ганглии, таламус, серое вещество полушарий, хвостатое ядро, ядра моста (мускариновые рецепторы), передние рога боковых желудочков, вегетативные образования НС (никотиновые рецепторы). Учитывая биохимическую "карту" мозговой ткани, в которой ацетилхолин имеет широкое представительство, есть основания предполагать, что этот медиатор обеспечивает сложные двигательные функции - инициацию движений, двигательные стереотипы. Холинергическая система, тесно взаимодействуя с дофаминергической, ГАМК-ергической и глутаматэргической медиаторными системами, обеспечивает спонтанную активность и эмоциональное поведение, память и волевые акты. Глиатилин, с одной стороны, являясь донором холина, увеличивает синтез ацетилхолина и положительно воздействует на нейротрансмиссию, с другой - глицерофосфат участвует в синтезе фосфатидилхолина (мембранного фосфолипида). Глиатилин, являясь предшественником фосфолипидов мембран, участвует в анаболических процессах, ответсвенных за мембранный фосфолипидный и глицеролипидный синтез, оказывая положительное влияние на функциональное состояние мембранных структур клеток, улучшая цитоскелет нейронов, увеличивая массу клеточных органелл (рибосом, митохондрий). Этот механизм действия препарата особенно важен при острых заболеваниях нервной системы. В экспериментальных исследованиях показано, что процесс гибели нейронов растянут во времени. В патогенезе таких состояний ключевое значение имеет патологическая (некроз) и физиологическая (апоптоз) гибель значительной части популяции зрелых дифференцированных нейронов при экзо - или эндогенных влияниях. Даже при кратковременном патогенном воздействии происходит уменьшение объема клеток, которое приводит к потере межклеточных контактов с одновременной реструктуризацией мембранных образований клетки, ядерного хроматина и повреждением цитоплазматических органелл нейронов. Некроз завершает процесс нейродегенерации, которая сопровождается отеком, набуханием, распадом и лизисом нейронов. Плазматическая мембрана претерпевает морфологические и химические изменения, которые делают ее узнаваемой для фагоцитов, включающихся в процесс невоспалительной санации мозговой ткани в "скомпроментированной" области. Выживающие нейроны формируют аномальные связи, новые кланы нейронов, которые предрасположены к патологии из-за недостаточных функциональных возможностей и слабой резистентности к воздействию новых патогенных факторов. Отсутствие токсичности и достаточная широта терапевтической дозы делают глиатилин приоритетным при острой церебральной патологии (черепно-мозговой травме, остром нарушении мозгового кровообращения), при патологических и ятрогенных состояниях (операция, наркоз), связанных с глубоким нарушением сознания и необходимостью скорейшего его восстановления (оглушение - кома, медикаментозный сон).
Глиатилин улучшает церебральный кровоток, усиливает метаболические процессы в головном мозге, активирует структуры ретикулярной формации головного мозга и восстанавливает сознание при травматическом поражении головного мозга. В остром периоде черепно-мозговой травмы у больных с сохранными механизмами ауторегуляции мозгового кровотока Глиатилин способствует увеличению линейной скорости кровотока на стороне поражения, нормализует пространственно-временные характеристики, спонтанную биоэлектрическую активность мозга, а также способствует более быстрому и полному регрессу очаговой невросимптоматики и восстановлению сознания.
Глиатилин эффективен:
в раннем восстановительном периоде у лиц, перенесших ишемический инсульт, оказывает нормализующее влияние на пораженные и компенсаторно значимые зоны мозга.
у больных с легкой и среднетяжелой степенью интелектуально мнестических функций на фоне дисциркуляторной энцефалопатии и остаточных явлений нарушения мозгового кровообращения, обусловленного атеросклерозом и/или артериальной гипертензией.
оказывает профилактическое и корригирующее действие на патогенные факторы инволютивного психоорганического синдрома, такие как изменение фосфолипидного состава мембран нейронов и снижение холинергической активности.
улучшает состояние когнитивных функций, а также ряда поведенческих и познавательных функций у больных "мягкой и умеренной" деменцией альцгеймеровского типа.
улучшает настроение, способствует устранению эмоциональной неустойчивости, раздражительности и апатии.
активизирует умственную деятельность.
Выводится глиатилин через легкие (в виде двуокиси углерода), почки и кишечник.
С учетом современных представлений о возможности вживания ткани мозга в зоне пенумбры в течении как минимум 48 - 72 ч. После нарушения мозгового кровообращения особое значение приобретает разработка новых эффективных методов вторичной нейропротекции направленных на прерывание отсроченных механизмов смерти клеток (отдалённых последствий ишемии), избыточного синтеза оксида азота и оксидантного стресса, активации микроглии связанных с ней дисбаланса цитокинов, иммунных сдвигов, локального воспаления, нарушение микроциркуляции и ГЭБ; трофической дисфункции апоптоза. Вторичная нейропротекция может быть начата относительно поздно - через 6 - 12 часов после сосудистого инцидента и должна быть наиболее интенсивной на протяжении первых семи суток заболевания. Важно отметить не только терапевтическое, но и профилактическое значение. Коррекция отдаленных последствий ишемии замедляет развитие церебрального атеросклероза и энцефалопатии в постинсультном периоде.
Цитофлавин - метаболический препарат. Снижает образование свободных радикалов, активирует антиоксидантную защиту и ферменты дыхательной цепи митохондрий. Оказывает противоишемическое действие, улучшает коронарный и мозговой кровоток, обладает нейропротекторными свойствами. Применяется при острых нарушениях мозгового кровообращения, последствиях ишемического инсульта, дисциркуляторной энцефалопатии, токсической эцефалопатии, постнаркозной депрессии. Цитофлавин - метаболическое средство, действие которого обусловлено компонентами, входящими в его состав.
Цитофлавин снижает образование свободных радикалов, восстанавливает активность ферментов антиоксидантной защиты и энергетический потенциал клетки. Цитофлавин активирует окислительно-восстановительные ферменты дыхательной цепи митохондрий, стимулирует синтез белка и нуклеиновых кислот, улучшает процессы утилизации кислорода, способствует утилизации глюкозы, жирных кислот и ресинтезу макроэргов и ГАМК в нейронах.
Цитофлавин оказывает противоишемическое действие, улучшает коронарный и мозговой кровоток, ограничивает зону некроза. Цитофлавин обладает нейропротекторными свойствами, улучшает метаболические процессы в ЦНС, восстанавливает рефлекторные нарушения, расстройства чувствительности, интеллектуально-мнестические функции. Цитофлавин способствует быстрому пробуждению после общей анестезии.
Основными направлениями вторичной нейропротекции являются:
антиоксидантная терапия.
торможение местной воспалительной реакции.
улучшение трофического обеспечения мозга (нейротрофины).
нейроимуномодуляция (нейропептиды).
регуляция рецепторных структур (ганглиозиды).
Одним из направлений вторичной нейропротекции является применение антиоксидантов - препаратов, уменьшающих выраженность реакции оксидантного стресса.
В проведенных экспериментальных и клинических исследованиях высокую эффективность показали отечественные препараты: эмоксипин, мексидол.
Эмоксипин - производное 3-гидроксипиридина, структурный аналог витамина В6. Основными эффектами эмоксипина являются торможение ПОЛ и активация антиоксидантной системы; изменение активности мембраносвязанных ферментов; модификация метаболической, рецепторной и транспортной функций клеточных мембран. Препарат стабилизирует кальций-АТФазу саркоплазматического ретикулума в условиях денатурации сарколеммы и препятствует повреждению мембраны клеток. Установлено антигипоксическое действие эмоксипина, ингибирует фосфоди-эстеразу, способствуя накоплению в ткани мозга сАМР. Установлено антигипокси-ческое действие эмоксипина. Препарат безопасен и хорошо переносится.
Отечественным антиоксидантом нового поколения является мексидол - соль эмоксипина и янтарной кислоты. Препарат тормозит ПОЛ и свободнорадикальные процессы, увеличивает концентрацию восстановленной формы глутатиона, активирует эндогенную антиоксидантную систему супероксиддисмутазы и церулоплазмин, предупреждает снижение активности глутатионзависимых ферментов, в результате чего достоверно уменьшается выраженность процессов оксидантного стресса. Выявлены также позитивное влияние мексидола на состояние мембранных структур клеток (уменьшение вязкости липидного бислоя мембраны и увеличение её текучести); модуляция активности мембраносвязных ферментов, ионных каналов, рецепторных комплексов, в том числе бензодиазепинового, ГАМК, ацетилхолинового,; улучшение синоптической передачи и пластичности мозга. Препарат стимулирует энергосинтезирующие функции митохондрий и улучшает энергетический обмен в клетке, повышая, таким образом, устойчивость ткани мозга к гипоксии и ишемии. Причиной антигипоксического эффекта мексидола является прямое окисление сукцината, входящего в его состав, о чём свидетельствует усиление эндогенного дыхания, сопровождающееся восстановлением флаинопротеидов. Мексидол не только оказывает метаболическое действие, но и улучшает мозговое кровообращение: вызывает обратное развитие атеросклеротической активностью (снижает уровень общего холестерина и липопротеидов низкой плотности), нормализует реологические свойства крови, подавляет агрегацию тромбоцитов.
Таким образом, важной стратегией вторичной нейропротекции являются разработка и внедрение препаратов с выраженными нейротрофическими и ростовыми свойствами.
Факторы роста, представляющие собой эндогенные полипептиды, являются идеальными претендентами для лечения инсульта, так как обладают нейропротективными, репаративными и пролиферативными свойствами. (1)
В настоящий момент принято выделять две группы нейропротекторных препаратов - прямые и непрямые нейропротекторы.
Согласно данной классификации прямые нейропротекторы непосредственно защищают нейроны. Эти препараты блокируют основные факторы повреждения клеток, которые обусловлены развитием ишемии в этой зоне, в результате которой наблюдается увеличение концентрации продуктов ПОЛ и свободных радикалов, ионов Са++, ацидоз. Прямыми нейропротекторными свойствами обладают природные витамины и флавоноиды - аскорбиновая кислота, a-токоферол, витамин А, g-аминомаслянная кислота (ГАМК); ферменты антиоксидантной системы организма - супероксиддисмутаза (СОД); неферментные антиоксиданты - эмоксипин, мексидол и гистохром; блокаторы кальциевых каналов - бетаксолол, нифедипин; нейропептиды - ретиналамин, кортексин; антигипоксанты - цитохром с. Кроме того, в настоящее время ведется поиск препаратов, которые могли бы непосредственно устранять факторы, способствующие активации апоптоза. Действие этих препаратов направлено на снижение неблагоприятного влияния глютамата и других субстратов на аксоны ганглионарных нейронов.
Непрямое нейропротекторное действие подразумевает влияние препаратов на различные факторы, увеличивающие риск повреждения клеток (снижение перфузионного давления, атеросклероз, изменение реологических свойств крови, ангиоспазм), а также повышение устойчивости организма к снижению перфузионного давления кислорода в тканях. Подобным эффектом обладают препараты, улучшающие микроциркуляцию (теофиллина этилендиамин и никотинат, винпоцетин, пентоксифиллин и др.), реологические свойства крови, снижающие уровень холестерина в крови, ноотропные средства.
Описание основных групп нейропротекторов
1. Активаторы метаболизма мозга.
Актовегин - высокоактивный стимулятор утилизации кислорода и глюкозы в условиях ишемии и гипоксии, увеличивающий транспорт и накопление глюкозы в клетках, что улучшает аэробный синтез макроэргических соединений и повышает энергетические ресурсы нейронов, препятствуя их гибели. Препарат Актовегин представляет собой гемодиализат телячьей крови, содержит такие органические вещества, как аминокислоты, нуклеозиды, липиды, олигосахариды.
Фармакологическое действие:
Актовегин активирует клеточный метаболизм (обмен веществ) путем увеличения транспорта и накопления глюкозы и кислорода, усиливая их внутриклеточную утилизацию. Эти процессы приводят к ускорению метаболизма АТФ (аденозинтрифосфорной кислоты) и повышению энергетических ресурсов клетки. При условиях, ограничивающих нормальные функции энергетического метаболизма (гипоксия /недостаточное снабжение ткани кислородом или нарушение его усвоения/, недостаток субстрата) и при повышенном потреблении энергии (заживление, регенерация /восстановление ткани/), актовегин стимулирует энергетические процессы функционального метаболизма (процесс обмена веществ в организме) и анаболизма (процесс усвоения веществ организмом). Вторичным эффектом является усиление кровоснабжения.
Молекулярный механизм действия актовегина
Выделенная из актовегина, активная фракция оказывает инсулиноподобное действие на изолированные адипоциты жировой ткани: биосинтез липидов может вырасти в зависимости от дозы в 5 раз; вызванное изопротеренолом торможение этого эффекта не происходит; при этом наступает торможение внутриклеточного образования Ц-АМФ; воздействие на адипоциты активной фракцией Актовегина вызывает зависящую от концентрации стимуляцию активности пируват-дегидрогеназы (ПДГ). При этом активной форме передается около 60% общей активности ПДГ.
Инсулиноподобные механизмы действия актовегина существенно отличаются от механизмов применения непосредственно инсулина, так как в этих условиях липогенез, липолиз и транспорт глюкозы не ингибируются.
Было замечено, что гемодиализат не оказывает влияния на фосфорилирование инсулиновых рецепторов или на зависимость инсулина от его рецептора. Из этого можно сделать вывод, что сигналы актовегина не передаются инсулиновым рецепторам, а, скорее всего, проходят на пострецепторном уровне.
Активная фракция, изолированная от гемодиализата, повышает транспорт 3-0-метилглюкозы в зависимости от дозы в 5 раз. Время воздействия такое же, как и при использовании инсулина. Оба агента начинают действовать в течение 1 мин, а достигают максимума через 5 мин.
Стимуляция транспорта 3-0-метилглюкозы активной фракцией не вызывает увеличения цитохолазина-В во фракции плазмы мембраны. Активная фракция, очевидно, действует независимо от перемещения глюкозы. Стимуляция транспорта происходит через модуляцию внутренней активности носителя глюкозы. Это объясняет самостоятельное инсулиноподобное воздействие Актовегина на транспорт и использование глюкозы, что выражается в улучшении энергетического статуса клетки.
Показания к применению:
Недостаточность мозгового кровообращения, ишемический инсульт (недостаточное снабжение ткани головного мозга кислородом вследствие острого нарушения мозгового кровообращения); черепно-мозговые травмы; нарушения периферического кровообращения (артериального, венозного); ангиопатии (нарушение тонуса сосудов); трофические нарушения (нарушения питания кожи) при варикозном расширении вен нижних конечностей (изменениях вен, характеризующихся неравномерным увеличением их просвета с образованием выпячивания стенки вследствие нарушения функции их клапанного аппарата); язвы различного происхождения; пролежни (омертвение тканей, вызванное длительным давлением на них вследствие лежания); ожоги; профилактика и лечение лучевых поражений. Повреждения роговицы (прозрачной оболочки глаза) и склеры (непрозрачной оболочки глаза): ожог роговицы (кислотами, щелочью, известью); язвы роговицы различного происхождения; кератит (воспаление роговицы), в том числе после трансплантации (пересадке) роговицы; потертости роговицы у пациентов с контактными линзами; профилактика поражений при подборе контактных линз у пациентов с дистрофическими процессами в роговице (для применения глазного желе), а также для ускорения заживления трофических язв (медленно заживающих дефектов кожи), пролежней (омертвения тканей, вызванного длительным давлением на них вследствие лежания), ожогов, лучевых поражений кожи и др.
Побочные действия:
Аллергические реакции: крапивница, чувство прилива крови, потливость, повышение температуры тела. Зуд, жжение в области применения геля, мази или крема; при применении глазного геля - слезотечение, инъецированность склер (покраснение склер).
Противопоказания:
Повышенная чувствительность к препарату. С осторожностью назначать препарат в период беременности. В период кормления грудью применение актовегина нежелательно.
2. Блокаторы кальциевых каналов.
Нимодипин
Нимодипин - блокатор кальциевых каналов, производное дигидропиридина. Избирательно взаимодействует с кальциевыми каналами типа L и блокирует трансмембранное поступление ионов кальция.
Фармакологическое действие:
Особенностью препарата является преимущественное влияние на кровоснабжение мозга. Препарат оказывает дилатирующее действие на сосуды головного мозга и обладает противоишемическими свойствами.
Нимодипин предотвращает или устраняет спазмы сосудов, вызываемые различными сосудосуживающими биологически активными веществами (серотонином, простагландинами, гистамином).
Под влиянием препарата происходит более выраженное увеличение перфузии в ранее пораженных участках головного мозга с недостаточным кровоснабжением, чем в здоровых участках, не влияя на системное АД. Особенно отчетливо этот эффект проявляется при спазмах кровеносных сосудов после субарахноидального кровоизлияния.
Нимодипин оказывает протективное действие в отношении нейронов мозга, стабилизирует их функциональное состояние. Благоприятно влияет на память и улучшает способность к концентрации внимания.
Показания:
Профилактика спазма сосудов головного мозга и лечение ишемических нарушений мозгового кровообращения, вызванных субарахноидальным кровоизлиянием;
Неврологические расстройства вследствие спазма сосудов головного мозга, лечение и профилактика ишемических нарушений мозгового кровообращения (в т. ч. при гипертоническом кризе);
Состояние после оперативного лечения по поводу субарахноидального кровоизлияния;
Лечение сенильной деменции;
Лечение отдаленных последствий перенесенного ишемического инсульта, субарахноидального кровоизлияния;
Профилактика мигрени.
Побочное действие:
Нимодипин обычно хорошо переносится больными.
Со стороны сердечно-сосудистой системы: снижение АД (1-9%), возможно - резкое снижение АД (что особенно нежелательно при исходной артериальной гипотонии), тахикардия (<1%), периферические отеки, гиперемия лица (1-9%), ощущение тепла или жара, потливость (<1%). Также, особенно при парентеральном применении, может наблюдаться урежение ЧСС, экстрасистолия; редко - коллапс (<1%).
Со стороны ЖКТ и печени: могут возникать диспептические явления (1-9%). При парентеральном введении возможно увеличение уровня трансаминаз, ЩФ, гамма-глутамилтрансферазы, тошнота, рвота, гепатит, желтуха (<1%).
Со стороны ЦНС и психического статуса: в некоторых случаях возможны расстройства сна, головная боль (1-9%), повышение психомоторной активности, агрессивность, гиперкинезы, депрессия (<1%).
Со стороны опорно-двигательного аппарата: мышечные спазмы (1-9%).
Со стороны мочевыделительной системы: при парентеральном введении возможно нарушение функции почек, вследствие чего возможно повышение содержания мочевины и/или креатинина в сыворотке крови (1-9% - периферические отеки; <1% - гипонатриемия).
Аллергические реакции: дерматит (1-9%).
Местные реакции: флебит (особенно при введении неразведенного раствора нимодипина).
Прочие: одышка (<1%).
Противопоказания:
Выраженные нарушения функции печени, в том числе при циррозе печени (для приема внутрь);
Отек мозга;
Выраженное повышение внутричерепного давления;
Выраженная гипотензия;
Гиперчувствительность;
Беременность (в экспериментальных исследованиях в настоящее время тератогенное действие препарата не выявлено);
Лактация (на время лечения следует прекратить грудное вскармливание).
Ограничения к применению:
Гипотензия (легкая или умеренная), сердечная недостаточность, кардиогенный шок, инфаркт миокарда с застойными явлениями в легких, нерезко выраженные нарушения функции печени.
Резкое понижение АД или возникновение выраженной головной боли обусловливают необходимость прекращения терапии.
Ферментные антиоксиданты
Эрисод
Действующие вещества: Супероксиддисмутаза
Лекарственная форма: порошок для приготовления глазных капель
Фармакологическое действие:
Антиоксидантное средство, оказывает антигипоксическое, противовоспалительное и антицитолитическое действие. Является эндогенным акцептором свободных кислородных радикалов, избыточное накопление которых в клетке имеет важное значение в развитии кислородзависимых патологических процессов (гипоксия, воспаление, интоксикация). Нормализует протекающие с участием свободных радикалов кислорода окислительные процессы и предупреждает разрушение биомембран клеток, связанное с активацией ПОЛ.
Показания: Открытоугольная глаукома, герпетические заболевания глаз; передний увеит, травмы и ожоги глаз; послеоперационный период после удаления катаракты.
Противопоказанния: Гиперчувствительность.
Побочные действия: Сухость глаз, аллергические реакции
Неферментные антиоксиданты
Гистохром
Действующие вещества: Пентагидроксиэтилнафтохинон
Лекарственная форма: раствор для внутривенного введения, раствор для инъекций
Фармакологическое действие: Стабилизирует клеточные мембраны, взаимодействует с активными формами кислорода, свободными радикалами, проявляет свойства хелатора металлов переменной валентности. Снижает количество продуктов перекисного окисления липидов, содержание которых увеличивается при сердечно-сосудистых заболеваниях. Оказывает кардиопротекторное действие у пациентов с успешной тромболитической терапией инфаркта миокарда. Применение препарата приводит к снижению частоты реперфузионных аритмий, в т. ч. жизнеугрожающих (желудочковые экстрасистолы IVa и IVb классов, пароксизмальных желудочковых) и наджелудо
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Особенности физической реабилитации у детей с нарушением зрения
- Особливості гормонально-метаболічного гомеостазу у хворих на цукровий діабет 2 типу із симптоматичними психічними розладами та у хворих на шизофренію під впливом психотропної терапії
ДЕРЖАВНА УСТАНОВА „ІНСТИТУТ ПРОБЛЕМ ЕНДОКРИННОЇ ПАТОЛОГІЇ ІМ. В.Я.ДАНИЛЕВСЬКОГО АКАДЕМІЇ МЕДИЧНИХ НАУК УКРАЇНИ”ЗЕМЛЯНІЦИНА ОЛЬГА ВЯЧ
- Особливості перебігу інфекційних захворювань та туберкульозу у тварин та людини
ЗМІСТВступРозділ І Інфекційні хвороби. Особливості протікання туберкульозу у тварин1.1 Поняття про інфекційні захворювання1.2 Класифіка
- Особливості перебігу хронічного гепатиту с в залежності від генотипу вірусу
- Особливості фізичної реабілітації в період вагітності, пологовий та післяпологовий періоди
- Остеохондроз. Пухлини і запальні захворювання спинного мозку
Остеохондроз.Міжхребцеві диски — це фіброзно-хрящові прошарки між тілами хребців. Вони складаються з фіброзного кільця і драглистого я
- Острая астма у взрослых
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

