Асимметрия мембран
Все биологические мембраны асимметричны, и легко понять почему: ведь каждая из них имеет две поверхности, омываемые разными средами. В качестве примера можно привести плазматическую мембрану, обращенную одной стороной в цитоплазму, а другой — во внеклеточное пространство. Именно трансмембранная асимметрия, дифференцирующая две половинки бислоя, обусловливает чувствительность мембраны к изменениям среды по обе ее стороны. Очевидно, что асимметрия мембранных белков зависит от способа, каким тот или иной белок был внедрен в мембрану. Скорость «флип-флопа» белков в бислое пренебрежимо мала. Мембранные липиды тоже расположены асимметрично. Наиболее убедительно это было показано для эритроцитов. Как возникает липидная асимметрия и как она поддерживается — в настоящее время во многом неясно. В одних случаях важную роль играют физические факторы, в частности кривизна мембраны, в других определяющий вклад вносят взаимодействия с цитоскелетом или участие АТР-зависимых ферментоподобных «флипаз».
Ясно, что помимо трансмембранной асимметрии мембранам присуща и латеральная негомогенность. Поверхностная мембрана многих эукариотических клеток сильно поляризована и имеет четко выраженные макроскопические домены. В качестве примера можно привести базолатеральную и апикальную области плазматической мембраны поляризованных эпителиальных клеток. Эти домены выполняют различные функции, имеют неодинаковый состав и физически разнесены по поверхности клетки. Мембраны тила-коидов в хлоропластах также имеют доменную структуру; в частности, у них есть плотно прилегающие друг к другу мембранные участки и несоприкасающиеся области, содержащие различные элементы системы электронного транспорта. Эти достаточно протяженные латеральные домены могут существовать за счет специфических белок-белковых взаимодействий между мембранами или могут быть обусловлены наличием в самой мембране специальных структур, взаимодействием с компонентами цитоскелета или агрегацией белков в плоскости мембраны. Детали этих взаимодействий пока неизвестны.
Что касается возможности существования малых липидных доменов в мембране, т. е. отдельных участков, в пределах которых бис-лой имеет специфические физические свойства и состав, то говорить об этом можно с меньшей определенностью. В модельных системах при различных условиях действительно наблюдается латеральное разделение фаз, и заманчиво было бы предположить, что подобное разделение существует и в биологических мембранах при физиологических условиях. Возможно, это не-бислойные элементы мембраны или какие-то переходные структуры.
Мы рассмотрим асимметричное распределение мембранных белков и липидов. В целом всю эту область можно назвать мембранной топографией. Сюда же относится и описание цитоскелета, поскольку он, по-видимому, играет важную роль в организации белков и, возможно, липидов в плазматической мембране эукариот.
1. Топография мембранных белков
Мембранные белки встроены в бислой асимметрично, и эта асимметрия регулируется кинетическими факторами. Энергия активации для такой переориентации белка в мембране, когда полярные и заряженные остатки, обычно находящиеся на поверхности, хотя бы временно оказываются в гидрофобной области бислоя, очень велика. И хотя известно, что некоторые мембранные белки диффундируют вдоль бислоя и/или вращаются вокруг оси, перпендикулярной его поверхности, нет никаких данных о том, что какое-либо спонтанное перемещение может привести к изменению транс-мембранной ориентации белка по отношению к двум сторонам бислоя.
В этом разделе представлен обзор основных экспериментальных подходов к определению трансмембранной ориентации белков в би-слое. Есть много способов, позволяющих предсказать локализацию спиралей, пронизывающих мембрану, исходя из первичной последовательности данного белка. В одних случаях эти предсказания являются достаточно четкими и согласуются с результатами экспериментальных исследований, в других однозначный ответ получить не удается. Ни одна модель, построенная с помощью компьютера, не является окончательной, она дает лишь исходную точку для анализа. Совершенно ясно, что любое детальное исследование интегрального мембранного белка должно включать экспериментальное изучение его топографии. Сделать это бывает непросто, и часто для построения адекватной модели приходится применять несколько подходов, поскольку ни один метод не застрахован от ошибок. Детальному рассмотрению отдельных экспериментальных подходов посвящены обзоры.
1.1 Методология протеолиз
Использование протеаз для определения топографии белков в ряде случаев оказалось исключительно плодотворным. Ориентированный мембранный препарат, содержащий изучаемый белок, обрабатывают протеолитическим ферментом и по местам расщепления устанавливают те участки полипептида, которые находятся с наружной стороны мембраны. Ключевым моментом является приготовление мембран с однозначной топологической ориентацией; только в этом случае возможна адекватная интерпретация результатов фрагментации изучаемого белка. Некоторые мембраны можно изучать без предварительного выделения. Однако в большинстве случаев необходима тщательная работа по получению топологически ориентированного препарата с вывернутой мембраной или с мембраной, имеющей нативную ориентацию. Такие препараты были получены для мембран эритроцитов, плазматических мембран некоторых эукариотических клеток, внутренних митохондриальных мембран, мембран саркоплазматического рети-кулума и некоторых бактериальных мембран. В отдельных случаях удается исследовать локализацию конкретного белка, специально встроенного в ориентированную мембрану реконструированных протеолипосом. В биологических мембранах помимо изучаемого белка чаще всего находятся и другие белки. Если изучаемый белок преобладает, то продукты протеолиза можно выделить и охарактеризовать. Если же он является минорным белковым компонентом, то для идентификации фрагментов приходится использовать косвенные методы, связанные с применением специфических антител или химических реагентов с последующим электрофорезом в ПААГ в присутствии ДСН. Важно убедиться в том, что те участки белка, которые недоступны для расщепления, не будут подвергаться гидролизу из-за повреждения мембран при первоначальном протеолизе. Необходимо также быстро и обратимо ингибировать протеа-зы, поскольку многие из этих ферментов остаются активными даже после добавления ДСН перед электрофорезом. Следует иметь в виду, что отсутствие расщепления еще ничего не означает, поскольку возможные места расщепления на наружной поверхности могут оказаться недоступными для протеазы из-за особенностей третичной структуры мембранного белка.
Как и в случае многих растворимых белков, протеолиз не обязательно сопровождается существенными изменениями в третичной или четвертичной структуре мембранного белка in situ, хотя его биологическая функция может быть полностью утрачена. В тех случаях, когда при расщеплении по одному или двум местам активность исчезает, с помощью протеолиза можно идентифицировать и даже выделить функционально важные домены белка.
В качестве примеров, иллюстрирующих использование протеоли-тических ферментов, можно привести белок полосы 3 эритроцитов, бактериородопсин, лактозопермеазу Е. coli и субъединицу IV цитохром с-оксидазы.
Иммунологические методы
Очень ценным инструментом для определения топографии мембранных белков являются специфичные антитела. В этом случае исследуют связывание антител с белками только в ориентированных мембранных препаратах типа мембранных везикул Е. coli. Анализ можно сделать количественным, если использовать соответствующие иммунологические методы. Места связывания можно локализовать с помощью электронной микроскопии, пометив антитела коллоидным золотом или используя золото, связанное со специфичным комплексом антиген—антитело на поверхности мембраны. Ясно, что в процессе приготовления мембранного препарата не должны разрушаться нативные топографические структуры. Чем точнее данные о местах связывания антител, тем информативнее будут эти эксперименты. Если исследовать ориентированные мембраны с нормальной или вывернутой ориентацией, то с помощью поли-клональных антител против определенного очищенного полипептидного фрагмента можно определить, имеет ли изучаемый белок участки, экспонированные на какой-либо одной стороне мембраны. Однако такие эксперименты не позволяют определить, какая часть белка экспонирована. Более детальную информацию можно получить с помощью двух подходов. Один состоит в использовании мо-ноклональных антител, а второй предусматривает применение поли-клональных антител против пептидов, соответствующих определенным областям белка.
Наиболее полезны те из них, которые связываются как с белком в мембране, так и с денатурированными фрагментами белка, что позволяет изучать белки после их разделения с помощью электрофореза в ПААГ в присутствии ДСН. Это особенно важно для локализации места связывания антител на полипептиде. В принципе эпитоп можно локализовать с точностью до нескольких аминокислотных остатков. В качестве примеров успешного использования моноклональных антител можно привести родопсин, бактериородопсин, ацетилхолиновый рецептор и белок LamB — рецептор фага X из наружной мембраны Е. coli.
Использование антител против синтетических пептидов, соответствующих отдельным белковым фрагментам, позволяет точно выяснить, доступна ли эта область белка для связывания антитела. Если антитела, специфичные к определенной аминокислотной последовательности, связываются с нативной формой белка в мембране, то исследователь получает мощный инструмент для определения топографии белка. Этим путем можно проверять отдельные топографические модели. Примерами успешного использования данного подхода являются работы по лактозопермеазе Е. coli, микросомному цитохрому Р450 и ацетилхолиновому рецептору. К сожалению, нет гарантий, что антипептндные антитела вообще будут связываться с белком. Потенциальный центр связывания в нативном белке может находиться в такой конформации или так быть упрятанным внутри белковой глобулы, что не будет узнан антителом или доступен для него. Действительно, в некоторых случаях антипептидные антитела не связываются с белком даже после его денатурации в ДСН.
Весьма остроумным является подход к определению топографии полипептида, основанный на методах молекулярной генетики. Он состоит во введении чужеродного эпитопа в аминокислотную последовательность мембранного белка с последующим использованием антител, специфичных к этому эпитопу.
Химическая модификация
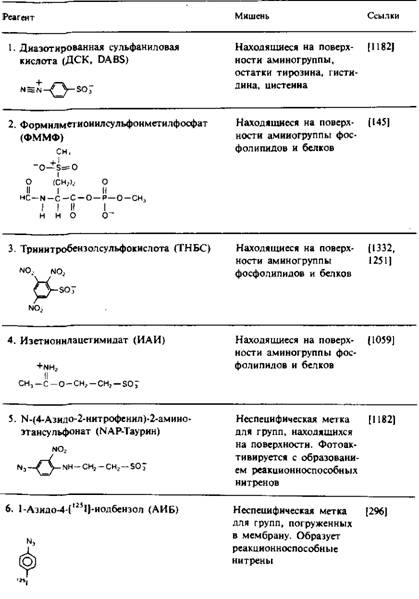
Этот подход широко использовался для локализации белков или их отдельных участков на поверхности мембраны или в ее гидрофобной области. Белок вступает в реакцию с реагентом, который может действовать лишь на одной стороне ориентированной мембраны или в ее гидрофобной сердцевине. Реагент, предназначенный для идентификации белка на поверхности мембраны, должен быть сильно полярным; он не должен адсорбироваться на мембране или накапливаться внутри ее. Для локализации же той части белка, которая находится в контакте с углеводородными хвостами липидных молекул, следует использовать очень неполярные реагенты, которые концентрируются в гидрофобной области мембраны. Артефакты, возникающие при этом подходе, чаще всего бывают связаны с тем, что реагент модифицирует белок не только в том реакционном пространстве, для которого он был предназначен. Например, реагент, направленный на модификацию поверхности мембраны, может иметь достаточно неполярный характер, чтобы проникать через мембрану и получать доступ к белкам внутреннего компартмента. Химическая модификация может также привести к повреждению мембраны и сделать ее проницаемой для того реагента, который, как ожидается, должен быть непроникающим. В табл. 1 перечислены некоторые из химических реагентов, используемые для изучения топографии мембранных белков.
Модификацию белков на поверхности мембраны часто проводят с помощью фермента лактопероксидазы, которая катализирует иодирование доступных остатков тирозина или гистидина. Поскольку реакция между I" и Н2О2 происходит в активном центре лактопероксидазы, последняя должна быть в высшей степени «векторной», т.е. локализованной только на одной стороне мембраны. Однако при определенных условиях в ходе реакции может образовываться Ь, который, проникая через мембрану, способен иодировать аминокислотные остатки на внутренней стороне мембраны. Это показывает, насколько важен строгий контроль условий протекания реакций для исключения артефактов.
Для поверхностной модификации часто используются и другие реагенты — соли диазония, которые реагируют с боковыми цепями остатков лизина, цистеина, тироксина и гистидина, а также фотоак-тивируемые реагенты, например NAP-таурин.
В табл. 1 перечислен также ряд неполярных фотоактивируемых реагентов, которые используются для избирательной модификации аминокислотных остатков белка, контактирующих с гидрофобной областью бислоя. Эти реагенты обычно добавляют к мембранному препарату, дают им возможность накопиться в бислое и затем подвергают их фотоактивации. Преимущество образующихся при этом нитренов и карбенов состоит в том, что их реакции намного менее специфичны по сравнению с реакциями других активных частиц, так что ковалентная модификация не ограничивается боковыми цепями каких-либо определенных аминокислот. Правда, нитрены проявляют избирательность по отношению к нуклеофилам. Использование карбенов предпочтительнее, поскольку они вступают в реакцию с более высоким выходом. Для получения информации о вторичной структуре трансмембранных участков полипептидной цепи путем определения тех остатков, которые контактируют с липидами, использовали реагент ТИД. Например, спираль С бак-
Таблица 1. Некоторые реагенты, применяемые для изучения топографии мембранных белков

териородопсина включает метку лишь с одной стороны; это согласуется с представлением о том, что данная спираль является трансмембранной, причем ее неполярная область обращена в липидную фазу.
Локализация специфических центров
Ценную информацию иногда можно получить, определяя положение специфических центров в ряде белков. Например, места присоединения сахарных остатков в гликопротеинах плазматической мембраны всегда находятся на ее наружной поверхности, так что выявление их в полипептидной цепи имеет и топологическую ценность. Столь же информативными могут быть и данные о локализации сайтов модификации белка, например сайтов фосфорилирования, если локализация модифицирующего фермента известна. Так, в белках плазматической мембраны фосфорилированные аминокислотные остатки находятся на цитоплазматической стороне. Аналогичным образом может оказаться полезной локализация специфических мест связывания. Например, были идентифицированы места связывания бактериофага с экспонированными на поверхности клетки участками белков ОтрА и LamB наружной мембраны Е. coli; для этого использовались мутантные белки.
Генетические подходы
Возможность генетической модификации мембранных белков привела к созданию новых подходов к их топографическому анализу. Такие методы, по всей вероятности, будут применяться все шире, однако пока число удачных примеров не столь велико, чтобы судить об их надежности и универсальности. Так, в белок ОтрА методами генной инженерии были встроены в определенные места короткие пептиды, затем был проведен протеолиз и по его результатам определено, были ли участки, содержащие включенный пептид, экспонированы на поверхности клетки. Анализ мутантных вариантов позволил идентифицировать также места связывания фага и соответствующие эпитопы в белках, экспонированных на наружной стороне мембраны.
Ценные данные о топографии белков цитоплазматической мембраны Е. coli были получены и с помощью метода гибридизации белков. Гибридные белки можно сконструировать так, что их N-концевой участок будет представлен мембранным белком, а на С-конце будет находиться каталитический центр щелочной фосфатазы. Щелочная фосфатаза обычно локализуется в периплазматическом пространстве Е. coli, куда она транспортируется и где проявляет свою ферментативную активность. Синтез многих мембранных белков, по-видимому, осуществляется линейным образом, начиная с N-конца. Поэтому, если место сочленения, где начинается последовательность щелочной фосфатазы, локализовано на периплаз-матической стороне мембраны, то гибридный белок будет транспортироваться в периплазму и проявлять ферментативную активность. Если же место сочленения находится на цитоплазматической стороне, то щелочная фосфатаза в гибридном белке останется внутри клетки и будет проявлять низкую ферментативную активность. Следовательно, те места сочленения в гибридных белках, которые приводят к высокой активности щелочной фосфатазы, будут соответствовать наружным доменам мембранного белка.
1.2 ПРИМЕРЫ АНАЛИЗА ТОПОГРАФИИ МЕМБРАННЫХ БЕЛКОВ
Один из наиболее ярких примеров детального топографического анализа мембранного белка — это изучение бактериородопсина. Как показывают данные по реконструкции изображения, бактерио-родопсин имеет семь трансмембранных сегментов, по-видимому представляющих собой а-спирали. Результаты протеолиза, химической модификации и связывания антител согласуются с этой моделью, хотя точные границы трансмембранных сегментов не установлены.
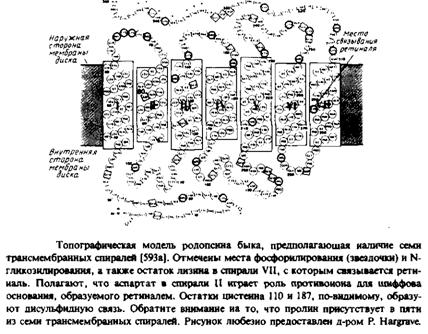
Еще один белок, для которого получены непротиворечивые топографические данные, — это бычий родопсин. В этом случае анализ первичной структуры тоже предполагает наличие семи трансмембранных а-спиралей с соединяющими их петлями. С такой моделью согласуются результаты изучения топографии с помощью антител и протеаз, а также данные о локализации мест фосфорилирования и присоединения углеводов. Обратите внимание, что хотя бактериородопсин и родопсин связывают одну и ту же простетическую группу — ретиналь — и, по-видимому, уложены в мембране одинаковым образом, никакой гомологии в их аминокислотной последовательности не наблюдается и выполняют они разные функции. Бактериородопсин является бактериальным светочувствительным протонным насосом, а родопсин — это зрительный пигмент, содержащийся в палочках сетчатки. Под действием света родопсин претерпевает светозависимые конформационные изменения, инициируя целый каскад событий, конечным результатом которых является зрительный сигнал.
Большое внимание было уделено анализу топографии еще одного трансмембранного белка — ацетилхолинового рецептора. Исходя из анализа первичной последовательности, было предложено несколько топографических моделей этого рецептора, адекватность которых проверялась с помощью иммунологических методов. Следует, однако, отметить, что полученные данные весьма противоречивы; это означает, что применение этих методов не всегда является оправданным.
В качестве последнего примера можно привести микросомный цитохром Ь$. Этот белок функционирует как переносчик электронов, участвуя в некоторых окислительно-восстановительных реакциях в эидоплазматическом ретикулуме. Цнтохром bs — это амфифильный белок, в котором гемсвязывающий каталитически активный домен соединяется с помощью десяти аминокислотных остатков с неполярным доменом — мембранным якорем. Эти два домена можно отделить друг от друга путем проте-олиза. Структуру гемсвязывающего фрагмента изучали методом рентгеноструктуриого анализа. Строение якорного пептида на С-конце белка неизвестно. Топографические исследования, проводившиеся в нескольких лабораториях, были направлены на выяснение одного простого вопроса: пересекает ли этот якорь бислой или он погружен в него только наполовину и, сделав петлю, идет обратно, так что его N- и С-концы оказываются по одну сторону мембраны? Несмотря на все усилия, окончательный ответ на этот вопрос пока не получен. В большинстве исследований использовался очищенный цитохромом bs, встроенный в фосфолипидные везикулы. Проблема состоит в том, что разные методики реконструкции дают разные кон-формации белковой молекулы. При «непрочном» связывании цито-хрома bs С-конец доступен для карбоксипептидазы Y и локализован на той же стороне, что и гемсвязывающий домен. Однако с помощью определенных методик можно получить «прочно» связанный домен, в котором С-конец недоступен для протеолиза, что, вероятно, отвечает топографической ориентации белка in vivo. Корана и др. пытались решить этот вопрос, изучая модификацию двух форм этого белка с помощью фотоактивируемых аналогов фосфолипидов. Они пришли к выводу, что в «прочно» связанной форме белка мембранный якорь пронизывает бис-лой. Этот вывод, однако, не нашел полной поддержки. Другие подходы либо вообще не позволили сделать выбор в пользу той или иной модели, либо дали противоречивые результаты.
Все сказанное выше показывает, что в отсутствие структурных данных высокого разрешения трудно определить способ укладки интегральных белков в мембране. И в самом деле, число белков, для которых это удалось сделать, очень мало.
2. Цитоскелет
В принципе как трансмембранное, так и латеральное распределение мембранных компонентов может зависеть от их взаимодействия со структурами, находящимися на поверхности мембраны. В ряде случаев такая зависимость была четко выявлена, в частности с этим связан все более возрастающий, интерес к взаимодействию мембраны с цитоскелетом. Цитоскелет — это сложная сеть волокон разного типа, обнаруженная в эукариотических клетках. У прокариоти-ческих клеток ничего подобного не выявлено. Основная функция этой системы, по-видимому, связана с механикой клетки. Цитоскелет обеспечивает механическую опору для плазматической мембраны и тем самым определяет форму клетки, а также местоположение клеточных органелл и их перемещение при митозе. С подвижностью внутриклеточных мембранных везикул связаны такие процессы, как эндоцитоз, экзоцитоз и фагоцитоз, а также перемещения плазматической мембраны при амебоидном движении клеток. Все эти процессы осуществляются с участием цитоскелета. По сути цитоскелет является динамическим каркасом клетки, который реагирует как на внутренние, так и на внешние стимулы. Часть этой системы тесно связана с плазматической мембраной. В настоящее время лучше всего охарактеризован мембранный скелет эритроцитов млекопитающих. Менее детально изучены биохимические свойства цитоскелета микроворсинок щеточной каемки кишечного эпителия. Обычно ци-тоскелет представляет собой трехмерную сеть волокон, охватывающую всю клетку. В некоторых точках он прикреплен к плазматической мембране, и эти области, как известно, участвуют в межклеточных контактах или в фокальных контактах, с помощью которых клетки прикрепляются к субстрату в клеточных культурах.
Предполагается, что именно благодаря взаимодействиям цитоскелета с мембраной возникает трансмембранное распределение ли-пидов, стабилизируются латериальные белковые домены и обеспечивается направленное перемещение белков в мембране.
Цитоскелетную сеть образуют три типа волокон: 1) микрофила-менты, состоящие из актина и связанных с ним белков; 2) промежуточные филаменты, состоящие из кератинов и родственных им белков; 3) микротрубочки, состоящие из тубулина. В биохимическом отношении лучше всего изучено связывание с мембраной актиновых мик-рофиламентов. Особого рассмотрения здесь заслуживает актин-спектриновая сеть эритроцитов. Эти белки способствуют объединению актиновых волокон в пучки, прикрепляют филаменты к мембране, образуют сшивки в актине, регулируют длину филаментов, влияют на их сократительную способность и обеспечивают отклик на Са2+. В ряде случаев актин участвует в сократительной активности. Микрофиламенты разрушаются цитоха-лазинами.
Микрофиламенты могут располагаться параллельно цитоплазматической мембране, как в сократимом кольце в делящейся клетке, или могут быть связаны с плазматической мембраной одним своим коццом, как в местах адгезии в области контакта клетка—клетка или клетка—субстрат. Полагают, что связывание актина с мембранами обеспечивается несколькими мембранными белками. Из данных о физической близости микро-филаментов к мембране, о биохимических взаимосвязях микрофила-ментов и разрушающем воздействии цитохалазина следует, что микрофиламенты участвуют во многих мембранных процессах, в частности в опосредуемом рецепторами эндоцитозе, пэтчинге и кэппинге, клеточной подвижности и цитокинезе. С биохимической точки зрения лучше всего охарактеризованы взаимодействия актина с мембраной у эритроцитов.
ПРОМЕЖУТОЧНЫЕ ФИЛАМЕНТЫ
Это полимеры, состоящие из одного или двух фибриллярных полипептидов, которые различаются в клетках разного типа и кодируются семейством мультигенов. Примером являются кератины из эпителиальных клеток и виментин из клеток мезенхимы.
Функции промежуточных филаментов неизвестны. Мало что можно сказать и о биохимической основе их взаимодействия с мембранами.
МИКРОТРУБОЧКИ
Они состоят из тубулина, который хорошо охарактеризован и представляет собой а/?-гетеродимерный белок. Микротрубочки образуют цитоплазматическую сеть, которая, как полагают, связывает плазматическую мембрану с органеллами, например с митохондриями. Вдоль микротрубочек, по-видимому, происходит перемещение эндосом и лизосом. Есть доказательства, что тубулин прикрепляется к мембранам в особых точках. Выделен мембранный белок синапсин I, который, по-видимому, взаимодействует с тубулином. В ходе митоза цитоплазматическая сеть микротрубочек распадается и перестраивается в митотическое веретено. Микротрубочки разрушаются под действием колхицина.
МЕМБРАНА И ЦИТОСКЕЛЕТ ЭРИТРОЦИТОВ
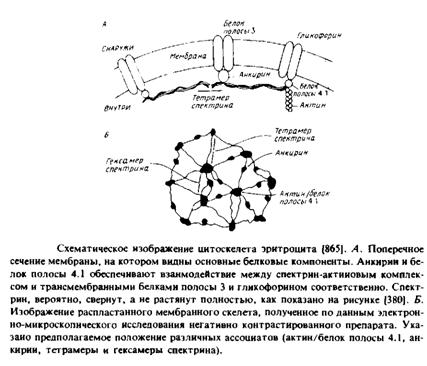
Наиболее детально изучены мембрана и цитоскелет эритроцитов млекопитающих. В табл. 4.2 перечислены основные белки, которые были разделены с помощью ДСН-ПААГ-электрофореза. Цифровые обозначения полипептидов связаны с их относительной электрофоретической подвижностью в геле. При промывании мембраны растворами с низкой ионной силой удаляются периферические мембранные белки, к которым прежде всего относятся компоненты цитоскелета. Основными интегральными белками цитоскелета являются белок полосы 3 и гликофорины А, В и С. Белок полосы 3 представляет собой анионный переносчик, а функции гли-кофоринов, относящихся к классу гликопротеинов, неизвестны. В электронном микроскопе цитоскелет выглядит как упорядоченная сеть на внутренней стороне мембраны. Как видно из табл. 4.2, белки цитоскелета являются основными мембранными компонентами, и это облегчает их биохимическую характеристику. По сути белковый каркас состоит из спектрин-актинового комплекса, который связан с плазматической мембраной благодаря взаимодействиям как с белком полосы 3, так и с гликофорином; эти взаимодействия осуществляются с помощью специальных белков — ан-
Таблица 2. Свойства, степень ассоциации и функции эритроцитарных мембранных белков


кирина и белка полосы 4.1. Основные компоненты были очищены до гомогенного состояния и изучены in vitro. Комплексы между основными белками, такими, как белок полосы 3 и анкирин или анкирин и спектрин, характеризуются константами диссоциации порядка Ю-7 М, которые могут меняться в физиологических условиях. Фосфорилирование анкирина влияет на его аффинность по отношению к спектрину, а взаимодействие между белком полосы 4.1 и гликофорином, по-видимому, модулируется фосфатидилинози-толами.
Интересно, что белки, близкородственные компонентам цитоскелета эритроцитов, обнаружены в ряде неэритроидных клеток. Большой интерес к цитоскелету эритроцитов, по всей вероятности, обусловлен тем, что данная система не является уникальной лишь для этих клеток, а представлена в виде кортикального цитоскелета и в клетках другого типа. Рассмотрим свойства некоторых цитоскелет-иых белков.
1. Спектрин. Это тетрамер типа г, в котором два гетероди-мера a/J объединены по схеме «конец-к-концу». Молекула может достигать в длину 2000 А. Спектрин связан с анкирииом и белком полосы 3 по сайтам, расположенным на противоположных концах молекулы. Кроме того, спектрин связан с актином, возможно, в комплексе с белком полосы 4.1. Спектринопо-
добные молекулы, например фодрин, обнаружены в клетках разного типа.
2.Актин. Это глобулярный белок, который существует в виде линейных олигомеров, содержащих по 12—18 молекул. Они выглядят на электронных микрофотографиях как короткие стержни, к которым может быть прикреплено до шести спектриновых тетрамеров.
3.Анкирин. Это наиболее охарактеризованный растворимый белок, обеспечивающий взаимодействия между интегральными мембранными белками и цитоскелетом. Он имеет отдельные домены, ответственные за независимое связывание со спектрином и с цитоп-лазматическим доменом белка полосы 3. Анкирин был обнаружен и в неэритроидных клетках.
4.Белок полосы 4.1. Он также относится к классу белков, обеспечивающих связь цитоскелета с мембраной. Белок полосы 4.1 связывается со спектрином и актином, а также с гликофорином. Кроме того, при определенных условиях он может связываться и с белком полосы 3. Белку полосы 4.1, по-видимому, родствен синапсин I, обнаруженный в мембране синаптических везикул.
5. Белок полосы 3. Это основной анионный переносчик в эритроцитах. Цитоплазматический домен содержит на N-конце кислый участок, который связывается с некоторыми гликоли-тическими ферментами, а также с гемоглобином. Цитоплазматический домен не участвует в транспорте анионов. Его сегмент, расположенный вблизи мембраны, связывается с анкири-ном и с белком полосы 4.2. На основании анализа аминокислотной последовательности было высказано предположение, что белок полосы 3 имеет 12 трансмембранных сегментов, но полученные к настоящему времени экспериментальные данные не позволяют ни подтвердить, ни опровергнуть это положение.
6. Гликофорин А. Это основной сиалосодержащий гликопротеин; В отличие от белка полосы 3 он имеет относительно небольшой цитоплазматический домен и один трансмембранный сегмент. Полагают, что этот белок связывается с белком полосы 4.1. Другие его функции неизвестны.
Трансмембранная асимметрия липидов
Мембранные белки, находясь в плоскости бислоя, не меняют Свою топологическую ориентацию. Они встраиваются в мембрану в jCTporo определенной ориентации и остаются в таком положении в течение всего времени их жизни. Липиды ш ряде биологических мембран, напротив, с довольно большой частотой мигрируют с одной стороны мембраны на другую. Определить скорость трансмембранной миграции липидов очень важно по двум причинам: это помогает понять Природу липидной асимметрии и позволяет критически оценить пригодность методов, используемых для нахождения распределения липидов между двумя сторонами бислоя. Чтобы измерения содержа-1кия, например, фосфатидилсерина на наружной стороне мембранных везикул были достоверными, они должны быть завершены до того, как фосфатидилсерин из внутреннего монослоя переместится в наружный. Некоторые методы установления липидной асимметрии модифицируют саму изучаемую систему и индуцируют трансмембранную миграцию липидных молекул, поэтому полученные результаты бывает трудно интерпретировать. Детальная оценка достоинств и недостатков методов изучения липидной асимметрии в мембранах дается, например, в обзорах.
МЕТОДЫ УСТАНОВЛЕНИЯ ТРАНСМЕМБРАННОГО РАСПРЕДЕЛЕНИЯ ЛИПИДОВ
Химическая модификация фосфолипидов
Относительно легко подвергаются химической модификации только аминофосфолипиды, например фосфатидилсерин и фосфати-дилэтаноламин. При этом мембранный препарат с известной топологической ориентацией обрабатывают реагентом, который не проникает через бислой и ковалентно связывается со свободными аминогруппами тех аминофосфолипидов, которые находятся только на наружной поверхности мембраны. Чаще всего с этой целью используют ТНБС. Доля фосфатидилэтаноламина, вступившего в реакцию, должна служить мерой его содержания на наружной стороне мембраны. Очевидно, однако, что такой вывод неправомочен, если реакция не доходит до конца или если в ходе реакции значительное количество фосфатидилэтаноламина перемещается с внутренней стороны мембраны на наружную и становится доступным для реагента. Как правило, в реальной ситуации имеют место оба обстоятельства, что значительно осложняет интерпретацию результатов.
Предложен вариант этого подхода, предусматривающий синтез аналогов фосфолипидов с реакционноспособными сульфгидрильны-ми группами с последующим использованием непроникающих реагентов, избирательно реагирующих по SH-группам. Естественно, что эти липидные аналоги следует включать в изучаемые мембраны перед обработкой реагентами, и желательно предварительно исследовать их поведение в модельных системах.
Фосфолипидный обмен
Спонтанный обмен фосфолипидами между мембранами, как правило, протекает с пренебрежимо малой скоростью. Однако были выделены белки, называемые липидпереносящими белками, которые катализируют обмен. Эти белки чаще всего выделяют из тканей млекопитающих. Наиболее изучен белок из печени крысы, который обладает абсолютной специфичностью по отношению к фосфатидилхолину и катализирует его обмен между мембранами. Большинство других липидперенося-щих белков менее специфичны к полярным головкам липидных молекул. Это растворимые белки, которые имеют высокоаффинные места связывания фосфолипидных молекул. Механизм обмена неизвестен, однако ЛПБ можно использовать для изучения липидной асимметрии, поскольку они связывают липиды только наружной поверхности бислоя, с которыми они контактируют. Обычно мембранные везикулы инкубируют с избытком липосом, содержащих радиоактивно меченный фосфолипид, в присутствии липидперенося-щего белка. Фосфолипидный обмен со стехиометрией 1:1, который катализируется указанными белками, не приводит к изменению состава мембран, при этом степень обмениваемости фосфолипидов можно определить, измерив удельную радиоактивность мембраны. Если фосфолипид в мембране полностью доступен для обмена, то его удельная радиоактивность в липосомах и мембранах в конце эксперимента будет одинаковой. Если же изучаемый липид на внутренней стороне мембраны недоступен для обмена, то его удельная радиоактивность в мембране будет ниже, чем в липосомах. Если трансмембранная миграция протекает медленнее, чем устанавливается равновесие при обмене, то удельная радиоактивность будет возрастать во времени, и это возрастание будет отражать скорость флип-флопа. При проведении этих экспериментов необходимо отделять липосомы от изучаемых мембран; для этого обычно используют центрифугирование.
Достоинство этой методики состоит в том, что ЛПБ не проникают через мембрану, недостаток же связан с тем, что равновесие устанавливается медленно, за несколько часов или даже больше. Поэтому данная методика неприменима, когда происходит быстрая трансмембранная миграция, но ее можно использовать в сочетании с другими методами. Например, можно провести обмен радиоактивных липидов, находящихся на наружной поверхности бислоя, а затем использовать фосфолипазы для оценки скорости, с которой эти липи-ды мигрируют с наружной стороны мембраны на внутреннюю.
Фосфолипазы
Фосфолипазы — это ферменты, гидролизующие фосфолипиды по связям, указанным на рис. 4.3. Фосфолипазы пре
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Астрономические основы календаря
1 Предпосылки появления календаря2 Элементы сферической астрономии2.1 Основные точки и линии небесной сферы2.2 Небесные координаты2.3 Кул
- Белки нервной системы
Значительная часть белков нервной системы идентична белкам других органов и тканей в силу общности ряда базовых процессов жизнедеятел
- Беспозвоночные черви
К типу круглых червейотносятся такие организмы, у которых тело вытянуто в длину, не подразделяется на отдельные членики и имеет в общем
- Биоиндикация почвы по беспозвоночным
Глава 1. Биоиндикация загрязнения почвы1.1 История развития и изучения биоиндикации почвы1.2 Структура животного населения почвы и фактор
- Биологическая роль витаминов, липидов, процессов брожения
1. Классификация, свойства и биологическая роль витаминовСовременная классификация витаминов не является совершенной. Она основана на
- Биологические основы выращивания белуги (Huso huso)
- Биологические основы выращивания рыбца
Рыбное хозяйство в Российской Федерации является комплексным сектором экономики, включающим широкий спектр видов деятельности – от п
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

