Химия элементов: молибден
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра ТОПП
Расчётно-графическая работа по неорганической химии
Тема: "Химия элементов"
МОЛИБДЕН
Вариант 3
Факультет: ЭМ
Группа: ЭМ-712 Преподаватель:
Студент: Бусыгина Н.С. Шевницина Л.В.
Новосибирск 2008
Содержание
1. История открытия
2. Молибден в природе
3. Физико-химические свойства молибдена
4. Переработка молибденового сырья
5. Важнейшие соединения молибдена
6. Применение молибдена и его соединений
7. Биологическая роль молибдена
8. Токсикология молибдена
9. Кластеры, содержащие атомы молибдена
Список литературы
1. История открытия
Молибденит (дисульфид молибдена, MoS2) был известен древним грекам и римлянам с незапамятных времен. Этот свинцово-серый с металлическим блеском минерал (другое название - молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом. Мягкость минерала позволяла использовать его (вместе с графитом) как грифель для карандашей, поэтому долгое время молибденит путали с галенитом и графитом, хотя, в отличие от последнего, он оставлял на бумаге зеленовато-серый цвет. Сходство древнегреческих названий свинца - mólubdV, и галенита - molubdaina было причиной того, что в средневековой Европе три минерала (PbS, MoS2 и графит) имели одно название - Molybdaena. История открытия элемента № 42 связана со Швецией. В 1758 шведский минералог и химик Аксель Фредерик Кронштедт (1722-1765) высказал предположение, что графит, галенит и молибденовый блеск три самостоятельных вещества. Двадцать лет спустя, в 1778, химическим составом молибденита заинтересовался шведский химик Карл Вильгельм Шееле. Прокипятив его с концентрированной азотной кислотой, он получил белый осадок "особой белой земли", которую назвал молибденовой кислотой. Хотя во времена Шееле и не знали, что "земли" представляют собой оксиды металлов, уникальная химическая интуиция подсказывала ему, что металл можно получить прокаливанием молибденовой кислоты с углем. Экспериментальные трудности (у него не было подходящей печи) не позволили Шееле самостоятельно решить эту задачу и лишь в 1782 шведскому химику Петеру Якобу Гьельму (Peter Jacob Hjelm), которому Шееле прислал образец молибденовой кислоты, удалось восстановить ее углем и получить королек металла (сильно загрязненного карбидами). После удачно проведенного опыта Шееле писал Гьельму: "Радуюсь, что мы теперь обладаем металлом - молибденом!"
Относительно чистый металл удалось получить много лет спустя Йенсу-Якобу Берцелиусу в 1817. Совершенно чистый молибден, способный к ковке, получили лишь в начале 20 в.
Долгое время с момента открытия молибдена К. Шееле этот металл оставался лабораторной редкостью до того, как в конце 19 в. был предложен промышленный способ извлечения молибденита. В 1891 французская фирма Schneider & Co впервые начала использовать молибден в качестве легирующей добавки, придающей стали одновременно высокую твердость и вязкость. Это редкое сочетание ценных свойств в одном металле было сразу оценено по достоинству, так как, обладая плотностью в два раза меньшей, чем плотность вольфрама, молибден являлся почти равноценной его заменой. Резкий скачок в объеме потребления молибдена произошел во время Первой мировой войны, так как темпы производства металлического вольфрама, использовавшегося в качестве легирующей добавки в производстве броневой стали, явно отставали от темпов его увеличивающегося потребления. К этому времени уже были известны замечательные свойства молибдена как легирующей добавки, но основные проблемы были связаны с нехваткой разведанных месторождений молибденита. Интенсивные поиски увенчались успехом лишь в 1918, когда в "долине облаков", в Колорадо было открыто крупнейшее в мире месторождение Клаймакс. Интересно, что 75-миллиметровая броня (сталь, легированная марганцем) появившихся на полях сражений в 1914-1918 танков англо-французских войск легко пробивалась 75-миллиметровыми снарядами немецкой артиллерии. Стоило только добавить молибден (в количестве всего 1,5-2%) к стали, как эти снаряды становились бессильны даже против 25-миллиметровых броневых листов.
2. Молибден в природе
Типы месторождений. Молибден относится к редким элементам, его кларк в земной коре равен 1,1·10-4% по массе. Кроме того, оценено общее содержание его во Вселенной (5·10-7% по массе или 10-8% от общего количества атомов), на Солнце (9·10-7% (масс) или 10-8% (ат)), углеродистых метеоритах (1,2·10-4 (масс) или 2,5·10-5% (ат)), морской воде (10-6% (масс) или 6,4·10-8% (ат)), речной воде (8·10-8% (масс) или 8·10-10% (ат)). В природе этот металл встречается только в виде соединений, известно около двух десятков его минералов, среди которых наиболее важны молибденит (MoS2), повелит (CaMoO4), молибдо-шеелит (Ca (Mo,W) O4), молибдит (xFe2O3·yMoO3·zH2O) и вульфенит (PbMoO4). Промышленное значение имеет только молибденит. Молибденовые руды принято делить по минеральному составу и форме рудных тел на жильные (кварцевые, кварц-серицитовые и кварц-молибденит-вольфрамитовые), прожилково-вкрапленные (кварц-молибденит-серицитовые, медно-молибденовые, медные порфировые с молибденом), скарновые (молибденовые, вольфрамо-молибденовые и медно-молибденовые). Серицит - природный алюмосиликат. Скарны - это породы, образовавшиеся на контакте известняков и кислых магматических пород типа гранитов, богатых кварцем. Медно-порфировые месторождения представлены породами, в которых кварцевые жилы с молибденитом образуют прожилки в измененной породе. Раньше наибольшее промышленное значение имели кварцевые жильные месторождения, сейчас жильные месторождения, в основном, выработаны и ценны прожилково-вкрапленные и скарновые месторождения. Более 60% запасов молибдена и около 70% его добычи приходится на медно-молибден-порфировые месторождения. Из них молибден добывается попутно с медью.
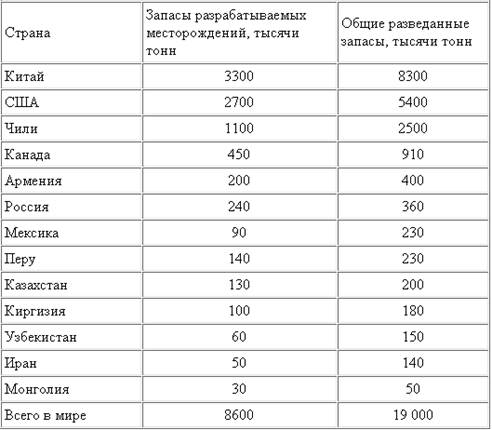
Cамое большое в мире месторождение молибдена - Клаймакс (англ. Сlimax - наивысшая точка, так как это самое высокое место в США) было открыто в 1924 в штате Колорадо и законсервировано с 1995 в связи с опасностью перепроизводства молибденовой продукции. Крупнейший рудник не будет разрабатываться до тех пор, пока запасы месторождения Empire в том же комплексе, в 100 км к востоку от Клаймакса, не будут истощены. Добыча молибденсодержащих руд в США ведется в Колорадо (рудник Henderson), Нью-Мексико (месторождение Questa), Айдахо (месторождение Thompson Creek). Попутное извлечение молибдена с медью идет в Аризоне (месторождения Bagdad и Sierrita) и Юте (Bingham Canyon). Точной информации о потенциальных ресурсах молибдена в Китае до сих пор нет, известно лишь, что основная добыча ведется в семи провинциях: Ляонин (горнорудный центр Хулудао), Шаньси (крупнейший молибден-порфировый рудник Циндуичэн), Хэбэй, Хэнань (месторождение Луанчуань), Цзянси (медно-порфировое месторождение Дэсин), Гирин, Шандун. Основная часть месторождений в Канаде расположена на территории Британской Колумбии (рудники Эндако и Китсолт). Ресурсы молибдена в Центральной и Южной Америке представлены, в основном, медно-молибден-порфировыми месторождениями, крупнейшими из которых (Chuquicamata, El Teniente, Los-Pelambres, Andina) владеет чилийская государственная корпорация Codelco (Corp. Nacional del Cobre de Chile). Кроме того, Мексика (месторождение La Caridad) и Перу (рудник Tokepala) располагают весомыми запасами молибдена. В России разведано десять месторождений молибдена, семь из которых промышленно осваиваются. Медно-молибден-порфировые месторождения есть в Сибири: крупнейшее в стране Сорское месторождение в Хакассии, уникальное по своим минералого-физическим и технологическим свойствам Жирекенское и Бугдаинское месторождения в Восточном Забайкалье, Орекитканское - в Бурятии. Разведаны также месторождения Агаскырское (Хакассия) и Лабаш в Беломорском районе Карелии. С 1940 разрабатывается скарновое Тырныаузское вольфрамо-молибденовое месторождение на Северном Кавказе, в Кабардино-Балкарии. В Читинской области есть и жильно-молибденовое месторождение - Шахтаминское, временно законсервированное вследствие истощения основных ресурсов. Руда с крупнейших Сорского и Жирекенского месторождений перерабатывается Сорским и Жирекенским горно-обогатительными комбинатами, оба они являются собственностью ОАО "Группа Сибирский алюминий".
3. Физико-химические свойства молибдена
МОЛИБДЕН - (Molybdenum), Mo - химический элемент 6 (VI Б) группы периодической системы, атомный номер 42, атомная масса 95,94. Известен 31 изотоп молибдена с 83Мо по 113Мо. Из них стабильные: 92Мо, 94Мо - 98Мо. Шесть этих изотопов и 100Мо (Т½ = 1,00·1019 лет) встречаются в природе: 92Мо (14,84%), 94Мо (9,25%), 95Мо (15,92%), 96Мо (16,68%), 97Мо (9,55%), 98Мо (24,13%), 100Мо (9,63%). Самые нестабильные изотопы элемента № 42 имеют периоды полураспада менее 150 нс. Наиболее устойчивая степень окисления +6.
Внешний вид металлического молибдена зависит от способа его получения. Компактный (в виде слитков, проволоки, листов, пластин) молибден - довольно светлый, но блеклый металл, а молибден, полученный в виде зеркала разложением, например, кабонила - блестящий, но серый.
Молибденовый порошок имеет темно-серый цвет. Плотность молибдена 10280 кг/м3. Температура плавления 2623° С, кипения 4639° С. Известна только одна (при обычном давлении) кристаллическая модификация металла с кубической объемноцентрированной решеткой.
В совершенно чистом состоянии компактный молибден пластичен, ковок, тягуч, довольно легко подвергается штамповке и прокатке. При высоких температурах (но не в окислительной атмосфере) прочность молибдена превосходит прочность большинства остальных металлов.
При загрязнении углеродом, азотом или серой молибден, подобно хрому, становится хрупким, твердым, ломким, что существенно затрудняет его обработку. Водород очень мало растворим в молибдене, поэтому не может заметно влиять на его свойства.
Молибден - хороший проводник электричества, он в этом отношении уступает серебру всего в 3 раза. Электропроводность молибдена больше, чем у платины, никеля, ртути, железа и многих других металлов. В обычных условиях молибден устойчив даже во влажном воздухе.
Его реакционная способность зависит от степени измельченности, и мелкий порошок все же медленно окисляется во влажном воздухе, давая так называемую молибденовую синь.
Энергичное взаимодействие молибдена с водяным паром начинается при 700° С, а с кислородом - при 500° С:
Mo + 2H2O = MoO2 + 2H2↑,
2Mo + 3O2 = 2MoO3.
Молибден сгорает в атмосфере фтора уже при 50-60° С, реакции с другими галогенами протекают при более высоких температурах:
Mo + 3F2 = MoF6
2Mo + 5Cl2 = 2MoCl5.
Разбавленные и концентрированные минеральные кислоты при нагревании растворяют молибден, но концентрированная HNO3 пассивирует его. При повышенных температурах с молибденом взаимодействуют сера, селен, мышьяк, азот, углерод и многие другие неметаллы. Основным промышленным способом получения металлического молибдена является реакция MoO3 с водородом:
MoO3 + 3H2 = Mo + 3H2O.
Процесс проходит в две или три стадии. Сначала молибденовый ангидрид восстанавливается до MoO2, а затем до свободного металла. Первая стадия восстановления проводится при 550° С. Если вторая стадия протекает ниже 900° С, то получающийся металл содержит значительное количество кислорода и поэтому необходима третья стадия восстановления, при 1000-1100° С и выше. Получающийся таким способом металл вполне пригоден для обработки методами порошковой металлургии. Долгое время не удавалось получить молибден в компактном состоянии, и только в 1907 была предложена методика получения молибденовой проволоки. Порошок металла смешивался с органическим клеящим веществом (сахарным сиропом) и продавливался через отверстия матрицы для получения сформованных нитей. Через эти нити в атмосфере водорода пропускался постоянный электрический ток с маленькой разностью потенциалов, при этом происходил сильный разогрев, органическое вещество выгорало, а частицы металла спекались - получалась проволока. Для получения компактного металла сейчас используются приемы порошковой металлургии, позволяющие получать слитки при температурах значительно более низких, чем температура плавления металла. Порошкообразный молибден прессуется на гидравлических прессах в стальных матрицах, нагревается в атмосфере водорода при 1100-1300° С и спекается при 2200° С в атмосфере водорода в толстостенных молибденовых лодочках. Кроме того распространен метод плавления молибдена в вакууме, в электрической дуге, возникающей между стержнем из спрессованного порошка молибдена и охлаждаемым медным электродом при силе тока 7000А и небольшой разности потенциалов. Иногда применяется плавление в сфокусированном пучке электронов или аргоновой плазме.
4. Переработка молибденового сырья
Перед химической переработкой молибденсодержащую руду нужно обогатить. Основным методом обогащения молибденитовых руд является флотация - способ разделения мелких частиц различных веществ, основанный на различной их смачиваемости и накоплении на поверхности раздела фаз. Сначала молибденитовая руда предварительно измельчается в дробилках, затем в шаровых мельницах, а потом поступает на коллективную сульфидную флотацию. С помощью этого процесса удается получить концентрат, содержащий до 10% молибдена. Полученный молибденовый концентрат поступает далее на селективную флотацию с применением специальных реагентов, в процессе которой (при заданном значении рН) происходит селективное отделение MoS2 от других сульфидов (халькопирита и пр). Повторяя этот процесс 5-6 раз (с промежуточным измельчением), получают, в зависимости от технологии и первоначального минералогического состава, качественный молибденовый концентрат с содержанием Mo 48-58,6%, Сu 0,01-2,2%. Следует отметить высокую степень извлечения молибденита в процессе флотации, составляющую 90-95% и выше. Первой и важнейшей стадией в процессе химической переработки молибденитового концентрата является обжиг, который позволяет избавиться от нежелательных примесей: серы, воды и остатков флотореагентов. В результате обжига происходит целевая реакция окисления дисульфида молибдена до триоксида
2MoS2 + 7O2 = 2MoO3 + 4SO2↑
и множество других побочных процессов, заметно влияющих на последующее извлечение молибдена:
6CuFeS2 + 19O2 = 2Fe3O4 + 6CuO + 12SO2↑
MoO3 + CaCO3 = CaMoO4 + CO2 ↑
MoO3 + CuO = CuMoO4
MoO3 + PbO = PbMoO4.
Температурный режим и эффективность обжига зависят от многих факторов, прежде всего от степени измельчения концентрата.
Огарок, содержащий молибденовый ангидрид, переводят либо в парамолибдат аммония или чистый MoO3, либо в молибдат кальция. Из двух первых можно в дальнейшем получить любые соединения молибдена, в том числе высокочистые. Наибольшее распространение при извлечении молибдена из огарков высококачественных концентратов получил аммиачный метод, так как в 8-10% водном аммиаке растворяется молибденовый ангидрид, и не растворяется большинство примесей, сопутствующих ему в огарке. В зависимости от состава концентрата и условий обжига удается извлечь 80-95% молибдена. Не извлеченный MoO3 перерабатывается по дополнительной схеме. Из аммиачного раствора молибдата аммония молибден можно извлекать в виде парамолибдата аммония (NH4) 6Mo7O24·4H2O, молибденовой кислоты H2MoO4 или молибдата кальция CaMoO4. Помимо аммиачного извлечения молибденового ангидрида иногда практикуется его возгонка из огарков (если в них мало содержание нелетучих молибдатов) в интервале температур 900-1000° С, которая позволяет получать MoO3 чистотой 99,95%.
5. Важнейшие соединения молибдена
В своих соединениях молибден проявляет степени окисления от +2 до +6, среди них наиболее устойчивы вещества, в которых молибден шестивалентен. Однако в природе наиболее распространен четырехвалентный молибден - в виде дисульфида. Помимо простых соединений этого элемента известно множество его гетерополисоединений. Подобно хрому, соединения молибдена бывают окрашены в различные цвета: белый, желтый, оранжевый, черный, коричневый, красный, синий, фиолетовый и другие цвета и оттенки. Оксид молибдена (IV) MoO2, серый аморфный порошок или фиолетово-коричневые кристаллы, устойчивые на воздухе. Получается при восстановлении молибденового ангидрида водородом при 550° С:
MoO3 + H2 = MoO2 + H2O.
Диоксид молибдена восстанавливается водородом до металла при 1000° С, а при сильном нагревании диспропорционирует:
3MoO2 = 2MoO3 + Mo.
Сульфид молибдена (IV) MoS2, черные очень мягкие (твердость всего 1-1,5 по шкале Мооса) и жирные на ощупь кристаллы с металлическим блеском, похожие на графит. Кристаллы имеют форму пластинок и при небольшом трении (например, о бумагу) расслаиваются на тончайшие лепестки, оставляя серо-зеленый след. Может быть получен при нагревании стехиометрических количеств простых веществ, разложением тиомолибдата аммония в инертной атмосфере или нагреванием MoO3 в атмосфере сероводорода:
Mo + 2S = MoS2
MoO3 + 3H2S = MoS2 + S + 3H2O
(NH4) 2MoS4 = MoS2 + H2S + S + 2NH3 ↑
MoS2 не растворяется в воде и разбавленных минеральных кислотах даже при нагревании, но окисляется концентрированной азотной кислотой до молибденового ангидрида. Дисульфид молибдена (IV) - полупроводник, поэтому может применяться в изготовлении высокочастотных детекторов, выпрямителей или транзисторов. Благодаря удивительной мягкости кристаллов MoS2 и их способности легко расслаиваться на тончайшие лепесточки чистое вещество применяется как компонент твердых и жидких смазочных материалов, в том числе предназначенных для эксплуатации при высоких температурах (до 400° С). Молибденит применяется в производстве изделий из керамики, так как при добавлении к глине способен окрашивать ее в синий или красный цвет (в зависимости от добавленного количества) при обжиге.
Молибдена (V) хлорид MoCl5, сильно гигроскопичные черные или темно-бурые игольчатые кристаллы c температурой плавления 194,4° С. Его получают действием хлора на порошок молибдена
2Mo + 5Cl2 = 2MoCl5
при нагревании или реакцией газообразного тетрахлорметана с молибденовым ангидридом при 250° С: Растворение MoCl5 в воде протекает бурно и сопровождается вскипанием, а во влажном воздухе он тоже довольно быстро гидролизуется:
MoCl5 + H2O = MoOCl3 + 2HCl.
Молибдена (VI) оксид MoO3, белое с зеленоватым оттенком мягкое кристаллическое вещество со слоистой структурой. При температурах выше 800° С заметно возгоняется. Может быть получен при нагревании молибдена или его сульфида на воздухе при 600° С, прокаливанием парамолибдата аммония или молибденовой кислоты на воздухе:
2Mo + 3O2 = 2MoO3
H2MoO4 = MoO3 + H2O
2MoS2 + 7O2 = 2MoO3 + 4SO2 ↑
(NH4) 6 (Mo7O24) = 7MoO3 + 6NH3↑ + 3H2O.
При нагревании с различными восстановителями (С, Ca, Al, H2, Mg и др.) восстанавливается до металла. Молибденовый ангидрид заметно растворим в воде (1,5 г/л при 100° С). При растворении в водных щелочах, подобно хрому, в зависимости от стехиометрии образует молибдаты или изополимолибдаты, например:
MoO3 + 2NaOH = Na2MoO4 + H2O
2MoO3 + 2NaOH = Na2 (Mo2O7) + H2O
3MoO3 + 2NaOH = Na2 (Mo3O10) + H2O
6MoO3 + 6NaOH = Na6 (Mo6O21) + 3H2O.
Триоксид молибдена используется для получения свободного металла и его сплавов, многих других соединений молибдена, в производстве глазурей и эмалей и как катализатор промышленного получения петролейного эфира.
Молибденовые кислоты. Известно несколько молибденовых кислот, например: молибденовая кислота H2MoO4 - бесцветный мелкокристаллический порошок, молибденовая кислота H2Mo2O7- белое кристаллическое вещество, изополикислота Н2 (Мо4О13) - сильная кислота, существующая в водных растворах.
Парамолибдат аммония (NH4) 6 (Mo7O24) ·4H2O - бесцветные призматические кристаллы, растворимые в воде. Выпадают при упаривании раствора (NH4) 2MoO4, образующегося при растворении молибденового ангидрида в избытке водного аммиака. В аналитической химии азотнокислый раствор парамолибдата аммония используется для качественного и количественного определения фосфорной кислоты и фосфатов. Наиболее широкое применение получил как компонент микроудобрений: молибдата аммония (около 50% Mo), простого молибденового суперфосфата (0,1% Мо и 19,5% Р2О5) и двойного молибденового суперфосфата (0,2% Мо и 43% Р2О5). Парамолибдат аммония является также полупродуктом при получении свободного металла
6. Применение молибдена и его соединений
Несколько столетий ученым в Европе не удавалось разгадать тайну остроты и прочности древних самурайских мечей и изготовить холодное оружие с подобными свойствами и только в 19в. в мечах 14 в. была обнаружена примесь молибдена, обусловливающая их высокую прочность. Долгое время с момента открытия молибдена К. Шееле этот металл оставался лабораторной редкостью до того, как в конце 19 в. был предложен промышленный способ извлечения молибденита. В 1891 французская фирма Schneider & Co впервые начала использовать молибден в качестве легирующей добавки, придающей стали одновременно высокую твердость и вязкость. Это редкое сочетание ценных свойств в одном металле было сразу оценено по достоинству, так как, обладая плотностью в два раза меньшей, чем плотность вольфрама, молибден являлся почти равноценной его заменой. Резкий скачок в объеме потребления молибдена произошел во время Первой мировой войны, так как темпы производства металлического вольфрама, использовавшегося в качестве легирующей добавки в производстве броневой стали, явно отставали от темпов его увеличивающегося потребления. К этому времени уже были известны замечательные свойства молибдена как легирующей добавки, но основные проблемы были связаны с нехваткой разведанных месторождений молибденита. Интенсивные поиски увенчались успехом лишь в 1918, когда в "долине облаков", в Колорадо было открыто крупнейшее в мире месторождение Клаймакс. Интересно, что 75-миллиметровая броня (сталь, легированная марганцем) появившихся на полях сражений в 1914-1918 танков англо-французских войск легко пробивалась 75-миллиметровыми снарядами немецкой артиллерии. Стоило только добавить молибден (в количестве всего 1,5-2%) к стали, как эти снаряды становились бессильны даже против 25-миллиметровых броневых листов. Хром-молибденовые и никель-молибденовые стали использовались (используются и сейчас) при выплавке металла для стволов артиллерийских орудий, винтовок, ствольных коробок и бронебойных снарядов благодаря своей высокой упругости и способности к точной токарной обработке. Конец войны и последующее снижение спроса дали толчок новым исследованиям применения молибдена. В 1925 немецкая фирма BASF (Баденская анилиново-содовая фабрика) запатентовала молибденсодержащий катализатор, устойчивый к действию серы в процессах гидрогенизации угля и повышающий их эффективность. Появилось большое число низколегированных молибденсодержащих автомобильных сталей, а в 1926 с конвейера сошел Wills Saint Claire - первая в мире марка автомобиля, сконструированного из стали с добавкой молибдена. В начале 1930-х началось активное использование молибдена в конструкционных материалах, в производстве быстрорежущих сталей, большинство которых всегда содержит добавку этого элемента. Сейчас 80% получаемого в мире молибдена используется в черной металлургии: в производстве низколегированных нержавеющих сталей, содержащих менее 4% Mo, быстрорежущих и других инструментальных сталей, доля молибдена в которых достигает 9,5%. Молибден улучшает легирующие свойства хрома в нержавеющих сталях, что особенно важно при их использовании в коррозионных средах, например, морской воде или в качестве конструкционных материалов в процессах нефтехимии. Металлорежущие молибденосодержащие инструменты могут закаливаться в процессе работы. В расплавы сталей элемент добавляется в виде молибдата кальция, молибденового ангидрида или ферромолибдена. Ферромолибден обычно получают при восстановлении огарков от обжига MoS2 в присутствии железа. Большая часть остального потребления элемента № 42 приходится на молибденсодержащие катализаторы, которые широко примененяются в процессах переработки нефти (крекинга, гидроочистки, риформинга), превращения метанола в формальдегид, парофазного окисления пропилена в акролеин, аммонолиза толуола, эпоксидирования различных алкенов и других. Чистый молибден находит ограниченное применение при изготовлении нагревательных элементов, а также в электровакуумной технике и электроламповом производстве. Первое место в мире по потреблению молибденовой продукции занимает Западная Европа (35%), за ней следуют США (25%) и Япония (17%). На долю этих регионов приходится более 90% мирового использования молибдена.
7. Биологическая роль молибдена
Молибден - один из основных микроэлементов в питании человека и животных. Он содержится во многих живых тканях и необходим для поддержания активности некоторых ферментов, участвующих в катаболизме пуринов и серосодержащих аминокислот. Активной биологической формой элемента является молибденовый кофермент (molybdenum cofactor, Moco) - низкомолекулярный комплекс небелковой природы, действующий в составе ферментов и необходимый для осуществления специфических каталитических превращений. Moco является коферментом четырех важных ферментов: ксантиндегидрогеназы, ксантиноксидазы, сульфитоксидазы и альдегидоксидазы. Ксантиндегидрогеназа катализирует превращение гипоксантина в ксантин, а затем в мочевую кислоту. Этот фермент, наряду с ксантиноксидазой, участвует в метаболизме пурина (образование NADH из NAD+). Сульфитоксидаза, находясь в митохондриях, участвует в метаболизме серосодержащих аминокислот - цистеина и метионина - и катализирует окисление сульфита в сульфат. Альдегидоксидаза принимает участие в реакциях катаболизма пиримидинов и биотрансформации ксенобиотиков - чужеродных для организма человека и животных веществ, порожденных в той или иной степени хозяйственной деятельностью человека и не входящих естественным образом в биотический круговорот. Именно со способностью альдегидоксидазы катализировать окисление в организме канцерогенных ксенобиотиков связывают предполагаемую антираковую активность молибдена. Лин Ксиан (Lin Xian) - местечко в провинции Хонан (Honan) на севере Китая было известно как область с наиболее высоким процентом заболеваемости раком пищевода среди местного населения. Проведенные исследования почвы показали низкое содержание в ней молибдена, наличие которого необходимо для нормального функционирования азотфиксирующих бактерий. Дело в том, что восстановление вносимых в почву нитратов осуществляется ими с помощью молибден-зависимого фермента нитратредуктазы. Недостаток молибдена уменьшает активность фермента, которой хватает лишь на то, чтобы восстановить нитрат не до аммиака, а до нитрозаминов, которые обладают, как известно, высокой канцерогенной активностью. Внесение в почву молибденовых удобрений значительно уменьшило процент заболеваемости населения. Несмотря на то, что молибден является малораспространенным элементом, случаи его дефицита в организме человека редки. Недостаток молибдена вызывает тяжелые заболевания. Наиболее богатые элементом № 42 пищевые продукты: бобовые и злаковые растения, листовые овощи, молоко, фасоль, печень и почки.
8. Токсикология молибдена
Молибден, попадающий в организм с растительной пищей, более токсичен, чем его неорганические соединения, и вызывает у животных изменения аналогично селену. Молибденоз наблюдается у людей и животных в определённых географических районах при избытке Мо в почве. Доказана роль Мо как биоэлемента в тканевом дыхании, установлено его влияние на пуриновый обмен, синтез аскорбиновой кислоты, углеводный обмен, на функцию половых желёз и вегетоэндокринные реакции и другие процессы. Существует определённый антагонизм между Mo и Cu; Zn усиливает токсичность Мо; известно взаимосвязь Мо и других микроэлементов, а также Mo с P и S. MoO3 и молибдаты ядовиты, металлический Mo и MoS2 менее токсичны.
У человека молибденоз напоминает подагру; повышается образование мочевой кислоты, наблюдается артрозы, полиартральгии.
У рабочих медно-молибденового комбината в крови повышенное содержание мочевой кислоты, снижены активность каталазы и количество глобулинов, увеличено общее содержание глутатиона. У рабочих молибденового цеха гипотония, лабияльность кровяного дыхания, функциональное нарушение нервной системы, нарушение обменных процессов.
При изготовлении изделий из молибдена в воздушной среде обнаружена высокодисперсная, содержащая молибден, пыль в концентрации 9,6-72,3 мг/м3. При этом у рабочих жалобы на частый кашель, сухость в носу, першение в горле; выявлены атрофические риниты, фарингиты, гастриты, сердечно-сосудистая гистония. При увеличении содержания молибдена в крови человека, содержание витамина С уменьшается.
99Мо циркулирует в крови в виде компелекса с белками; в печени и почках он образует прочный белковый комплекс. При депонировании в костях 64% от локализованного количества молибдена слабо сорбировано минеральной частью поверхностных костных пластинок, остальная часть связанна с альбумоидами и мукоидами кости. Выделение происходит главным образом с мочой. Скорость выделения определяется прочностью фиксации Мо в тканях.
Допустимая концентрация Мо 2-4 мг/м3.
9. Кластеры, содержащие атомы молибдена
Одно из важных направлений в современной неорганической химии - изучение кластеров. Это класс химических соединений, в составе которых имеется разное число атомов переходных металлов; взаимодействие между атомами металлов может меняться от весьма слабого до сильного. Исследования в данной области существенно расширили наши представления о природе химической связи. Теперь мы знаем, как удивительно богата и красива эта химия, кластеры демонстрируют уникальную реакционную способность, велико также и практическое значение таких соединений.
Вполне понятно стремление химиков получить кластеры, содержащие все большее и большее число атомов металла и имеющие наноразмеры. Еще недавно химики только мечтали о кластерах, содержащих несколько десятков атомов металла. Теперь кластеры, насчитывающие более 100 атомов металла, открыты.

Замечательные успехи по получению больших кластеров достигнуты в химии полиоксометаллатов. Из малых фрагментов, состоящих из атомов металла и кислорода, можно формировать очень большие (наноразмерные) молекулярные кластеры с уникальной структурой. Важные сообщения пришли совсем недавно из лаборатории профессора А. Мюллера (университет Билефельд, Германия). Получен самый большой неорганический кластер, строение которого определено методом рентгеноструктурного анализа. Он содержит 248 (!) атомов молибдена, связанных через мостиковые атомы кислорода. В подкисленных водных растворах молибдата при восстановлении быстро образуется раствор синего цвета, содержащий полиоксомолибдат, имеющий в своем составе 176 атомов молибдена. Структура кластера похожа на автомобильную покрышку и показана в левой части. Если такой большой кластер долго хранится в реакционном растворе, то в подходящих экспериментальных условиях происходит дальнейший его рост. При этом отверстие в кластере Mo176 закрывается симметрично с двух сторон крышками, в каждой из которых - 36 атомов молибдена. В целом структура гигантского кластера, имеющего наноразмеры, напоминает летающую тарелку. Внутри молекулярного кластера имеется большая эллипсовидная полость с размерами примерно 8,5х20 ангстрем.
При восстановлении молибдата в других экспериментальных условиях (в ацетатном буфере) образуется раствор другого цвета - красно-коричневый. Из него с высоким выходом получена и структурно охарактеризована аммонийная соль, имеющая в своем составе кластерный анионный комплекс уникального строения.
(Mo132O372 (CH3COO) 30 (H2O) 72) 42 -
Это гигантская наноразмерная сфера (диаметр около 25 ангстрем), построенная из более чем 500 атомов молибдена и кислорода, имеет икосаэдрическую симметрию.12 вершин икосаэдра заняты атомами молибдена фрагментов {MoO7}, которые в свою очередь связаны с 5 октаэдрами {MoO6} через общие ребра.30 биядерных фрагментов Mo2 связывают эти кластерные фрагменты, и из таких простых структурных фрагментов образуется сфера. Она имеет такие большие размеры, что внутри ее могут свободно разместиться несколько таких относительно больших молекул как фуллерен С60.
Список литературы
1. Ахметов Н.С. Общая и неорганическая химия. - 3-е издание, перераб. и доп. - М.: Высш. шк., 1998г.
2. Под ред. засл. деят. науки проф. Н.В. Лазарева и докт. биол. наук проф. И.Д. Гадаскиной. Вредные вещества в промышленности. - 7-е изд., перераб. и доп. в трёх томах. Том 3-й. неорганические и элементорганические соединения. - Л.: Хими, 1977г.
3. Зеликман А.Н. Молибден. Сборник, пер. с англ. - М., 1970г.
4. http://www.sbras.ru/HBC/article. phtml? nid=128&id=14
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Хімія в нашому житті
ПЛАНХімія в ванній кімнаті 3Вода. 3Поверхнево-активні речовини (ПАР) 3Зубні порошки і пасти. 4Хімія на кухні 5Щавлева кислота. 6Лимонна кисл
- Хром и методы его определения
- Хроматографический анализ
Хроматография - это физико-химический метод разделения и анализа смесей газов, паров, жидкостей или растворенных веществ сорбционными м
- Цинк и его свойства
- Шарль Вюрц - создатель основ химии
Шарль Адольф Вюрц — один из самых прославленных творцов научных основ химии. Превосходный теоретик, автор многих фундаментальных откры
- Щелочноземельные металлы
Часть первая. Общая характеристика IIА группы Периодической Системы элементов.В этой группе располагаются следующие элементы: Be, Mg, Ca, Sr, B
- Электролиты и их свойства
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

