Синтез диэтилового эфира малоновой кислоты. Свойства и основные методы получения сложных эфиров
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Самарский государственный технический университет
Кафедра: «Органическая химия»
“СИНТЕЗ ДИЭТИЛОВОГО ЭФИРА МАЛЕИНОВОЙ КИСЛОТЫ”
Курсовая работа
Выполнил:
Руководитель:
Самара, 2007 г.
Содержание
1. Введение
1.1. Свойства диэтилового эфира малеиновой кислоты
1.2. Практическое применение
1.3. Методика синтеза
2. Литературный обзор
2.1. Двухосновные (дикарбоновые) кислоты
2.2. Реакция этерификации
2.3. Механизм этерификации
3. Выводы
Список литературы
1.1. Свойства диэтилового эфира малеиновой кислоты
Диэтиловый эфир малеиновой кислоты, диэтилмалеат, этилмалеат C2H5OOCCH=CHCOOC2H5. Температура замерзания: ~-11.5°C, температура кипения: 225.3°C, дипольный момент: 2.54 Дебай, диэлектрическая проницаемость: 8.58 при 230С, плотность: 1.0687 при 20°С, г/мл, показатель преломления: 1.4400 при 20°С. Легковоспламеняющаяся жидкость
1.2. Практическое применение
Основная область применения диэтилмалеата – использование в качестве органического растворителя.
Органические растворители используются как в аналитической химии, так и в производстве. Среди потребителей органических растворителей – лаборатории и научно-исследовательские организации, предприятия нефтехимической, фармацевтической, парфюмерной, пищевой, электронной и оборонной промышленности.
Кроме того, широкое применение органические растворители, в частности диэтилмалеат, находят в лакокрасочной промышленности.
Постоянное ужесточение законодательства по охране окружающей среды привело к значительному вытеснению в последние годы традиционных красок на органических растворителях более экологически чистыми - водорастворимыми красками. Однако органоразбавляемые краски довольно часто используются в строительстве благодаря высокому качеству покрытий и относительному удобству применения. По разным оценкам их доля в общем объеме потребления строительных красок стабилизировалась на уровне 20-30%.
В настоящее время органоразбавляемые краски включены в программы большинства ведущих производителей лакокрасочных материалов. Чаще всего в качестве растворителя в современных органоразбавляемых красках применяют относительно низкотоксичный уайт-спирит, хотя иногда применяют и токсичные растворители (например, сольвент и ксилол). Кроме токсичности следствием применения в составе красок органических растворителей является их горючесть, а также характерный, часто достаточно сильный запах.
С появлением водоразбавляемых красок принято считать, что краски на органических растворителях имеют по сравнению ними всего два неоспоримых преимущества. Первое преимущество - возможность применения при отрицательных температурах (по материалам некоторых производителей до -20 0С). Второе преимущество - состоит в том, что свеженанесенное, еще не стабилизированное покрытие не может быть повреждено дождем.
Оба эти преимущества позволяют существенно расширить сезонность поведения работ, продлив ее на весну и осень. Теоретически возможно применение таких красок и в зимний период, однако это связано с рядом технологических сложностей, связанных с необходимостью предварительного оттаивания и осушения подложки.
Достаточно мощный импульс к использованию органоразбавляемых красок дало применения в качестве пленкообразователя специальный термопластиковой акриловой смолы Плиолит (PLIOLIT - торговая марка The Goodyear Tire & Rubber Co, USA).
Естественно краски на плиолитовых смолах обладают всеми перечисленными выше преимуществами органоразбавляемых красок, что однако не является главным. Главное же состоит в том, что они образуют достаточно хорошее покрытие, сравнимое с теми, которые можно получить с применением водоразбавляемых красок самых последних поколений.
На Российском рынке краски на основе плиолитовых смол представлены следующими фирмами: Alpa (Франция), Marshall (группа Akzo Nobel, Турция), Murolite (Швеция), Soframap (Франция)
1.3. Методика синтеза
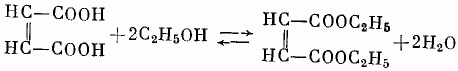
Малеиновая кислота .................... 29 г (0,25 г-моль)
Этиловый спирт 96%-ный.............. 32 г
Бензол ........................................... 20 мл
Серная кислота (d=1,84). Бикарбонат натрия
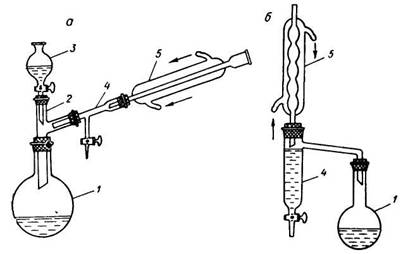
Приборы для проведения синтезов с азеотропной отгонкой воды: а – с холодильником Либиха, б – с шариковым холодильником, 1 – реакционная колба, 2 – двурогий форштосс, 3 – капельная воронка, 4 – «ловушка» для воды, 5 – обратный холодильник.
В круглодонной колбе, снабженной обратным холодильником и ловушкой для воды, смешивают 29 г малеиновой кислоты, 32 г этилового спирта, 1,5 мл концентрированной серной кислоты и 20 мл бензола. Смесь кипятят на водяной бане или колбонагревателе до прекращения выделения воды, охлаждают, переносят в делительную воронку и промывают водой, последовательно водным раствором бикарбоната натрия и еще раз водой. После этого отгоняют растворитель, который захватывает с собой и следы воды. Остаток перегоняют из колбы с дефлегматором.
Выход диэтилмалеата 34 г (79% теоретического), температура кипения 123°С при 12 мм рт. ст., ![]() .
.
2. Литературный обзор.
2.1. Двухосновные (дикарбоновые) кислоты
Диэтилмалеат является сложным эфиром двухосновной малеиновой кислоты. Чтобы иметь представление о свойствах и структуре данного эфира, рассмотрим кратко этот класс органических соединений.
Общая формула этих кислот НООС–(СН2)n–СООН. Тривиальные названия имеют только первые члены ряда:
| № | Название кислоты | Температура плавления | Растворимость, г/100 г Н2О при 20° С |
| 0 | Щавелевая | 179,5 | 8,0 |
| 1 | Малоновая | 135,6 | 73,5 |
| 2 | Янтарная | 188 ,0 | 5,8 |
| 3 | Глутаровая | 97,5 | 63,9 |
| 4 | Адипиновая | 153,0 | 1,6 |
| 5 | Пимелиновая | 105, | 5,0 |
| 6 | Пробковая | 144,0 | 0,16 |
| 7 | Азелаиновая | 106,5 | 0,24 |
| 8 | Себациновая | 134,5 | 0,1 |
| 9 | Нонандикарбоновая | 111 | |
| 10 | Декандикарбоновая | 128 | |
| 11 | Брассиловая | 113 | |
| 12 | Додекандикарбоновая | 126 | |
| 13 | Тридекандикарбоновая | 113,5 | |
| 14 | Тапсиевая | 125 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Синтез замещенных пирролов
Федеральное агентство по образованиюМосковская государственная академиятонкой химической технологииим. М.В. ЛомоносоваФакультет: Био
- Синтез зтилового спирта, этилбензола и алкилирование фенолов
- Синтез и анализ ХТС в производстве азотной кислоты
- Синтез и анализ ХТС в производстве ацетона
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИТЕХНОЛОГИЧЕСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТКАФЕДРА ХИМИЧЕСКОЙ Т
- Синтез и анализ ХТС в производстве бензина
Нефть и природный газ известны человечеству с глубокой древности. Описание источников нефти содержится в трудах Геродота (V век до н. э.)
- Фотометричне визначення вуглеводів в горілках
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТХІМІЧНИЙ ФАКУЛЬТЕТДИПЛОМНА РОБОТАна тему: ФОТОМЕТРИЧНЕ ВИЗН
- Фракционный состав нефти
Copyright © https://referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

