Рассеяние электронной плотности в металлах и ионных кристаллах по рентгенографическим данным
Экспериментальные исследования распределения электронных плотностей в кристаллах по данным рентгено - и нейтронографических измерений в последние годы значительно расширились. Этому способствует, во-первых, то обстоятельство, что получаемые карты распределения электронных плотностей в кристаллах дают возможность не только качественно судить о характере связи, но и количественно определять ряд физических свойств кристаллов. Метод определения физических свойств кристаллов по рентгенографическим данным распределения электронных плотностей в кристаллах, предположенный и развитый институтом физики твердого тела и полупроводников Академии наук Беларуси, находит широкое признание и используется во многих исследовательских центрах. Во-вторых, успешному развитию исследований природы химической связи рентгено - и нейронографическими методами в последнее время способствует значительное повышение точности абсолютных измерений интенсивности дифракционных рефлексов и определение кривых атомнорассеивающих факторов.
Очевидно, что функция распределения электронной плотности в кристалле – не только важнейшая характеристика особенности химической связи, но и непосредственно количественно связана с волновой функцией, являясь квадратом ее модуля. Поэтому определение распределения электронной плотности различными способами – по данным рассеяния рентгеновских лучей и электронов, методами ядерного гамма-резонанса, по комптоновским профилям и другими методами – важнейшая задача экспериментального исследования химической связи и представляет собой экспериментальную основу квантовой химии.
Проблема восстановления волновой функции, достаточно точно описывающей действительное распределение электронов в кристалле и, следовательно, особенности межатомной химической связи, до сих пор не может считаться полностью решенной. Наиболее прямые методы нахождения функции распределения электронной плотности в кристаллах по рассеянию рентгеновских лучей, электронов и нейронов приводят к достаточно надежным результатам лишь для кристаллов, для которых первые бреговские рефлексы лежат при сравнительно малых значениях вектора обратной решетки. Для кристаллов этого типа интенсивности первых рефлексов в значительной мере определяются самой внешней частью электронных орбиталей. Однако к данному типу относится скорее меньшинство, чем большинство кристаллов.
Для восстановления и уточнения волновых функций, характеризующих истинное распределение внешней части электронов, в ряде случаев удобно и целесообразно использование косвенных методов, непосредственно характеризующих не функции распределения внешних электронов, а функции распределения момента количества движения, энергии ионизации, плотности состояния по энергиям.
В первую очередь к числу подобных методов следует отнести изучение комптоновских профилей. Открытый Комптоном эффект, как показал ряд исследований, в особенности работы Вейсса и его сотрудников, - весьма удобный и мощный метод изучения проблем химической связи. Существенными факторами, ограничивающими возможности исследования комптоновских профилей для изучения особенностей межатомной химической связи, являются чрезвычайно малая их интенсивность, сложность исследования элементов с большим порядковым номером, большая поглощающая способность и др.
Использование данных измерений комптоновских профилей позволяет найти функцию распределения плотности моментов и электронной плотности кристаллов во внешних частях орбиталей атомов. Измерения рассеяния рентгеновских лучей, электронов и нейронов дают возможность определять распределение электронной плотности во внешних и в особенности в средних частях электронных оболочек.
Объектами исследования в настоящей работе являлись литий с ОЦК и
алюминий с ГЦК кубическими решетками, а также бинарное соединение фторид лития со структурой хлорида натрия, предметом – интегральная интенсивность брегговских рефлексов, структурный множитель, функция атомного рассеяния, карты распределения электронной плотности для каждого объекта исследования при комнатной температуре.
Цель исследования – выяснить характер распределения электронной плотности в металлических и ионных кристаллах. Определить зависимость распределения электронной плотности от типа кристаллической решетки с металлической связью.
В соответствии с намеченной целью были поставлены следующие задачи исследования:
1. Систематизировать опыт исследований распределения электронной плотности и потенциала.
2. Рассмотреть методику определения интегральной интенсивности рефлекса исследуемых образцов.
3. Вычислить значения структурного и атомно-рассеивающего факторов лития, алюминия и фторида лития.
4. На основе экспериментальных данных построить карты распределения электронных плотностей лития, алюминия и фторида лития.
Новизна исследования:
Существующая модель металла, где ионы погружены в электронную «жидкость», не отражает химическую связь атомов друг с другом. В модели ионных кристаллов недостаточно ясно распределение электронной плотности между ионами.
В связи с этим исследование распределения электронной плотности рентгенографическим методом является актуальной проблемой, требующей ее решения.
Объем и структура диссертации:
Работа состоит из введения, литературного обзора, экспериментальной части, заключения, списка литературы и приложения. Работа изложена на 61 странице, включает в себя 32 рисунка, 8 таблиц, список литературы содержит 37 источников.
Положения, выносимые на защиту :
Ø Методика и результаты расчета электронной плотности в металлах с различными типами решетки.
Ø Методика и результаты разделения атомно – рассеивающих факторов разных сортов атомов в бинарном соединении.
Ø Построение карт электронной плотности и их анализ.
Глава 1. Свойства исследуемых объектов и методы измерения электронной плотности по упругому рассеянию
1.1 Свойства исследуемых объектов
Литий. При обычной температуре литий кристаллизуется в кубической объемно-центрированной решетке, а = 3,5098 Å, в элементарной ячейке которой 2 атома с координатами (0,0,0) и (1/2,1/2,1/2). Литий - самый легкий металл; плотность 0,534 г/см3 (20°С); tпл 180,5°С, tкип. 1317°С. Удельная теплоемкость (при 0-100°С) 3,31·103 Дж/(кг·К), термический коэффициент линейного расширения 5,6·10-5. Удельное электрическое сопротивление (20°С) 9,29·10-4 Ом·м (9,29 мкОм·см); температурный коэффициент электрического сопротивления (0-100°С) 4,50·10-3. Металл весьма пластичен и вязок, хорошо обрабатывается прессованием и прокаткой, легко протягивается в проволоку. Твердость по Моосу 0,6 (тверже, чем Na и К), легко режется ножом. Модуль упругости 5 Гн/м2 (500 кгс/мм2), предел прочности при растяжении 116 Мн/м2 (11,8 кгс/мм2), относительное удлинение 50-70% . Пары лития окрашивают пламя в карминово-красный цвет. (1)
Литий является модельным образцом, поскольку он имеет всего лишь 3 электрона с электронной конфигурацией 1221. Это обстоятельство позволяет достаточно просто найти волновую функцию, описывающую состояние атома.
Литий (Li) - щелочной металл. В компактном состоянии серебристо-белого цвета. Получил название от греческого lithos (камень). Открыт шведским химиком А. Арфведсоном в 1817 г. в минерале петалите (алюмосиликата лития). Металлический литий впервые выделен английским ученым Дэви в 1818 г. электролизом оксида лития. В 1885 г. в значительных количествах металлический литий получен независимо друг от друга Бунзеном (Германия) и Матиссеном (Англия) путем электролиза (электролитом служил хлорид лития). Содержание лития в земной коре 0,0065 % (по массе). В свободном состоянии литий не встречается из-за большой химической активности.
В промышленности металлический литий получают путем электролиза расплавленного хлорида лития или смеси расплавленных хлорида лития и хлорида калия с применением графитированного анода и стального катода. Литий высокой чистоты (99,95%), почти свободный от примесей щелочных и щелочноземельных металлов, получают электролизом насыщенного раствора LiCl в пиридине, разложением соединения NH3Li в вакууме при 50-60 °С и восстановлением окиси лития алюминием в вакууме (примерно 10-1 Па) при 950-1000°С.
Физические свойства
Атомный номер 3, атомная масса 6,941 а. е. м., атомный объем ![]() м3/моль. Потенциалы ионизации атомов (эВ): 5,39; 75,61; 122,42. Из щелочных металлов Li обладает наименьшим атомным радиусом - 0,157 нм, а следовательно, наибольшим ионизационным потенциалом = 5,39 эВ, поэтому литий химически менее активен по сравнению с другими щелочными металлами. Ионный радиус Li+ равен 0,068 нм. Благодаря малому атомному радиусу литий обладает наиболее прочной кристаллической решеткой по сравнению с остальными щелочными металлами. Это обусловливает наиболее высокие температуры плавления и кипения лития по сравнению с его аналогами. При нормальной температуре литий имеет ОЦК решетку, период решетки 0,35023 нм, координационное число 8, межатомное расстояние 0,30331 нм. Ниже - 195 °С литий кристаллизуется в г. п. у. решетку с а = 0,3111 им и с = 0,5093 нм. Энергия кристаллической решетки 155,2 мкДж/кмоль. (2)
м3/моль. Потенциалы ионизации атомов (эВ): 5,39; 75,61; 122,42. Из щелочных металлов Li обладает наименьшим атомным радиусом - 0,157 нм, а следовательно, наибольшим ионизационным потенциалом = 5,39 эВ, поэтому литий химически менее активен по сравнению с другими щелочными металлами. Ионный радиус Li+ равен 0,068 нм. Благодаря малому атомному радиусу литий обладает наиболее прочной кристаллической решеткой по сравнению с остальными щелочными металлами. Это обусловливает наиболее высокие температуры плавления и кипения лития по сравнению с его аналогами. При нормальной температуре литий имеет ОЦК решетку, период решетки 0,35023 нм, координационное число 8, межатомное расстояние 0,30331 нм. Ниже - 195 °С литий кристаллизуется в г. п. у. решетку с а = 0,3111 им и с = 0,5093 нм. Энергия кристаллической решетки 155,2 мкДж/кмоль. (2)
Технологические свойства
Литий обладает очень высокой пластичностью и может легко деформироваться при комнатной температуре прессованием, прокаткой и волочением. При этом не происходит упрочнения, так как температура рекристаллизации лития лежит ниже 20 0С. В холодном состоянии литий легко режется ножом.
Области применения
Важнейшей областью применения лития и его соединений является ядерная энергетика. Дейтерид лития используется в качестве твердого горючего в водородных бомбах, жидкий 7Li - в качестве теплоносителя в ядерных реакторах. Ряд соединений лития применяют в военной технике, а также как топливо для ракет космических кораблей, управляемых снарядов подводных лодок, сверхскоростной авиации и т. д. Широко применяются соединения лития при получении керамики, эмали, специальных стекол, при сварке алюминиевых и магниевых сплавов, в химической промышленности, в холодильной технике, в радиоэлектронике и т. д. В металлургии литий, его соединения и литий содержащие сплавы используют для раскисления, дегазации и десульфурации расплавов различных металлов и сплавов. Литий используют для повышения прочности и пластичности сплавов, снижения их плотности, повышения коррозионной стойкости. Добавки лития к магнию позволяют получать сверхлегкие сплавы, плотность которых на 15-25 % ниже плотности стандартных магниевых сплавов. Легирование алюминия литием снижает плотность алюминиевых сплавов на 10-12 %. Литий улучшает антифрикционные и механические свойства подшипниковых сплавов, в частности в свинцовокальциевые баббиты вводят для этой цели 0,04 % Li. Литий улучшает литейные свойства чугуна. Некоторые соединения лития в последние годы находят применение в медицине.
Алюминий. (лат. Aluminium), Al, химический элемент III группы периодической системы Менделеева; атомный номер 13, атомная масса 26,9815, серебристо - белый легкий металл. Состоит из одного стабильного изотопа 27Al.
Наиболее характерными физическими свойствами алюминия является его малая относительная плотность, равная 2700 кг/м3 а также сравнительно высокие тепло- и электропроводность. При 0°C удельная электропроводность алюминия, т.е. электропроводность алюминиевой проволоки сечением 1 мм и длиной 1 м равна 37,1 Ом.
Температура плавления алюминия невысокая, она равна приблизительно 660oC. Однако скрытая теплота плавления его очень большая – около 100 кал/ г.
Кристаллическая решетка алюминия представляет собой гранецентрированный куб, имеющий при 20ºC параметр решетки 4,04Å. Элементарная ячейка содержит в себе 4 атома с координатами (0,0,0); (1/2,1/2,0); (1/2,0,1/2) и (0,1/2,1/2). (3)
Название алюминий происходит от лат. alumen - так еще за 500 лет до н. э. назывались алюминиевые квасцы, которые применялись как протрава при крашении тканей и для дубления кожи. Датский ученый X. К. Эрстед в 1825, действуя амальгамой калия на безводный АlСl3 и затем, отгоняя ртуть, получил относительно чистый алюминий. Первый промышленного способ производства алюминия предложил в 1854 французский химик А. Э. Сент-Клер Девиль: способ заключался в восстановлении двойного хлорида алюминия и натрия Na3AlCl6 металлическим натрием.
Физические свойства алюминия
Алюминий сочетает весьма ценный комплекс свойств: малую плотность, высокую теплопроводность и электрическую проводимость, высокую пластичность и хорошую коррозионную стойкость. Он легко поддается ковке, штамповке, прокатке, волочению. Алюминий хорошо сваривается газовой, контактной и других видами сварки. Свойства алюминий, как и всех металлов, в значит, степени зависят от его чистоты. Алюминий обладает невысокой прочностью (предел прочности 50-60 Мн/м2), твердостью (170 Мн/м2 по Бринеллю) и высокой пластичностью (до 50%). Обладая большим сродством к кислороду, алюминий на воздухе покрывается тонкой, но очень прочной пленкой оксида Al2О3, защищающей металл от дальнейшего окисления и обусловливающей его высокие антикоррозионные свойства.
Сочетание физических, механических и химических свойств алюминия определяет его широкое применение практически во всех областях техники, особенно в виде его сплавов с других металлами. В электротехнике алюминий успешно заменяет медь, особенно в производстве массивных проводников, например, в воздушных линиях, высоковольтных кабелях, шинах распределительных устройств, трансформаторах (электрическая проводимость алюминия достигает 65,5% электрической проводимости меди, и он более чем в три раза легче меди; при поперечном сечении, обеспечивающем одну и ту же проводимость, масса проводов из алюминия вдвое меньше медных). Сверхчистый алюминий употребляют в производстве электрических конденсаторов и выпрямителей, действие которых основано на способности оксидной пленки алюминия пропускать электрический ток только в одном направлении. Обладая относительно низким сечением поглощения нейтронов, алюминий применяется как конструкционный материал в ядерных реакторах.
В алюминиевых резервуарах большой емкости хранят и транспортируют жидкие газы (метан, кислород, водород и т. д.), азотную и уксусную кислоты, чистую воду, перекись водорода и пищевые масла. Алюминий широко применяют в оборудовании и аппаратах пищевой промышленности, для упаковки пищевых продуктов (в виде фольги), для производства разного рода бытовых изделий. Резко возросло потребление алюминий для отделки зданий, архитектурных, транспортных и спортивных сооружений.
Фторид лития - химическое соединение лития и фтора с формулой LiF. При нормальных условиях - белый порошок или прозрачный бесцветный кристалл, негигроскопичный, почти не растворим в воде. Растворяется в азотной и плавиковой кислоте. Образует ионный кристалл с кубической решеткой.
Фторид лития обладает очень высокой прозрачностью от ультрафиолетовой до инфракрасной области спектра (0,12...6 мкм), поэтому он используется в ультрафиолетовой и инфракрасной оптике. Кроме того, он используется для измерения доз облучения методом термолюминесцентной дозиметрии. Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски. Проявляет слабые сцинтилляционные свойства. Диэлектрик; характеризуется высоким удельным электрическим сопротивлением вследствие большой ширины запрещенной зоны.
Высокая теплота плавления (1044 кДж/кг) позволяет использовать фторид лития как материал для хранения тепловой энергии. При плавлении увеличивает свой объём на 22%. Жидкий фторид лития вызывает быструю коррозию металлов. Фторид лития применяют для растворения соединений урана и тория непосредственно в реакторах.
LiF применяется как флюс при плавке металлов, сварке магния и алюминия, при электролизе алюминия, для производства специальных оптических стекол, керамических глазурей и кислотостойких эмалей. Получается действием фтористоводородной кислоты на Li2СО3 или взаимодействием растворимых солей лития с фторидами калия или аммония.
Физические свойства
Бесцветный кристалл, растворим в воде 0,27 г/100 г (18°). В присутствии NH3 и, особенно, NH4F растворимость в воде падает. Не растворяется в большинстве органических растворителей (в отличие от других галогенидов лития).
1.2 Методы измерения электронной плотности по упругому рассеянию
В настоящей работе рассматривается распределение электронной плотности в металлических и ионных кубических кристаллах. Поэтому для наилучшего понимания результатов эксперимента, необходимо было выяснить принципы химической связи в кристаллах.
Химическая связь между атомами в кристаллах возникает за счёт взаимодействия внешних валентных электронов атомов, тогда как внутренние электронные оболочки практически остаются неизменными. На рис. 1.2.1 показаны типичные кривые потенциальной энергии и(r)межатомного взаимодействия. Равновесное расстояние rр между атомами обычно составляет 0,15-0,40 нм. При сближении атомов на расстояния меньшие, чем равновесное, возникает резкое их отталкивание. Это позволяет в первом приближении приписать атомам для того или иного типа связи определенные "размеры", т. е. некоторые постоянные радиусы, и тем самым перейти от физической модели кристалла к его геометрической модели как системе несжимающихся шариков.
По характеру химической связи кристаллы делятся на четыре основные группы: - ионные кристаллы (напр. NaCl), ковалентные (напр., алмаз, кремний), металлические (металлыи интерметаллические соединения) и молекулярные кристаллы (напр., нафталин).
электронный плотность комптоновский рассеяние
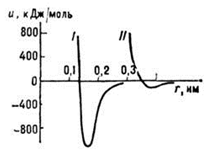
Рис. 1.2.1Кривые энергии межатомного взаимодействия: I-для сильной (ионной, ковалентной, металлической) связи, II -для слабой (ван-дер-ваальсовой) связи.
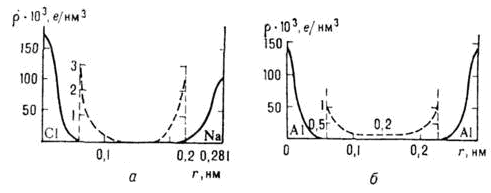
Рис. 1.2.2 Распределение электронной плотности на линии связи между атомами в кристаллах: а- ионная связь (NaCl), пунктирная линия - область внешних электронных орбит; б - металлическая связь (А1), пунктирная линия - плотность электронов в межатомном пространстве.
В ионных кристаллах внешние валентные электроны переходят от атомов металлов, которые становятся положительными ионами (катионами), к атомам неметаллов, которые становятся отрицательными ионами (анионами), что приводит к электростатическому притяжению между ними (рис. 1.2.2). Взаимодействие ионов является кулоновским, но при их соприкосновении начинают играть роль силы отталкивания между электронными оболочками; потенциальная энергия их взаимодействия описывается формулой
![]()
где r - расстояние между центрами ионов; и п - параметры, которые могут быть найдены из сжимаемости кристаллов; =(6-9). В межатомном пространстве в ионных кристаллах электронная плотность r (r)близка к нулю рис. 1.2.2, а.
Потенциальная энергия взаимодействия рассчитывается по формуле:
![]()
где m=4, а, α, С - константы, более точно uков получают из решения методами квантовой химии уравнения Шрёдингера.
Природа металлической связи та же, что и ковалентной, т. е. обобществление внешних валентных электронов атомов, однако характер локализации этих электронов иной - они приблизительно равномерно заполняют всё межатомное пространство, образуя общий электронный "газ", который и осуществляет коллективное взаимодействие с заряженными положительно атомами металла (рис. 1.2.2, б)
В молекулярных кристаллах атомы внутри молекул объединены прочными ковалентными связями, а атомы соседних молекул взаимодействуют за счёт более слабых ван-дер-ваальсовых сил, имеющих дипольное и дисперсионное происхождение. Расстояние между атомами соседних молекул 0,35-0,4 нм.
В работе о распределении электронной плотности и потенциала в решетке селенида марганца описывается разностный метод расчета электронной плотности.(4) В качестве исследуемого вещества выбран селенид марганца. По измеренным значениям интенсивностей подсчитывались абсолютные значения структурных амплитуд. При этом вводились поправки на дисперсию и температурный фактор.(5)
Измеренные структурные амплитуды (F) для селенида марганца представлены на рис. 1.2.3, а, где сплошными линиями нанесены теоретические значения F, рассчитанные по Хартри - Фоку для нейтральных атомов (6). Как видно из рисунка, экспериментальные значения структурных амплитуд определяющиеся разностью fSe– fMn , при малых значениях ![]() лежат выше теоретических.
лежат выше теоретических.
Подсчитанные по структурным амплитудам функции атомного рассеяния (рис. 1.2.3, б) при малых значениях H, также отличались от теоретических, причем для селена экспериментальные значения лежат выше теоретических, а для марганца ниже теоретических. Таким образом, полученные данные показали, что в решетке селенида марганца
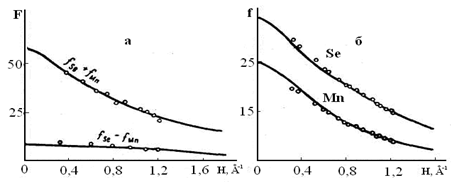
Рис. 1.2.3 Структурные амплитуды (а) и функции атомного рассеяния ионов (б)
ионы марганца имеют положительный заряд, а ионы селена отрицательный. Для оценки величины заряда ионов был выполнен разностный синтез трехмерного ряда Фурье
![]() (1.2.1)
(1.2.1)
для направлений (100), (110) и (111), результаты которого показали, что электронная плотность в области иона марганца уменьшается (![]() отрицательно), а в области иона селена увеличивается. Численный расчет показал, что величина заряда ионов в селениде марганца составляет примерно 1,2 ±0,2 эл. По полученным данным f-функций подсчитывалась электронная плотность в решетке MnSe между ионами марганца и селена с использованием разностного метода синтеза трехмерного ряда Фурье: (7)
отрицательно), а в области иона селена увеличивается. Численный расчет показал, что величина заряда ионов в селениде марганца составляет примерно 1,2 ±0,2 эл. По полученным данным f-функций подсчитывалась электронная плотность в решетке MnSe между ионами марганца и селена с использованием разностного метода синтеза трехмерного ряда Фурье: (7)
![]() (1.2.2)
(1.2.2)
где F1—структурная амплитуда преимущественно внутренних электронов, функция рассеяния которых аппроксимировалась в виде
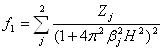 (1.2.3)
(1.2.3)
Коэффициенты Zjи ![]() определялись по данным привязки к f - функции при больших порядках отражения с использованием теоретических значений.
определялись по данным привязки к f - функции при больших порядках отражения с использованием теоретических значений.
Расчеты электронной плотности показали (рис, 1.2.4), что в направлении (100) между ближайшими ионами Mn-Se минимальное значение плотности электронов составляет примерно 0,15 эл/А3 и в направлении (110) между ионами Мn-Мn оно падает практически до нуля.
Для соединения МnО плотность между ближайшими ионами Мn - О в несколько раз больше, чем в MnSe, и составляет примерно 0,55 эл/А3, Это обстоятельство указывает на то, что в селениде марганца ковалентная составляющая связи значительно меньше, чём в закиси марганца, и MnSe является близким к чисто ионным кристаллам. (8)
Из измеренных экспериментальных функций атомного рассеяния ионов, входящих в состав соединения селенида марганца, было рассчитано распределение потенциала в решетке данного соединения. Распределение потенциала в решетке выражалось трехмерным рядом Фурье
![]() , (1.2.4)
, (1.2.4)
где структурная амплитуда
![]() .
.
Как видно из соотношения (1.2.4), распределение потенциала подсчитывалось непосредственно по экспериментальным значениям f - функций, полученным из данных интенсивности рентгеновских дифракционных спектров.
Расчеты показали, что если f - кривая какого-либо иона аппроксимируется выражением вида
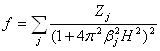 ,
,
то электронная плотность и потенциал этого иона будут описываться выражением
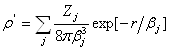 ,
,
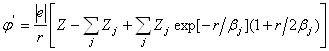 ,
,
где ![]() определяет степень ионизации рассматриваемого иона.
определяет степень ионизации рассматриваемого иона.
Таким образом, чтобы подсчитать значение потенциала в какой-либо точке решетки, необходимо просуммировать значения потенциалов в данной точке от всех окружающих ионов. Наибольший вклад вносили ионы, расположённые на первой и второй координационных сферах, так как от более удаленных ионов вклады уменьшаются как за счет расстояния, так и за счет взаимной компенсации ионов противоположного знака.
В работе (9) рассматривается распределение валентной электронной плотности в преимущественно ионных кристаллах с различающимися подрешетками Браве. Выяснилось, что в случае кристаллов с различающимися подрешетками Браве анионная подрешетка представляла собой ковалентно связанный каркас, в который помещалась подрешетка металла.
В качестве величины, характеризующей связь подрешеток, использовалась разностная плотность, полученная как результат вычитания из кристаллической электронной плотности плотностей отдельных подрешеток. Разностная плотность исследованных кристаллов оказывалась на порядок меньше кристаллической и подрешеточных, что свидетельствовало о слабой гибридизации подрешеток и преимущественно ионном характере связи между ними.
В работе (10) рассматривается перераспределения электронной плотности в области точечных дефектов в алюминии методом функционала электронной плотности.
Для правильного определения механизмов диффузии говорится о необходимости использования новых, более точных и корректных методов моделирования точечных дефектов и их комплексов в металлах и сплавах.
Одной из важнейших характеристик твердого тела является распределение электронной плотности. Особенно сильно влияет перераспределение электронной плотности на характеристики точечных дефектов, следовательно, его знание и учет являются ключевыми моментами в определении истинных диффузионных механизмов в металлах и сплавах.
В настоящее время наиболее перспективным и точным методом расчета характеристик точечных дефектов в металлах является метод функционала электронной плотности. Это единственный метод, который позволяет учитывать перераспределение электронной плотности в области точечных дефектов. Также к преимуществам данного метода следует отнести тот факт, что для расчетов он не требует экспериментальных данных и подгоночных констант, а основан исключительно на фундаментальных константах, таких как заряд ядра и электронное строение атома. К недостаткам данного метода следует отнести невозможность расчета систем размером более сотен атомов и необходимость использовать достаточно мощные вычислительные системы.
В основу теории функционала электронной плотности положена теорема Хоэнберга и Кона, согласно которой все свойства основного состояния неоднородного взаимодействующего электронного газа могут быть описаны с помощью введения некоторых функционалов от электронной плотности ![]() . Вместо обычного гамильтониана системы вводится функционал следующей структуры:
. Вместо обычного гамильтониана системы вводится функционал следующей структуры:
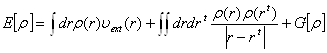
где vext (r) - внешнее поле, в которое входит поле ядер; функционал G() является универсальным и не зависит от внешнего поля. (11)
С помощью метода функционала электронной плотности, было проведено моделирование моновакансии в чистом алюминии. Моделирование проводилось для ячейки 4x4x4 (256 атомов).
Для бездефектного алюминия был определен параметр решетки, который равен аА! = 4,0468 Ǻ, что хорошо согласуется как с другими работами по моделированию , так и с экспериментальными данными.
Для алюминия содержащего моновакансию, была определена ее энергия образования, которая равна 0,66 эВ, что хорошо согласуется с работами, сделанными ранее, а также проведен расчет перераспределения электронной плотности при образовании вакансии (разность функций распределения электронной плотности в бездефектном алюминии и алюминии с вакансией). (12,13)
В работе (14) рассматривается расчет распределения электронной плотности и потенциала в алмазе по рентгенографическим данным. Распределение электронной плотности задается рядом Фурье
![]() , (1.2.5)
, (1.2.5)
где Fhkl - экспериментально измеренные величины структурных амплитуд, H– вектор обратной решетки, абсолютная величина которого дается соотношением
![]() ,
,
R–радиус-вектор точки с координатами (x,y,z), для которой определяется электронная плотность, V – объем элементарной ячейки.
Зная интегральные интенсивности дифракционных максимумов Ihkl, может быть определена следующего соотношения структурная амплитуда Fhkl:
![]() ,
,
где I0 – интенсивность первичного рентгеновского пучка, падающего на исследуемый образец, А* - произведение всех коэффициентов, входящих в выражение для интенсивности брегговского рефлекса.
Ряд (1.2.5) оказывается слабо сходящимся и его вычисление для известных значений структурных амплитуд может привести к непредсказуемым погрешностям. С другой стороны, распределение плотности заряда, как во всем кристалле, так и в его элементарной ячейке может быть описано уравнением Пуассона:
![]() (1.2.6)
(1.2.6)
где j- электростатический потенциал.
Представим электростатический потенциал j рядом Фурье вида (1.2.5)
![]() (1.2.7)
(1.2.7)
Подставляя (1.2.7) в уравнение (1.2.6) и сравнивая с (1.2.5), приходим к соотношению, выражающему ![]() через структурные амплитуды Fhkl:
через структурные амплитуды Fhkl:
![]() (1.2.8)
(1.2.8)
С учетом (1.2.8), ряд (1.2.7) принимает вид
![]() (1.2.9)
(1.2.9)
Полученный ряд (1.2.9) сходится существенно быстрее, чем ряд (1.2.5).
Представим ряд (1.2.9) в интегральной форме. Будем использовать функцию Эвальда
![]() (1.2.10)
(1.2.10)
Тогда выражение для потенциала j(x,y,z) =j(R) примет следующий вид:
![]() (1.2.11)
(1.2.11)
где F(Н)– функция, достаточно хорошо сглаживающая значения структурных амплитуд в точках Н = Hhkl. Правая часть равенства (1.2.11) представляет собой преобразование Фурье произведения двух функций F(H)/H2и Z(H). Применяя к выражению (1.2.11) теорему о свертке функций, получим
![]() , (1.2.12)
, (1.2.12)
где функции f(R) и g(R) находятся Фурье-преобразованием функций F(H)/H2и Z(H).
Чтобы использовать выражение (1.2.12) для расчетов φ(x,у,z),необходимо знать аналитический вид функции F(H), которая на практике определена только в дискретных точках, где она имеет значение Fhkl. Для нахождения F(H) воспользуемся методом аппроксимации. В качестве аппроксимирующей функции удобно взять следующее выражение:
![]() , (1.2.13)
, (1.2.13)
где zi – число электронов на i-ой оболочке в атоме;
![]() (1.2.14)
(1.2.14)
Для функции F(H), данной выражением (1.2.13), может быть найдена функция f(R), входящая в выражение для φ(х,у,z) согласно (1.2.12). Эта функция находится Фурье-преобразованием выражения F(Н)/Н2. В случае кубических решеток Фурье-преобразование может быть сведено к синус-преобразованию, тогда для f(R) получим следующее выражение:
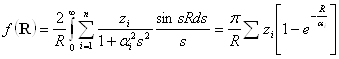 (1.2.15)
(1.2.15)
Функция g(R) является решеточной и находится Фурье-преобразованием Z(H). В зависимости от количества атомов в элементарной ячейке производится вычисление g(R), для лития она имеет вид:
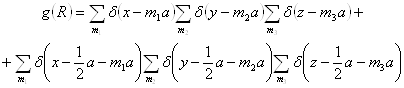 (1.2.16)
(1.2.16)
где а — постоянная решетки; m1, m2, m3 — целые числа, начиная с нуля; δ(x-m1a), δ(y-m2a), δ(z-m3a) — δ-функции.
Совершив необходимые вычисления в (1.2.12), получаем следующее выражение для функции распределения потенциала:
 , (1.2.17)
, (1.2.17)
Здесь через A1, А2 обозначены следующие выражения:
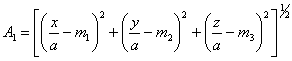 , (1.2.18)
, (1.2.18)
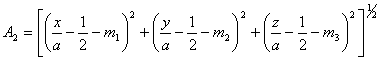
![]()
![]() Значение электростатического потенциала, созданного электронами, получается умножением φ(R) на заряд электрона -е. Потенциал ядер в произвольной точке ячейки V находится суммированием кулоновских потенциалов отдельных ядер. Выражение для потенциала ядер имеет следующий вид:
Значение электростатического потенциала, созданного электронами, получается умножением φ(R) на заряд электрона -е. Потенциал ядер в произвольной точке ячейки V находится суммированием кулоновских потенциалов отдельных ядер. Выражение для потенциала ядер имеет следующий вид:
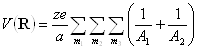 (1.2.19)
(1.2.19)
где A1, А2 даются выражениями (1.2.18). Полный потенциал решетки находится суммированием eφ(R) и V(R), т. е.
![]() (1.2.20)
(1.2.20)
Используя формулы (1.2.19), а также значения zi и найденные значения αi2, для потенциала кристаллической решетки получают следующее выражение:
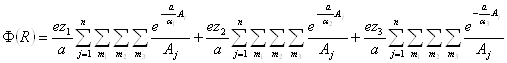 (1.2.21)
(1.2.21)
где Аj даются выражениями (1.2.18)
Аналогичные вычисления для электронной плотности дают следующее выражение:
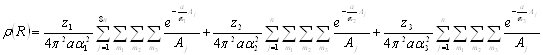 (1.2.22)
(1.2.22)
Глава 2. Неупругое рассеяние рентгеновских лучей веществом
2.1 Импульсная аппроксимация
Комптон-эффект исследовался многими учеными в практическом и теоретическом плане. КЭ занимались Дю-Монд, Купер, Вейс, Филипс. В их работах было рассмотрено рассеяние на не покоящихся электронах.
Рассеяние монохроматического излучения на покоящихся электронах должно приводить, очевидно, к δ-образному комптоновскому спектру. В дальнейшем, однако, было обнаружено, что спектральная линия КЭ шире, чем этого следовало ожидать из учета немонохроматичности и расходимости основного излучения, как показано на рисунке (2.1.1).
Джансей и более строго Дю-Монд объяснили это расхождение влиянием не учитываемого ранее начального распределения электронов по импульсам. (15)
Пусть ω1, k1 и ω2, k2 - соответственно частота и волновой вектор падающего и рассеянного излучений; тогда величины ω = ω1 - ω2 и k = k1 - k2 определяют энергию и импульс, передаваемые среде в единичном акте рассеяния. А законы сохранения в нерелятивистском приближении (ħν << mc2) выглядят следующим образом.
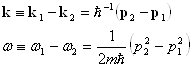 (2.1.1)
(2.1.1)
где р1 и р2 - импульсы электрона до и после рассеяния. Согласно (2.1.1)
![]() (2.1.2)
(2.1.2)
Энергетическое смещение комптоновской линии задается первым членом в (2.1.2), а второе слагаемое описывает доплеровское уширение линии, определяемое проекцией q импульса р1 па ось k. Так как k1 = ω1/c = 2π/λ1 и k = 2k1sin(![]() /2), то из (2.1.2) следует известное соотношение Комптона для положения центра линии КЭ на свободных не взаимодейс
/2), то из (2.1.2) следует известное соотношение Комптона для положения центра линии КЭ на свободных не взаимодейс
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Обзор современного состояния энергоресурсов человечества
Научно-технический прогресс невозможен без развития энергетики, электрификации. Для повышения производительности труда первостепенн
- Оценка эффективности инвестиционного проекта строительство парогазовой установки мощностью 410 МВт
В настоящее время проблема размещения капитала особенно актуальна. Инвестиции предшествуют созданию фирмы и определяют ее дальнейшую
- Світовий ринок енергоресурсів: стан, проблеми, перспективи
Міністерство освіти і науки УкраїниКиївський національний університет будівництва і архітектуриКафедра економічної теоріїКурсова ро
- Преобразование энергии в электрических машинах постоянного тока
КОНТРОЛЬНАЯ РАБОТА«ПРЕОБРАЗОВАНИЕ ЭНЕРГИИ В ЭЛЕКТРИЧЕСКИХ МАШИНАХ ПОСТОЯННОГО ТОКА»Задача 1.По следующим параметрам обмотки якоря м
- Привод ленточного конвеера
Курсовой проектпо дисциплине "Механика"Привод ленточного конвейераКинематическая схема привода(исходная).Исходные данные для кинемат
- Однофазный счетчик электрической энергии
- Параметры трансформатора и двигателя
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

