Происхождение и принципы эволюции: между равновесием и нелинейностью
Томский межвузовский центр дистанционного образования
Томский государственный университет систем управления и радиоэлектроники (ТУСУР)
Контрольная работа
по дисциплине «Концепция современного естествознания»
Выполнила
Афонина Юлия Владимировна
Г. Нефтеюганск
1. Как происходит обмен веществ и энергией в живой клетке? Чем он отличается от обменных процессов в неживой природе?
Обмен веществ (метаболизм) — это совокупность изменений и превращений вещества и энергии в организмах, обеспечивающих их рост, развитие, жизнедеятельность, самовоспроизведение и самосохранение. Процесс метаболизма — это непрерывно протекающие реакции потребления и усвоения поступающих веществ, превращения их в собственное тело организма (ассимиляции), а также противоположные реакции — разрушения некоторых веществ (диссимиляции). Ассимиляция может быть автотрофной (фотосинтез у зеленых растений) и гетеротрофной (пищеварение у животных). При химическом разложении молекул выделяется энергия, скрытая в форме химических связей в исходном соединении, и становится доступной для живой клетки. Примеры диссимиляции — дыхание, брожение. Пищеварение включает в себя процессы расщепления. Реакции между органическими соединениями идут очень медленно. В живой клетке выработались ускорители реакций — ферменты: биологические катализаторы, присутствующие во всех клетках и имеющие белковую природу. Их активность зависит от условий окружающей среды, определенной рН, и отсутствия ингибиторов. Они не изменяются и не расходуются в ходе реакций, как и катализаторы. Огромна их производительность — одна молекула фермента может за 1 мин разложить до 5 млн молекул субстрата — вещества, на которое действует фермент.
В центре этих превращений в клетке находится АТФ, которая синтезируется из АДФ и Н3Р04 за счет световой энергии или энергии, выделяемой при гликолизе, брожении или дыхании. При гликолизе АТФ выделяется энергия, необходимая для совершения всей работы живого организма — от создания градиентов концентрации ионов и сокращения мышц до синтеза белка. Углеродные остовы для синтеза метаболитов поставляет процесс распада липидов (рис. 1).
Обменные процессы в неживой природе характеризуются круговоротом веществ, цикличностью. В круговорот втянуты все геосферы, в них происходят процессы переноса веществ, меняющие их локальную концентрацию. С появлением жизни в обменные процессы, происходящие в неживой природе, стали втягиваться и процессы биосферы, которая представляет единство живого и минеральных элементов, вовлеченных в сферу жизни
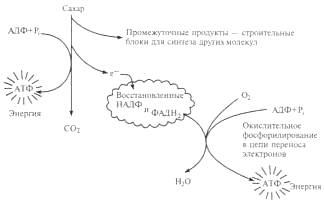
Рис. 1. Распад липидов, поставляющий углеродные скелеты для синтеза сахарозы и пр. (часть реакций происходит в глиоксисомах, а часть — в митохондриях и цитоплазме)
В обменных процессах, происходящих в неживой природе, нельзя выделить взаимосвязанных процессов ассимиляции и диссимиляции. Хотя все эти процессы происходят циклически во всех геосферах, они не направлены на цели роста, самосохранения, воспроизводства, адаптации и других характеристик, свойственных живым организмам. Согласно концепции Вернадского, «миграция химических элементов на земной поверхности и в биосфере, в целом осуществляется или при непосредственном участии живого вещества (биогенная миграция), или же она протекает в среде, геохимические особенности которой (кислород, углекислый газ, водород и др.) обусловлены живым веществом, как тем, которое в настоящее время населяет биосферу, так и тем, которое действовало на Землю в течение всей геологической истории».
Структурную основу метаболизма обеспечивает клеточный матрице, определяющий пространственное размещение молекулярных компонентов клетки, занятых в процессе жизнедеятельности. Среди клеточных органелл особую роль играют хлоропласты клеток зеленых растений и митохондрии любых организмов. В хлоропластах происходит связывание энергии солнечного света в процессе фотосинтеза. В митохондриях же извлекается энергия, заключенная в химических связях, поступающих в клетку питательных веществ.
2. Дайте представление о фазовых переходах, приведите примеры фазовых переходов разных типов. Поясните суть явлений сверхпроводимости и сверхтекучести
Фазы — это различные однородные части физико-химических систем. Вещество однородно, когда все параметры состояния вещества одинаковы во всех его элементарных объемах, размеры которых велики по сравнению с межатомными состояниями. Смеси различных газов всегда составляют одну фазу, если во всем объеме они находятся в одинаковых концентрациях. Одно и то же вещество в зависимости от внешних условий может быть в одном из трех агрегатных состояний — жидком, твердом или газообразном. Фазы — это устойчивые состояния определенного агрегатного состояния. Понятие фазы более широкое, чем понятие агрегатного состояния.
В зависимости от внешних условий система может находиться в равновесии либо в одной фазе, либо сразу в нескольких фазах. Их равновесное существование называется фазовым равновесием.
Испарение и конденсация — часто наблюдаемые фазовые переходы воды в окружающей природе. При переходе воды в пар происходит сначала испарение — переход поверхностного слоя жидкости в пар, при этом в пар переходят только самые быстрые молекулы: они должны преодолеть притяжение окружающих молекул, поэтому уменьшаются их средняя кинетическая энергия и соответственно температура жидкости. Наблюдается в быту и обратный процесс — конденсация. Оба эти процесса зависят от внешних условий. В некоторых случаях между ними устанавливается динамическое равновесие, когда число молекул, покидающих жидкость, становится равным числу молекул, возвращающихся в нее. Молекулы в жидкости связаны силами притяжения, которые удерживают их внутри жидкости. Если молекулы, имеющие скорости, которые превышают среднюю, находятся вблизи поверхности, они могут ее покинуть. Тогда средняя скорость оставшихся молекул понизится и температура жидкости уменьшится. Для испарения при постоянной температуре нужно сообщить жидкости некоторое количество теплоты: Q = rт, где r — удельная теплота парообразования, которая уменьшается с ростом температуры. При комнатной температуре для одной молекулы воды теплота парообразования составляет 10-20 Дж, тогда как средняя энергия теплового движения равна 6,06 • 10-21 Дж. Это значит, что в пар переходят молекулы с энергией, которая в 10 раз больше энергии теплового движения. При переходе через поверхность жидкости потенциальная энергия быстрой молекулы растет, а кинетическая уменьшается. Поэтому средние кинетические энергии молекул пара и жидкости при тепловом равновесии равны.
Исследования показали, что с поверхности Мирового океана, составляющего 94 % земной гидросферы, за сутки испаряется около 7 000 км3 воды и примерно столько же выпадает в виде осадков. Водяной пар, увлекаемый конвекционным движением воздуха, поднимается вверх и попадает в холодные слои тропосферы. По мере подъема пар становится все более насыщенным, затем конденсируется, образуя дождевые капли. В процессе конденсации пара в тропосфере за сутки выделяется около 1,6-1022 Дж теплоты, что в десятки тысяч раз превосходит вырабатываемую человечеством энергию за то же время.
Кипение — процесс перехода жидкости в пар в результате всплывания пузырьков, наполненных паром. Кипение происходит во всем объеме. Разрыв пузырьков у поверхности кипящей жидкости свидетельствует о том, что давление пара в них превышает давление над поверхностью жидкости. При температуре 100 °С давление насыщенных паров равно давлению воздуха над поверхностью жидкости (так была выбрана эта точка на шкале). На высоте 5 км давление воздуха вдвое меньше и вода закипает там при 82 °С, а на границе тропосферы (17 км) — приблизительно при 65 °С. Поэтому точка кипения жидкости соответствует той температуре, при которой давление ее насыщенных паров равно внешнему. Слабое поле тяготения Луны (ускорение свободного падения у ее поверхности равно всего 1,7 м/с2) не способно удержать атмосферу, а при отсутствии атмосферного давления жидкость мгновенно выкипает, поэтому лунные «моря» безводны и образованы застывшей лавой. По той же причине безводны и марсианские «каналы».
Вещество может находиться в равновесии и в разных фазах. Так, при сжижении газа в состоянии равновесия фаз объем может быть каким угодно, а температура перехода связана с давлением насыщенного пара. Кривая равновесия фаз может быть получена при проекции на плоскость (р, Т) области перехода в жидкое состояние. Аналитически кривая равновесия двух фаз определяется из решения дифференциального уравнения Клаузиуса—Клапейрона. Аналогично можно получить кривые плавления и возгонки, которые соединяются в одной точке плоскости (р, Г), в тройной точке (см. рис. 7.1), где в определенных пропорциях находятся в равновесии все три фазы. Тройной точке воды соответствует давление 569,24 Па и температура -0,0075 °С; углекислоты — 5,18 • 105 Па и 56,6 °С соответственно. Поэтому при атмосферном давлении р, равном 101,3 кПа, углекислота может быть в твердом или газообразном состоянии. При критической температуре физические свойства жидкости и пара становятся одинаковыми. При температурах выше критической вещество может быть только в газообразном состоянии. Для воды — Т= 374,2 °С, р = 22,12 МПа; для хлора — 144 °С и 7,71 МПа соответственно.
Фазовые переходы бывают нескольких родов. Во время фазового перехода температура не меняется, но меняется объем системы.
Фазовыми переходами первого рода называют изменения агрегатных состояний вещества, если: температура постоянна во время всего перехода; меняется объем системы; меняется энтропия системы. Чтобы произошел такой фазовый переход, нужно данной массе вещества сообщить определенное количество теплоты, соответствующее скрытой теплоте превращения.
В самом деле, при переходе из более конденсированной фазы в фазу с меньшей плотностью нужно сообщить некоторое количество энергии в форме теплоты, которое пойдет на разрушение кристаллической решетки (при плавлении) или на удаление молекул жидкости друг от друга (при парообразовании). Во время преобразования скрытая теплота расходуется на преодоление сил сцепления, интенсивность теплового движения не изменяется, в результате температура остается постоянной. При таком переходе степень беспорядка, а следовательно, и энтропия возрастают. Если процесс идет в обратном направлении, то скрытая теплота выделяется.
Фазовые переходы второго рода связаны с изменением симметрии системы: выше точки перехода система, как правило, обладает более высокой симметрией, как показал в 1937 г. Л.Д. Ландау. Например, в магнетике спиновые моменты выше точки перехода ориентированы хаотически, и одновременное вращение всех спинов вокруг одной оси на одинаковый угол не изменяет свойств системы. Ниже точки перехода спины имеют некоторую преимущественную ориентацию, и одновременный их поворот меняет направление магнитного момента системы. Ландау ввел коэффициент упорядочения и разложил термодинамический потенциал в точке перехода по степеням этого коэффициента, на основе чего построил классификацию всех возможных типов переходов, а также теорию явлений сверхтекучести и сверхпроводимости. На этой основе Ландау и Лифшиц рассмотрели много важных задач — переход сегнетоэлектрика в параэлектрик, ферромагнетика — в парамагнетик, поглощение звука в точке перехода, переход металлов и сплавов в сверхпроводящее состояние и др.
Фазовые переходы второго, третьего и т.д. родов связаны с порядком тех производных термодинамического потенциала Ф, которые испытывают конечные изменения в точке перехода. Такая классификация фазовых превращений связана с работами физика-теоретика П. Эренфеста. В случае фазового перехода второго рода в точке перехода испытывают скачки производные второго порядка: теплоемкость при постоянном давлении Ср = ![]() , сжимаемость
, сжимаемость ![]() , коэффициент теплового расширения
, коэффициент теплового расширения![]() , тогда как первые производные остаются непрерывными. Это означает отсутствие выделения (поглощения) теплоты и изменения удельного объема.
, тогда как первые производные остаются непрерывными. Это означает отсутствие выделения (поглощения) теплоты и изменения удельного объема.
Сверхтекучесть и сверхпроводимость.
Стремление к беспорядку приводит к увеличению, (в среднем) расстояния между частицами, часть кинетической энергии частиц переходит в потенциальную, и по мере уменьшения средней кинетической энергии уменьшается и температура газа. Эффект Джоуля—Томсона используют для понижения температуры на порядок по сравнению с нормальной. При каждом процессе охлаждения температура падает незначительно, но система работает циклами, и в конце процесса сжиженный газ капает из сопла в колбу. Дьюар изобрел сосуд для хранения сжиженных газов, который сейчас широко распространен (сосуд Дьюара).
Системы с последовательным сжатием и расширением газа широко используют для сжижения газа. Гелий превращается в жидкость при Т = 4,2 К. Впервые жидкий гелий получил нидерландский физик X. Камерлинг-Оннес в Лейдене путем охлаждения гелия ниже точки его инверсии с помощью жидкого водорода, кипящего под пониженным давлением (1908). Так он достиг температуры 1 К.
Из теоремы Нернста, называемой третьим началом термодинамики, следует, что при приближении температуры к нулю теплоемкости тоже стремятся к нулю, т. е. начинают зависеть от температуры (Т). По классической теории этого быть не должно. Значит, в рамках классической физики теорема Нернста не может быть объяснена. Кроме того, из уравнения Клапейрона следует, что коэффициент теплового расширения и термический коэффициент давления не должны зависеть от температуры, а из теоремы Нернста получается, что они тоже обращаются в нуль при Т= 0. Это значит, что при низких температурах перестает выполняться и уравнение Клапейрона—Менделеева.
Поскольку![]() и по третьему началу термодинамики при Т= 0 левые части обращаются в нуль, то в нуль должны обратиться и правые части, т.е. при Т= 0 давление газа не зависит от температуры, а определяется только плотностью, газ находится в состоянии вырождения. Пример такого газа — газ свободных электронов в металлах при обычных температурах.
и по третьему началу термодинамики при Т= 0 левые части обращаются в нуль, то в нуль должны обратиться и правые части, т.е. при Т= 0 давление газа не зависит от температуры, а определяется только плотностью, газ находится в состоянии вырождения. Пример такого газа — газ свободных электронов в металлах при обычных температурах.
К вырожденным газам не применима статистика Больцмана, поэтому разработана квантовая статистика Бозе—Эйнштейна (для бозонов). Из приведенных соотношений получается, что и внутренняя энергия перестает зависеть от температуры, определяясь только плотностью. Поэтому и газ свободных электронов в металлах не вносит заметного вклада в теплоемкость.
Охлаждение от 30 до 3 К совершается при использовании гелия. Сначала гелий охлаждают путем контакта его с жидким азотом или воздухом, затем — при адиабатическом расширении, когда его заставляют совершить работу. После этого охлажденный гелий многократно пропускают через установку Джоуля—Томсона, и через несколько циклов начинает капать уже жидкий гелий с точкой кипения 4,2 К. Температура 3 К имеет более общее значение, поскольку такой температурой обладает окружающее нас космическое пространство. Это слабое излучение, обнаруженное американскими учеными (радио- и астрофизиком А. Пензиасом и радиоастрономом Р. Вильсоном), является также космическим микроволновым фоновым излучением. В нем присутствует целый набор длин волн, но максимум интенсивности лежит около длины 3 см. Оно обладает всеми свойствами излучения, которыми бы обладало тело, нагретое до температуры 2,7 К. Считается, что это излучение было порождено в результате Большого Взрыва, и потому И. С. Шкловский предложил его назвать реликтовым. По теории Большого Взрыва, предложенной Г. Гаммовым, в ранней Вселенной излучение и вещество находились в очень тесном тепловом контакте, и только через 700 тыс. лет после Большого Взрыва произошло их разделение, при этом температура Вселенной понизилась на 3000 К. Вселенная и далее продолжала расширяться, соответственно увеличивались и длины волн излучения, поэтому большая часть излучения сейчас имеет длину волны порядка 3 см. Вещество, лишившись контакта с излучением, остывало медленней.
Если добиться испарения жидкого гелия, можно достичь температур порядка 1 К. Для получения более низких температур используют магнитные свойства веществ, обусловленные наличием спина электрона. Движущиеся электроны, так как каждый электрически заряжен, порождают магнитные поля, а наличие спина приводит к возникновению магнитного поля, и каждый электрон подобен маленькому полосовому магниту. Но в отличие от него электрон во внешнем магнитном поле может иметь только две ориентации («вверх» и «вниз») как объект квантовой природы. У большинства веществ спины электронов скомпенсированы и не создают магнитного поля, у парамагнитных — они не скомпенсированы, но без магнитного поля имеют одинаковое число спинов, ориентированных «вверх» и «вниз». Различным ориентациям полосового магнита во внешнем поле сопоставляют определенное значение энергии, то же — и для двояко ориентированных спинов. Пусть в присутствии поля ориентации «вверх» соответствует большая энергия. Если с увеличением магнитного поля отношение чисел электронов со спинами «вверх» и «вниз» осталось неизменным, значит, система обладает бесконечно высокой температурой. Итак, если два состояния отличаются по энергиям и одинаково «заселены», можно сказать, что система обладает бесконечной температурой.
Зафиксировав этот общий вывод, приложим внешнее магнитное поле к парамагнитному образцу, находящемуся в контакте с термостатом. Возникает отличие между по-разному ориентированными спинами, так как система была «бесконечно нагрета» и «перевороту» спинов вниз будет соответствовать переход части энергии в термостат. В результате число спинов, ориентированных «вниз», возрастет, они не будут скомпенсированы, система приобретет магнитный момент. Этот процесс, соответствующий стремлению к рассеянию энергии, называют изотермическим намагничиванием. Если теперь нарушить тепловой контакт с окружающей средой и повести процесс на следующем этапе адиабатически, потери энергии уже не будет. Приступим к адиабатическому размагничиванию образца. В отсутствие внешнего магнитного поля спины электронов практически с равными вероятностями могут быть ориентированы как по полю («вниз»), так и против него («вверх»). Энтропия системы спинов растет, хотя у образца в целом она не меняется, т.е. у системы атомов, находящихся в тепловом движении, энтропия понизилась, тепловое движение стало более упорядоченным, снизилась интенсивность теплового движения атомов (Т). Внешний наблюдатель отметил понижение температуры, а система электронных спинов выступила «холодильником», откачав под действием магнитного поля энергию от атомов в окружающее пространство.
Явление сверхтекучести наблюдали и раньше, отмечая странное поведение гелия при температурах около 2 К, но только П.Л. Капица подробно исследовал и описал его. Эту «странность» в поведении гелия объяснил Л.Д. Ландау (1941) — необычность гелия в том, что жидкий гелий существует в двух формах. В области температур от 4,2 до 2,18 К (так называемая ![]() -точка) он ведет себя как классическая жидкость — это гелий-I. Ниже
-точка) он ведет себя как классическая жидкость — это гелий-I. Ниже![]() -точки он состоит как бы из двух жидкостей: одна ведет себя как обычная (гелий-I), другая проявляет свойства сверхтекучести — проводит теплоту без потерь, т.е. ее теплопроводность равна бесконечности, не оказывает сопротивления течению, или имеет нулевую вязкость, — это гелий-П. В
-точки он состоит как бы из двух жидкостей: одна ведет себя как обычная (гелий-I), другая проявляет свойства сверхтекучести — проводит теплоту без потерь, т.е. ее теплопроводность равна бесконечности, не оказывает сопротивления течению, или имеет нулевую вязкость, — это гелий-П. В ![]() -точке происходит фазовый переход между двумя состояниями гелия. Относительное количество каждой из компонент гелия можно определить измерением силы, действующей на предмет, движущийся в жидкости. Оно зависит от температуры, и опыты показали, что при температурах ниже 1 К практически весь гелий находится в сверхтекучем состоянии.
-точке происходит фазовый переход между двумя состояниями гелия. Относительное количество каждой из компонент гелия можно определить измерением силы, действующей на предмет, движущийся в жидкости. Оно зависит от температуры, и опыты показали, что при температурах ниже 1 К практически весь гелий находится в сверхтекучем состоянии.
Итак, атомы сверхтекучего гелия ведут себя согласованно, как единое целое, беспорядка в этой системе нет, энтропия равна нулю. Невозможно сообщить какой-то части сверхтекучего гелия теплоту — все его атомы одинаково подвержены воздействию. Невозможен и обмен энергией между атомами — все они в самом низком состоянии, и вязкость среды равна нулю.
Явление сверхпроводимости было открыто при исследованиях в области низких температур, первоначально имевших чисто практическую направленность и приведших к многим крупным открытиям. В 1911 г. Камерлинг-Оннес обнаружил, что при температуре 7,2 К сопротивление свинцового проводника внезапно снизилось в миллионы раз и практически исчезло. Затем он открыл удивительный макроэффект скачкообразного исчезновения электрического сопротивления ртути, охлажденной до температуры 4,15 К.
Это странное явление и получило название сверхпроводимости. В одном из экспериментов в сделанном из чистого свинца кольце был наведен ток в несколько сотен ампер. Через год оказалось, что ток все еще продолжает идти в кольце, и величина его не изменилась, т. е. сопротивление свинца было равно нулю! Этот макроэффект возникновения сверхпроводимости долгое время оставался не объясненным, но постепенно расширялся круг веществ, способных к нему при низких температурах. Среди них — свинец, ниобий, ванадий, алюминий, олово, титан, молибден и ряд других металлов. Сейчас известны многие элементы и сплавы, которые при низких температурах обладают сверхпроводящими свойствами. Электротехников такое открытие сначала окрылило, но надежды на создание электрических машин без сопротивления оказались преждевременными. Проблема была не только в сложности охлаждения до столь низких температур, но и в возникновении вокруг проводника с большим током сильного магнитного поля, стремящегося нарушить сверхпроводимость. Подбирали специальные сплавы, на которые бы магнитное поле не влияло. Более того, в 30-е гг. немецкие физики В.Мейснер и Р.Оксенфельд нашли, что вещество, приобретающее свойства сверхпроводимости, способно вытеснять образующееся в нем магнитное поле. Но и вытесненное магнитное поле остается помехой сверхпроводимости. Выяснилось, что состояния сверхпроводимости и магнитной проницаемости являются взаимно исключающими. Эффект Мейснера был использован в 1945 г. в знаменитом опыте Аркадьева — над чашей, изготовленной из сверхпроводящего вещества и охлажденной до температуры ниже критической, парил магнит. Он поддерживался в таком необычном состоянии, так как вытесненное магнитное поле из сверхпроводника уравновешивало вес обычного магнита.
3. Опишите модель реального газа. К каким состояниям газа она применяется? Какая температура и плотность называется критической? Каковы особенности сжижения газов в естественных и искусственных условиях?
Модель реального газа, предложенная Ван-дер-Ваальсом (1873), отличалась от модели идеального газа учетом объема самих молекул и их взаимодействия. Последний фактор несколько уменьшает давление — каждая молекула при столкновении как бы тормозится притяжением соседних. Так появилось новое уравнение состояния, которое получило имя автора.
При низких абсолютных температурах газы уже не похожи на газы, их свойства определяются квантовыми законами. В этих условиях используют квантовые функции распределения, которые переходят в классические с повышением температуры. Области, в которых наступают отклонения от закона распределения, называют областями вырождения газа (для водорода, например, эта область находится при Т = 1 К, для других газов — еще ниже).
Получение сжиженных газов, необходимых в промышленности, требовало разработки методов получения низких температур. Многое в этом направлении сделано академиком П.Л. Капицей (1938), которому открытие сверхтекучести жидкого гелия принесло мировую славу. Через несколько лет Ландау построил теорию сверхтекучести жидкого гелия. В предвоенные годы проблема сверхтекучести была одной из центральных проблем теоретической физики.
Установление понятия критической точки оказалось решающим в разработке методики и техники сжижения газов. В 1877 г. в Париже, в химической лаборатории Нормальной школы, Л. Кальете провел опыт по сжижению кислорода: предварительно кислород был охлажден и сжат до 303,9 • 105 Па, затем резко расширен, в результате его температура упала до 90 К, и в этот момент в стеклянном приемнике возник туман — мельчайшие капельки жидкого кислорода. Вскоре Кальете тем же способом превратил в жидкость азот и водород. В Женеве в том же году Р. П. Пикте получил уже несколько кубических сантиметров жидкого кислорода и водорода. В еще больших количествах их удалось получить польским физикам 3. Врублевскому и К. Ольшевскому, когда они понизили температуру еще на 20 К путем испарения жидкого воздуха в пустоту (1885). Используя эффект Джоуля—Томсона, отличающийся от охлаждения при адиабатическом расширении тем, что газ охлаждается без совершения работы, за счет сил взаимного притяжения, английский физико-химик Дж. Дьюар сумел получить уже несколько литров жидкого водорода (1893).
Стремление к беспорядку приводит к увеличению (в среднем) расстояния между частицами, часть кинетической энергии частиц переходит в потенциальную, и по мере уменьшения средней кинетической энергии уменьшается и температура газа. Эффект Джоуля—Томсона используют для понижения температуры на порядок по сравнению с нормальной. При каждом процессе охлаждения температура падает незначительно, но система работает циклами, и в конце процесса сжиженный газ капает из сопла в колбу. Дьюар изобрел сосуд для хранения сжиженных газов, который сейчас широко распространен (сосуд Дьюара).
Системы с последовательным сжатием и расширением газа широко используют для сжижения газа. Гелий превращается в жидкость при Т = 4,2 К. Впервые жидкий гелий получил нидерландский физик X. Камерлинг-Оннес в Лейдене путем охлаждения гелия ниже точки его инверсии с помощью жидкого водорода, кипящего под пониженным давлением (1908). Так он достиг температуры 1 К.
Из теоремы Нернста, называемой третьим началом термодинамики, следует, что при приближении температуры к нулю теплоемкости тоже стремятся к нулю, т. е. начинают зависеть от температуры (Т). По классической теории этого быть не должно. Значит, в рамках классической физики теорема Нернста не может быть объяснена. Кроме того, из уравнения Клапейрона следует, что коэффициент теплового расширения и термический коэффициент давления не должны зависеть от температуры, а из теоремы Нернста получается, что они тоже обращаются в нуль при Т= 0. Это значит, что при низких температурах перестает выполняться и уравнение Клапейрона—Менделеева.
Поскольку![]() и по третьему началу термодинамики при Т= 0 левые части обращаются в нуль, то в нуль должны обратиться и правые части, т.е. при Т= 0 давление газа не зависит от температуры, а определяется только плотностью, газ находится в состоянии вырождения. Пример такого газа — газ свободных электронов в металлах при обычных температурах.
и по третьему началу термодинамики при Т= 0 левые части обращаются в нуль, то в нуль должны обратиться и правые части, т.е. при Т= 0 давление газа не зависит от температуры, а определяется только плотностью, газ находится в состоянии вырождения. Пример такого газа — газ свободных электронов в металлах при обычных температурах.
К вырожденным газам не применима статистика Больцмана, поэтому разработана квантовая статистика Бозе—Эйнштейна (для бозонов). Из приведенных соотношений получается, что и внутренняя энергия перестает зависеть от температуры, определяясь только плотностью. Поэтому и газ свободных электронов в металлах не вносит заметного вклада в теплоемкость.
4. Поясните суть гипотезы Луи де Бройля. Как она была экспериментально подтверждена, какое значение для естествознания имеет использование корпускулярно-волновых свойств вещества? Что узнали о живой материи с помощью электронного микроскопа и на каких принципах он работает?
Это было увлекательное время для физиков, когда загадки возникали буквально на каждом шагу. В XIX в. классическая физика достигла столь больших успехов, что некоторые ученые начали сомневаться, остались ли нерешенными хотя бы какие-то принципиальные научные проблемы. И лишь в самые последние годы столетия были сделаны такие поразительные открытия, как рентгеновское излучение, радиоактивность и электрон. В 1900 г. Макс Планк предложил свою революционную квантовую теорию для объяснения соотношения между температурой тела и испускаемым им излучением. Вопреки освященному веками представлению о том, что свет распространяется непрерывными волнами, Планк высказал предположение о том, что электромагнитное излучение (всего лишь за несколько десятилетий до этого было доказано, что свет представляет собой электромагнитное излучение) состоит из неделимых порций, энергия которых пропорциональна частоте излучения. Новая теория позволила Планку разрешить проблему, над которой он работал, но она оказалась слишком непривычной, чтобы стать общепринятой. В 1905 г. Альберт Эйнштейн показал, что теория Планка - не математический трюк. Используя квантовую теорию, он предложил замечательное объяснение фотоэлектрического эффекта (испускание электронов поверхностью металла под действием падающего на нее излучения). Было известно, что с увеличением интенсивности излучения число испущенных с поверхности электронов возрастает, но их скорость никогда не превосходит некоторого максимума. Согласно предложенному Эйнштейном объяснению, каждый квант передает свою энергию одному электрону, вырывая его с поверхности металла: чем интенсивнее излучение, тем больше фотонов, которые высвобождают больше электронов; энергия же каждого фотона определяется его частотой и задает предел скорости вылета электрона. Заслуга Эйнштейна не только в том, что он расширил область применения квантовой теории, но и в подтверждении им ее справедливости. Свет, несомненно обладающий волновыми свойствами, в ряде явлений проявляет себя как поток частиц.
Новое подтверждение квантовой теории последовало в 1913 г., когда Нильс Бор предложил модель атома, которая соединила концепцию Эрнста Резерфорда о плотном центральном ядре, вокруг которого обращаются электроны, с определенными ограничениями на электронные орбиты. Эти ограничения позволили Бору объяснить линейчатые спектры атомов, которые можно наблюдать, если свет, испущенный веществом, находящимся в возбужденном состоянии при горении или электрическом разряде, пропустить через узкую щель, а затем через спектроскоп - оптический прибор, пространственно разделяющий компоненты сигнала, соответствующие различным частотам или длинам волн (различным цветам). В результате возникает серия линий (изображений щели), или спектр. Положение каждой спектральной линии зависит от частоты определенной компоненты. Спектр целиком определяется излучением атомов или молекул светящегося вещества. Бор объяснял возникновение спектральных линий "перескоком" электронов в атомах с одной "разрешенной" орбиты на другую, с более низкой энергией. Разность энергий между орбитами, теряемая электроном при переходе, испускается в виде кванта, или фотона - излучения с частотой, пропорциональной разности энергий. Спектр представляет собой своего рода кодированную запись энергетических состояний электронов. Модель Бора, таким образом, подкрепила и концепцию дуальной природы света как волны и потока частиц.
Несмотря на большое число экспериментальных подтверждений, мысль о двойственном характере электромагнитного излучения у многих физиков продолжала вызывать сомнения. К тому же в новой теории обнаружились уязвимые места. Например, модель Бора "разрешенные" электронные орбиты ставила в соответствии наблюдаемым спектральным линиям. Орбиты не следовали из теории, а подгонялись, исходя из экспериментальных данных.
Де Бройль первым понял, что если волны могут вести себя как частицы, то и частицы могут вести себя как волны. Он применил теорию Эйнштейна - Бора о дуализме волна-частица к материальным объектам. Волна и материя считались совершенно различными. Материя обладает массой покоя. Она может покоиться или двигаться с какой-либо скоростью. Свет же не имеет массы покоя: он либо движется с определенной скоростью (которая может изменяться в зависимости от среды), либо не существует. По аналогии с соотношением между длиной волны света и энергией фотона де Бройль высказал гипотезу о существовании соотношения между длиной волны и импульсом частицы (массы, умноженной на скорость частицы). Импульс непосредственно связан с кинетической энергией. Таким образом, быстрый электрон соответствует волне с более высокой частотой (более короткой длиной волны), чем медленный электрон. В каком обличье (волны или частицы) проявляет себя материальный объект зависит от условий наблюдения.
С необычайной смелостью де Бройль применил свою идею к модели атома Бора. Отрицательный электрон притягивается к положительно заряженному ядру. Для того чтобы обращаться вокруг ядра на определенном расстоянии, электрон должен двигаться с определенной скоростью. Если скорость электрона изменяется, то изменяется и положение орбиты. В таком случае центробежная сила уравновешивается центростремительной. Скорость электрона на определенной орбите, находящейся на определенном расстоянии от ядра, соответствует определенному импульсу (скорости, умноженной на массу электрона) и, следовательно, по гипотезе де Бройля, определенной длине волны электрона. По утверждению де Бройля, "разрешенные" орбиты отличаются тем, что на них укладывается целое число длин волн электрона. Только на таких орбитах волны электронов находятся в фазе (в определенной точке частотного цикла) с самими собой и не разрушаются собственной интерференцией.
В 1924 г. де Бройль представил свою работу "Исследования по квантовой теории" ("Researches on the Quantum Theory") в качестве докторской диссертации факультету естественных наук Парижского университета. Его оппоненты и члены ученого совета были поражены, но настроены весьма скептически. Они рассматривали идеи де Бройля как теоретические измышления, лишенные экспериментальной основы. Однако по настоянию Эйнштейна докторская степень ему все же была присуждена. В следующем году де Бройля опубликовал свою работу в виде обширной статьи, которая была встречена с почтительным вниманием. С 1926 г. он стал лектором по физике Парижского университета, а через два года был назначен профессором теоретической физики Института Анри Пуанкаре при том же университете.
На Эйнштейна работа де Бройля произвела большое впечатление, и он советовал многим физикам тщательно изучить ее. Эрвин Шредингер последовал совету Эйнштейна и положил идеи де Бройля в основу волновой механики, обобщившей квантовую теорию. В 1927 г. волновое поведение материи получило экспериментальное подтверждение в исследованиях Клинтона Дж. Дэвиссона и Лестера Х. Джермера, работавших с низкоэнергетическими электронами в Соединенных Штатах, и Джорджа П. Томсона, использовавшего электроны большой энергии в Англии. Открытие связанных с электронами волн, которые можно отклонять в нужную сторону и фокусировать, привело в 1933 г. к созданию Эрнстом Руской электронного микроскопа. Волны, связанные с материальными частицами, теперь принято называть волнами де Бройля.
В 1929 г. "за открытие волновой природы электронов" де Бройль был удостоен Нобелевской премии по физике.
Де Бройль продолжил свои исследования природы электронов и фотонов. Вместе с Эйнштейном и Шредингером он в течение многих лет пытался найти такую формулировку квантовой механики, которая подчинялась бы обычным причинно-следственным законам. Однако усилия этих выдающихся ученых не увенчались успехом, а экспериментально было доказано, что такие теории неверны. В квантовой механике возобладала статистическая интерпретация, основанная на работах Нильса Бора, Макса Борна и Вернера Гейзенберга. Эту концепцию часто называют копенгагенской интерпретацией в честь Бора, который разрабатывал ее в Копенгагене.
В 1933 г. де Бройль был избран членом Французской академии наук, а в 1942 г. стал ее постоя
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Межклеточные контакты
Межклеточные контакты возникают в местах соприкосновения клеток в тканях и служат для межклеточного транспорта веществ и передачи си
- Кефалевые Азово-Черноморского бассейна
СодержаниеВступление1. Азовское и Чёрное моря как среда обитания кефалевых рыб1.1 Исторический аспект изучаемого вопроса1.2 Физико-геог
- Тип членистоногі: загальна характеристика
Курсова роботаНа тему: Тип членистоногі: загальна характеристикаВиконав Анохін Богдан2010План1.Клас ракоподібні2.Клас Павукоподібні3.Кл
- Женщины и мужчины - различия между полами
СодержаниеПрирода человека. Мужчина и женщина: 109 различийКристаллы тестостерона в поляризованном светеПоловые хромосомы человека: вн
- Биология ондатры Зейского района Амурской области
Большая численность и привязанность к определённому участку обитания ондатры создают благоприятные условия для изучения этого интер
- Биология перепела Благовещенского района
СОДЕРЖАНИЕ1. Ведение2. Физико-географическая характеристика Благовещенского района3. Биология немого перепела3.1 Систематика3.2 Ареал3.3 В
- Биология песца
1. Описание внешнего вида2. Распространение и участок обитания песца3. Сезонная миграция4. Социальная структура и размножение песца5. Обра
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

