Перспективы применения липосомальных форм
Перспективы развития фармацевтической технологии определяются требованиями современной фармакотерапии, которые предполагают создание максимально эффективных с лечебной точки зрения лекарственных препаратов при содержании в них минимума лекарственных субстанций, не обладающих побочными действиями. В основе решения этой задачи лежат положения и принципы биофармации, базирующиеся на оптимальном подборе состава и вида лекарственной формы и использовании оптимальных технологических процессов. Этим объясняется широкое распространение и углубление биофармацевтических исследований во многих странах.
Однако изучение биофармацевтических аспектов получения и назначения лекарственных препаратов, изучение "судьбы" лекарственных средств в организме — это лишь первый этап решения сформулированной выше задачи. Дальнейшие усилия должны быть направлены на реализацию полученных сведений в процессе производства и применения лекарственных препаратов с целью ликвидации таких их недостатков, как короткий срок действия; неравномерное поступление лекарственных веществ в патологический очаг; отсутствие избирательного действия; недостаточная стабильность и др.
Лишь те лекарства могут считаться рациональными, которые обеспечивают оптимальную биологическую доступность действующих веществ
К первоочередным задачам фармацевтической технологии следует отнести повышение растворимости труднорастворимых лекарственных веществ в воде и липидах; увеличение стабильности гомогенных и гетерогенных лекарственных систем; продление времени действия лекарственных препаратов; создание лекарств направленного действия с заданными фармакологическими свойствами.
Совершенствование регулируемости и направленности действия биологически активных веществ является основным направлением в развитии фармацевтической технологии. Разработанные лекарственные системы с регулируемым высвобождением действующих веществ позволяют быстро достичь лечебного эффекта, длительно удерживать постоянный уровень их терапевтической концентрации в плазме крови. Как показала практика, использование таких лекарственных систем дает возможность уменьшить курсовую дозу, устранить раздражающее действие и передозировку лекарственных веществ, уменьшить частоту проявлений побочных эффектов
Начиная с бронзового века, когда впервые был получен сплав меди и олова, люди используют сочетания различных материалов, чтобы усилить лучшие свойства каждого из них. Последним примером такого удачного сочетания является разработка учеными Национального института стандартов и технологий (National Institute of Standards and Technology – NIST), Университета Мэриленда (University of Maryland) и Управления контроля качества продуктов и лекарств США (U.S. Food and Drug Administration – FDA) метода сочетания свойств двух материалов, каждый из которых вызывает огромный интерес специалистов в области биомедицины: фосфолипидных пузырьков, называемых липосомами, и частиц гидрогеля – заполненных молекулами воды сетей полимерных цепочек. Их сочетание приводит к образованию гибридной наноразмерной частицы, которая, вполне вероятно, сможет достигать определенных, например опухолевых, клеток, легко проходить через их мембраны, а затем медленно выделять лекарственные вещества.
В недавней статье в журнале Langmuir ученые рассмотрели преимущества и недостатки липосом и наночастиц гидрогеля как средств адресной доставки лекарственных препаратов. Хотя липосомы обладают полезными поверхностными свойствами, что позволяет им ориентироваться на определенные клетки и проходить через их мембраны, они могут разрываться при изменении условий окружающей их микросреды. Наночастицы гидрогеля более стабильны и обладают свойствами контролируемого выделения лекарственных препаратов, что дает возможность осуществлять тонкую настройку дозировки лекарств с учетом времени, но подвержены разложению и собираются в конгломераты. Целью ученых являлось создание наночастиц, сочетающих оба компонента, что позволило бы использовать сильные стороны каждого из материалов, одновременно минимизировав слабые
Целью нашей работы явилось изучение литературных источников, описывающих современные поколения лекарств,в частности липосомальные препараты и современные способы ихих получения , изучение транспортных свойств липосом.
Глава 1. История открытия липосом
Липосомы – это микроскопические заполненные жидкостью сферические частицы, мембрана (оболочка) которых состоит из молекул тех же природных фосфолипидов, что и клеточные мембраны. Водорастворимые (гидрофильные) лекарственные вещества могут быть заключены во внутреннее водное пространство липосом, а жирорастворимые (гидрофобные) – в бислойную липидную мембрану. В последнее время липосомы находят все большее признание в мире как перспективные носители лекарственных веществ, поскольку согласно результатам многочисленных клинических испытаний лекарства, вводимые в составе липосом, более эффективны и менее токсичны, чем применяемые в свободном виде. Впервые на них обратил внимание английский исследователь Алек Бэнгхем (Bangham A.D.) с коллегами в 1965 году. Они заметили, что липосомы (это название утвердилось года три спустя) весьма напоминают мембраны клеток. В те годы уже было известно, что клеточные мембраны выполняют много функций, и липосомы сразу же стали важным инструментом для их изучения. В середине 60-х годов английский ученый Алек Бэнгхем, выясняя роль фосфолипидов в свертывании крови, изучал структуру дисперсий, образующихся при набухании фосфолипидов в избытке воды. На электронных микрофотографиях он увидел слоистые частицы, удивительно похожие на мембранные структуры клетки. Следующее исследование показало, что элементы, присутствующие в растворе в момент набухания фосфолипидов, включаются внутрь этих частиц и удерживаются там длительное время, обмениваясь с наружным раствором с очень малой скоростью. Так впервые было установлено, что фосфолипиды, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего проникновению растворенных в ней веществ.
Как модели мембран, липосомы позволили исследовать ряд их свойств: электрическое сопротивление, проницаемость для молекул воды, для ионов и других заряженных частиц, а также для содержимого клеток. Липосомы используются, кроме того, для изучения действия на мембраны витаминов, гормонов, антибиотиков и других препаратов. Эта сторона дела привлекла наибольшее внимание исследователей, поскольку выяснилось, что липосомы хорошо справляются с ролью носителей лекарств.
Известно, что заболевания поражают не весь организм, а развиваются в отдельных органах и тканях. Так, например, при раке главные события происходят в месте расположения опухоли, при инфаркте миокарда – в мышце сердца, при дизентерии – в кишечнике. Поэтому и лечение пойдет быстрее и успешнее, если лекарства будут действовать непосредственно в очаге заболевания. Особенно это важно в тех случаях, когда приходится иметь дело с весьма ядовитыми препаратами, которые хорошо лечат саму болезнь, но при этом плохо влияют на другие системы организма. Часто это свойство некоторых лекарств заставляет отказываться от использования их и применять менее эффективные.
Однако создать нужную концентрацию лекарственных веществ в пораженных болезнью местах, не затрагивая остальные, – задача непростая. Ведь медикаменты, каким бы способом их ни вводили, расходятся по всему организму более или менее равномерно. А чтобы они попали в нужные места, сделали вывод медики, необходим какой-то носитель, который бы мог их туда доставить. За последнии несколько лет было предпринято много попыток для решения этой проблемы, перепробовано множество соединений, и оказалось, что лучшими носителями лекарств являются липосомы.
Свойства липосом и их поведение определяются прежде всего наличием у них замкнутой мембранной оболочки. Несмотря на молекулярную толщину (около 4 нм), липидный бислой (бимолекулярный липидный слой) отличается исключительной механической прочностью и гибкостью. Благодаря этому липосомы сохраняют целостность при различных повреждающих воздействиях, а их мембрана обладает способностью к самозалечиванию возникающих в ней структурных дефектов. Вместе с тем гибкость бислоя и его текучесть придают липосомам высокую пластичность.
Глава 2. Применение липосом в медицине
2.1 Свойства липосомальных частиц
Какие же качества липосом дают им преимущества перед другими носителями лекарств? Прежде всего, это сродство с природными мембранами клеток по химическому составу. Известно, что липиды, входящие в состав мембран, занимают от 20 до 80 процентов их массы. Поэтому при правильном подборе компонентов липосом их введение в организм не вызывает негативных реакций.
Второе важное свойство липосом – это универсальность. Благодаря полусинтетической природе можно широко варьировать их размеры, характеристики, состав поверхности. Это позволяет поручать липосомам переносить широкий круг фармакологически активных веществ: противоопухолевые и противомикробные препараты, гормоны, ферменты, вакцины, а также дополнительные источники энергии для клетки, генетический материал.
В-третьих, липосомы сравнительно легко разрушаются в организме, высвобождая доставленные вещества, но в пути следования липосомы, сами лишенные свойств антигена, надежно укрывают и свой груз от контакта с иммунной системой и, стало быть, не вызывают защитных и аллергических реакций организма.
Важную роль играет также характер взаимодействия липосом с клетками. Оно может принимать разные формы: самая простая – липосомы адсорбируются (прикрепляются) на клеточной поверхности. Дело может на этом закончиться, а может пойти дальше: липосому поглотит клетка (этот процесс «заглатывания» называется эндоцитоз), и вместе с ней внутрь клетки попадут те вещества, которые она доставила. Наконец, липосомы могут слиться с мембранами клеток и стать их частью. При этом могут изменяться свойства клеточных мембран: например, их вязкость и проницаемость, величина электрического заряда. Может также увеличиться или уменьшиться количество каналов, проходящих через мембраны. Таким образом, благодаря липосомам появляется новый способ направленного воздействия на клетку, который можно назвать «мембранной инженерией».
Формы взаимодействия липосом с мембраной клетки: липосома может увеличить проницаемость мембраны – вызвать образование дополнительных каналов (I); может прикрепиться к мембране – адсорбироваться (II); важная форма взаимодействия – поглощение липосомы клеткой, в этом случае вещество, принесенное липосомой, попадает непосредственно в клетку (III); иногда клеточная мембрана и липосома обмениваются липидами (IV), а в других случаях мембраны липосомы и клетки сливаются (V).
В зависимости от размера частиц и числа образующих их липидных слоев различают следующие липосомы:
1) малые моноламеллярные, образованные одиночным липидным бислоем (диаметр 20-50 нм);
2) крупные моноламеллярные, образованные также одиночным бислоем (диаметр 50-200 нм и выше);
3) многослойные (мультиламеллярные), насчитывающие до нескольких десятков и даже сотен липидных бислоем (диаметр до 5000-10000 нм)
Для приготовления липосомы обычно используют фосфолипиды. Многослойные липосомы легко образуются при встряхивании водной дисперсии набухшего липида. При этом получается взвесь липосомы с широким распределением частиц по размерам. Сравнительно гомогенную дисперсию липосомы можно получить, пропустив их через поликарбонатные фильтры с заданным размером пор. Расстояние между соседними липидными бислоями составляет 2-3 нм, но может возрастать до 20 нм и более в случае заряженных бислоев. На 1 моль липида многослойные липосомы содержат 1-4 литра воды. Они обладают свойствами идеального осмометра,(осмометр — (осмо + греч. metreo измерять) прибор для измерения осмотического давления или концентрации осмотически активных веществ) меняя свой объем в ответ на изменение концентрации веществ в окружающей водной среде. Малые моноламеллярные липосомы получают из многослойных при обработке их ультразвуком при впрыскивании спиртового раствора липидов в водную среду, продавливанием под большим давлением воднолипидных дисперсий через небольшое отверстие, а также удалением детергента, солюбилизирующего липид, диализом или гель-фильтрацией. Такие липосомы содержат 0,2-1,5 л воды на 1 моль липида. Малые моноламеллярные липосомы не обладают осмотической активностью и не коагулируют в течение длит. времени. Большие моноламеллярные липосомы имеют значит. внутренний объем воды (8-14 л на 1 моль липида) и обладают осмотической активностью. Обычно их получают удалением солюбилизирующего детергента в условиях контролируемого диализа или впрыскиванием раствора липида в легколетучем растворителе (диэтиловый эфир, петролейный эфир, пентан) в подогретую до 60 °С воду. Крупные однослойные липосомы могут быть также получены из малых липосом путем их слияния под действием Са2+ или в условиях термотропного фазового перехода. Получены также липосомы, образованные липидами (или подобными молекулами), которые способны полимеризоваться (содержат обычно связи С—С или ![]() ). Полимеризация может осуществляться как в гидрофобной, так и в гидрофильной области бислоя и приводить к, так называемым, полимерным липосомам. Последние отличаются от обычных липосом большей стабильностью. Липосомы широко используют в качестве модельных систем при изучении принципов молипосомы организации и механизмов функционирования биолипосомы мембран. Они пригодны для изучения пассивного транспорта ионов и малых молекул через липидный бислой. Изменяя состав липидов в липосомах, можно направленно менять свойства мембран. Включением мембранных белков в липидный бислой получают так называемые, протеолипосомы, которые используют для моделирования разнообразных ферментативных, транспортных и рецепторных функций клеточных мембран. Липосомы используют также в иммунологических исследованиях, вводя в них разлипосомы антигены или ковалентно присоединяя к липосомы антитела. Они представляют собой удобную модель для изучения действия на мембраны многих лекарственных средств и других биологически активных веществ. Во внутренний водный объем липосомы (в т. ч. полимерных) можно включать лекарства, пептиды, белки и нуклеиновые кислоты, что создает возможность практического применения липосомы в качестве средства доставки разных веществ в определенные органы и ткани.
). Полимеризация может осуществляться как в гидрофобной, так и в гидрофильной области бислоя и приводить к, так называемым, полимерным липосомам. Последние отличаются от обычных липосом большей стабильностью. Липосомы широко используют в качестве модельных систем при изучении принципов молипосомы организации и механизмов функционирования биолипосомы мембран. Они пригодны для изучения пассивного транспорта ионов и малых молекул через липидный бислой. Изменяя состав липидов в липосомах, можно направленно менять свойства мембран. Включением мембранных белков в липидный бислой получают так называемые, протеолипосомы, которые используют для моделирования разнообразных ферментативных, транспортных и рецепторных функций клеточных мембран. Липосомы используют также в иммунологических исследованиях, вводя в них разлипосомы антигены или ковалентно присоединяя к липосомы антитела. Они представляют собой удобную модель для изучения действия на мембраны многих лекарственных средств и других биологически активных веществ. Во внутренний водный объем липосомы (в т. ч. полимерных) можно включать лекарства, пептиды, белки и нуклеиновые кислоты, что создает возможность практического применения липосомы в качестве средства доставки разных веществ в определенные органы и ткани.
2.2 Использование липосом как транспортных частиц
В последнее время липосомы находят все большее признание в мире как перспективные носители лекарственных веществ, поскольку многочисленные клинические испытания показали, что лекарства, вводимые в составе липосом, более эффективны и менее токсичны, чем вводимые в свободном виде.
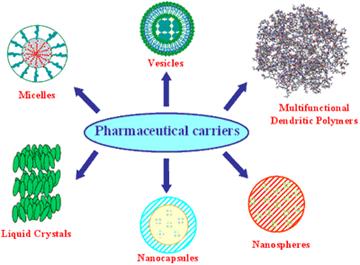
Рис. 1
На рисунке 1. показаны различные по своей природе транспортные частицы для лекарств.
Достоинства липосом как носителей лекарств очевидны: полученные из природных фосфолипидов липосомы в отличие от полимерных систем доставки лекарств полностью биодеградируемы и биосовместимы, пригодны для включения в них многих фармакологических агентов, в том числе ферментов, гормонов, витаминов, антибиотиков, иммуномодуляторов, цитостатиков. Включенные в липосомы лекарственные вещества становятся более устойчивыми в организме, так как изолированы липидной мембраной от повреждающих воздействий внешних условий, в частности от разрушения в желудочно-кишечном тракте, и в свою очередь в меньшей степени оказывают общее токсическое действие на организм. Уникальной особенностью липосом является возможность доставки лекарственных препаратов внутрь клеток, с которыми они взаимодействуют путем слияния или эндоцитоза. Модифицируя мембрану липосом молекулами, обеспечивающими «узнавание» клетки или органа-мишени, можно осуществлять направленную транспортировку лекарств.
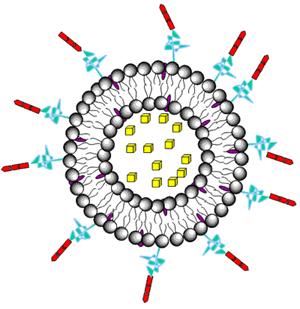
Рисунок 2. Схематичное изображение липосомы с лекарством
Особый интерес вызывает возможность орального применения липосомальных белковых препаратов, поскольку их инъекционные лекарственные формы быстро деградируют в желудке. Хотя механизм всасывания липосомальных препаратов в желудочно-кишечном тракте до конца не ясен, сообщений об их эффективности при пероральном приеме в литературе достаточно много. Так, например, несмотря на неоднозначные результаты по пероральному применению липосомального инсулина при лечении сахарного диабета, исследования в этом направлении продолжаются, а некоторые фирмы предполагают наладить промышленный выпуск этого препарата. Разработанный в дочернем государственном унитарном производственном предприятии (ДГУ ПП) «Вектор-Фарм» ГНЦ ВБ «Вектор» г. Новосибирска липосомальный генноинженерный альфа-2b интерферон (Липоферон) для энтерального применения(для приема внутрь) оказался эффективен при многих вирусных и ассоциированных с ними заболеваниях человека. В ряде клинических испытаний, проведенных в ведущих медицинских центрах страны, таких как ЦНИИ эпидемиологии МЗ РФ, НИИ педиатрии и детской хирургии МЗ РФ, ГНЦ Институт иммунологии МЗ РФ, Институт гриппа, были получены положительные результаты у взрослых и детей при лечении острого и хронического гепатита В, как свободного, так и ассоциированного с гломерулонефритом, гриппа, ОРЗ, атопических заболеваний, таких как риноконъюнктивит и бронхиальная астма.
Спектр терапевтического применения Липоферона для перорального применения постоянно расширяется, так как продолжающиеся клинические испытания выявляют все новые нозологические формы заболеваний, при лечении которых он эффективен. Очень важно, что липосомальный интерферон в пероральной форме хорошо переносится больными. При его применении не обнаруживаются побочные эффекты, сопровождающие парентеральное применение интерферона, такие как повышение температуры, озноб, утомляемость, кожные высыпания, лейко- и тромбоцитопения. Естественный путь введения — «peros» — делает препарат незаменимым в педиатрической практике. Немаловажно и то, что при пероральном приеме липосомальных препаратов отсутствует риск передачи вирусов СПИДа и гепатита.
Использование липосом оптимально при необходимости направленной транспортировки лекарственного вещества к органам ретикулоэндотелиальной системы (селезенка, печень и т.д.). В настоящее время тщательно разработана система применения и лечения антибактериальными препаратами в липосомах так называемых «инфекций РЭС». Доказана эффективность подобных препаратов при многих заболеваниях (лейшманиоз, сальмонеллез, брюшной тиф, бруцеллез, малярия и др.), появились работы по использованию липосомальных противовирусных препаратов при герпесе, вирусном гепатите, лихорадке долины Рифт, ВИЧ-инфекции в эксперименте на животных. При парентеральном введении распределение липосом в организме зависит от состава липосомальной мембраны, их размера, заряда, других химических и физических параметров везикул и иммобилизованных в них веществ, а также от способа введения. Так, например, после подкожного введения основное количество липосом депонируется в месте введения и элиминируется оттуда преимущественно лимфогенным путем. Таким образом, местное введение липосомальных препаратов является оптимальным способом их доставки в регионарные лимфоузлы. При внутримышечном введении липосомы способны создавать депо препарата в месте введения, скорость элиминации из депо зависит от размера и свойств липосом и составляет от нескольких часов (если липосомы мелкие) до нескольких дней (если крупные). Мелкие бислойные липосомы в отличие от крупных при внутрибрюшинном или внутримышечном введении гораздо быстрее проникают в кровеносное русло, что указывает на ограниченную способность последних проходить через капилляры и мембраны сосудов. При внутривенном введении мелкие липосомы выводятся из кровотока медленнее, чем крупные.
Для повышения тропности (способность воздействовать на что-либо) липосом к определенным органам и тканям их изготавливают из фосфолипидов, изолированных из этих органов, или фиксируют на поверхности специфические антитела против соответствующих тканевых антигенов, или применяют так называемые молекулы-посредники, обладающие двумя типами сродства: с одной стороны — к клеткам макроорганизма, с другой — к липосоме. Как отмечают исследователи, липиды в определенной степени участвуют в «узнавании» клеток, поскольку каждому типу мембран соответствует определенное, характерное только для него соотношение полярных липидов. В процессе «узнавания» важную роль играют также гликолипиды (ганглиозиды), участвующие в межклеточных взаимодействиях и являющиеся специфическими рецепторами ряда биологически активных веществ. То есть механизм взаимодействия липосом с клетками определяют не только фосфолипиды, но и ганглиозиды, входящие в состав липосом. Изучение распределения липосом, содержащих фосфатидилхолин, холестерин и гликолипид, при внутривенном введении в организм показало, что наилучшим гликолипидом для липосом в отношении их переноса в ткани головного мозга и печени является сульфатид, в ткани селезенки — ганглиозиды, в ткани легких — сфингомиелин. Так, например, человеческий a-интерферон, иммобилизованный в липосомы, мембрана которых построена из фосфатидилхолина, холестерина и сульфатида, после внутрибрюшинного введения в большей степени обнаруживается в крови, печени, селезенке и опухолевой ткани мозга.
Если необходимо локальное воздействие на клинический процесс, то для исключения системного влияния на организм целесообразно местное применение лекарственных препаратов.
Липосомальные препараты по сравнению с традиционными лекарственными формами для наружного применения, такими как мази и гели, обладают большей способностью проникать в кожу и волосы, а потому они более доступны для живых клеток-мишеней. Установлено, что липосомы интенсифицируют процессы взаимодействия активных веществ с кожей при лечебной наружной терапии, что приводит к повышению терапевтической эффективности иммобилизованных в них лекарственных веществ. Вероятнее всего, такой эффект вызван слиянием липосом с липидными ламеллами, не доходя до базального слоя, и высвобождением их внутреннего содержимого. Подвижные липиды липосом встраиваются в липидные ламеллы, увеличивая таким образом «жидкостность» барьера, что улучшает проницаемость. Другим важным путем проникновения липосом и их содержимого вглубь кожи являются волосяные фолликулы. Эффективность трансдермального липосомального переноса лекарственных веществ можно усиливать, используя методы ионо- и фонофореза.
2.3 Применение липосом в лечении вирусных заболеваний
Многие исследователи считают, что применение липосом в вакцинации способно усилить действие вакцин и при этом позволит сэкономить значительные денежные средства.
По мнению Марка Дж. Остро, вице-президента «Liposome Company» (USA), занимающей в мире ведущее положение в развитии липосомной технологии, в ближайшее время найдут свое применение не менее 15 новых терапевтических средств, основанных на липосомной технологии. По оценке американских специалистов, в ближайшее время продажа липосом на мировом рынке составит 20–25 % средств доставки лекарственных препаратов. Ведущее положение в исследованиях и разработках липосомальных форм введения лекарственных средств занимают три американские компании — «The Liposome Company» (TLC), «Liposome Technology Inc.» (LTI), «Vestar». Благодаря их исследованиям на рынок уже введены липосомальный амфотерицин В (TLC) для лечения системных микозов, противоопухолевые липосомальные препараты — даунорубицин («Vestar»), доксорубицин (TLC — Dox 99), цисплатин (TLC). Многие препараты проходят завершающие стадии клинических испытаний — это и липосомальные вакцины против гриппа и меланомы, и противодиабетический комплекс инсулин-липосомы, и противовирусные нуклеозиды для лечения СПИДа, и серия липосомальных бронхорасширяющих препаратов и т.д.
Разумеется, создателям липосомальных препаратов предстоят дальнейшие исследования в данной области. Необходимо совершенствовать технологию производства липосомальных препаратов, добиваться большей стабильности готовых лекарственных форм, удешевлять производство. Однако опыт производства российского липосомального интерферона свидетельствует о возможности решения этих задач. По нашему мнению, на данном этапе развития науки о липосомах важно использовать в производстве липосомальных препаратов только природные материалы, поскольку введение липосом, приготовленных на основе природного лецитина (фосфолипид, в состав которого входит холин), не связано с риском развития токсичности, иммуногенности и возникновения аллергических реакций. Кроме того, на применение природного лецитина в производстве пищевых продуктов, косметических и лекарственных средств отсутствуют ограничения как в Европейском союзе, так и в инструкциях Управления по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (FDA). Очень осторожно нужно подходить к применению у людей липосом, приготовленных из синтетических, полимеризованных липидов. Безусловно, полимерные липосомы, или липосомы второго поколения, значительно увеличат время циркуляции лекарств в кровотоке и, вероятно, за ними большое будущее, однако необходимо решить проблему токсичности и плохой биодеградации полимерных носителей
Липоферон – липосомированный препарат рекомбинантного α-2b интерферона – хорошо переносится больными и имеет высокую эффективность как в профилактике, так и лечении вирусных инфекций (грипп, ОРВИ, гепатиты В и С). Естественный путь введения (через рот) делает препарат незаменимым в педиатрической практике и при амбулаторном лечении.
Рекомбинантные α2-интерфероны (ИФН) обладают антивирусной, противоопухолевой и иммуномодулирующей активностью. Препараты ИФН широко применяются в комплексной терапии вирусных, бактериальных и онкологических заболеваний человека. Для достижения терапевтического эффекта необходимы ежедневные инъекции высоких доз препарата – от 1-2 до 50 млн МЕ, так как протеазы крови и других биологических жидкостей организма быстро разрушают ИФН. Парентеральное введение высоких доз ИФН часто сопровождается повышением температуры, ознобом, утомляемостью, кожными высыпаниями, лейко- и тромбоцитопенией и другими побочными эффектами. Так, при лечении хронического гепатита С побочные эффекты наблюдаются у 72% больных.
Создание препаратов рекомбинантного ИФН, не вызывающих побочных эффектов, – крайне актуальная проблема. Одним из подходов к решению этой сложной задачи является липосомирование, т. е. заключение ИФН в липосому. На международном фармрынке уже представлен липосомальный амфотерицин В для лечения системных микозов, противоопухолевые липосомальные препараты – даунорубицин, доксорубицин, цисплатин. Целый ряд препаратов находится на завершающих фазах клинических испытаний: липосомальные вакцины против гриппа и меланомы, противодиабетический комплекс инсулин-липосомы, противовирусные нуклеозиды для лечения СПИДа, серия липосомальных бронхорасширяющих препаратов и др. Эти препараты значительно менее токсичны, чем нелипосомированные.
Достоинства липосом как носителей лекарств состоят в том, что, полученные из природных фосфолипидов, они в отличие от полимерных систем доставки лекарств полностью биодеградируемы и биосовместимы. Включенные в липосомы лекарственные вещества оказываются более устойчивыми в организме, так как изолированы липидной мембраной от повреждающих воздействий, в частности от разрушения в желудочно-кишечном тракте, поэтому в меньшей степени оказывают общетоксическое действие на организм. Уникальной особенностью липосом является возможность доставки лекарственных препаратов внутрь клеток, с которыми они взаимодействуют, путем слияния или эндоцитоза. Особый интерес вызывает возможность орального применения липосомальных белковых препаратов.
Специалисты ДГУ «Вектор-Фарм» ГНЦ ВБ «Вектор» в течение 10 лет разрабатывали и внедряли в медицинскую практику липосомальный генно-инженерный α-2b ИФН (торговое название в Украине – Липоферон) для перорального применения. В состав препарата Липоферон входят только фармацевтически приемлемые компоненты. Препарат выгодно отличается отсутствием в составе альбумина, способного вызывать аллергические реакции. Пероральное применение Липоферона надежно защищает организм больного от риска передачи инфекций (ВИЧ, вирусы гепатитов В, С (ВГВ, ВГС)) при инъекциях. Также отсутствует психоэмоциональный фактор, характерный для инъекций, особенно у детей. Готовая форма препарата представляет собой лиофильно высушенный продукт, восстанавливающий липосомальную структуру при добавлении воды.
В результате доклинического исследования было установлено, что ИФН, заключенный в липосомы, сохраняет биологическую активность в желудочно-кишечном тракте и всасывается в кровь. По скорости всасывания ИФН, заключенный в липосомы и применяемый перорально, оказался близок к свободному ИФН, вводимому внутримышечно, но в остальном фармакокинетика препаратов заметно отличалась. Так, например, высокий уровень накопления ИФН в сыворотке крови мышей регистрировался через 1 ч независимо от применяемой лекарственной формы препарата. Липосомальный ИФН отличался более длительным периодом циркуляции в крови лабораторных животных, его период полувыведения составлял 6 ч, в то время как у Реаферона-ЕС – 3 ч. К 6 ч уровень ИФН в сыворотке крови после введения Реаферона падал до фоновых значений, после введения Липоферона это происходило к 9 ч, с последующим новым подъемом к 15 ч.
2.4 Липосомы и противотуберкулезная терапия
Гидразид никотиновой кислоты — основной противотуберкулёзный препарат. Если упаковать его в липосомы, это позволит адресно доставлять лекарство к микобактериям туберкулёза. Исследованиями в этой области занимаются специалисты Научного центра клинической и экспериментальной медицины СО РАМН при поддержке федеральной целевой программы Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007—2012 годы.
При туберкулёзном воспалении образуются гранулемы, которые состоят из клеток иммунной системы макрофагов, набитых микобактериями туберкулёза. Поэтому в макрофаги необходимо доставить лекарство. Адресная доставка позволит снизить токсическую нагрузку на печень. Макрофаги обладают способностью заглатывать мелкие частицы, поэтому предлагаемое лекарство, гидразид никотиновой кислоты, упаковывают в липосомы. Новосибирские учёные создали молекулярно-липосомальные гибридные композиции (МЛГК) размером от 200 до 450 нм, которые содержат окисленные декстраны, связанные с лекарством. Теперь исследователи проверяют, какие факторы могут повлиять на эффективность заглатывания МЛГК фагоцитами.
Учёные провели эксперименты на мышиных макрофагах. Клетки обработали ферментами и соединениями, которые теоретически могли бы помешать макрофагам поглощать липосомы. Процесс поглощения можно условно разделить на две стадии: сначала МЛГК налипают на клетки, а потом попадают внутрь. Оказалось, что слущивание с поверхности фагоцитов белковых молекул, способных выполнять функции рецепторов, не играет роли в прилипании МЛГК к мембранам клеток. Несколько ослабить этот процесс может пониженный метаболизм в клеточных мембранах.
Собственно фагоцитоз, то есть доля клеток, поглощающих липосомы, и количество липосом, которые заглатывает одна клетка, зависит от подвижности цитоскелета клетки, то есть возможности мембраны втягиваться и выпячиваться, и от уровня метаболизма на клеточных мембранах. Нарушения этих процессов снижают активность фагоцитоза вдвое, но, тем не менее, поглощение МЛГК всё равно происходит. Исследователи пришли к выводу, что макрофаги активно захватывают лекарство, заключённое в липосомах, поэтому МЛГК в состоянии обеспечить его адресную доставку к микобактериям туберкулёза.
2.5 Использование липосом в химиотерапии при онкозаболеваниях
Стандартной экструзией через калиброванные ядерные мембраны получены стабильные липосомы среднего диаметра 100 нм на основе природных фосфолипидов и липофильных пролекарств широко применяемых химиотерапевтических средств – метотрексата и мелфалана. Липосомы показали эффективность при системном введении мышам с экспериментальными опухолями. Фармакокинетика метотрексата в плазме крови мышей свидетельствует о преимуществах его применения в виде липофильного пролекарства в липосомах.
Открытие явления пассивного транспорта частиц примерно 100-нм размеров в опухоли и очаги воспаления (1) послужило импульсом для бурного развития исследований в области разработки систем доставки лекарств. Применение нанотехнологий уже является общепризнанной в мире стратегией развития фармацевтического производства на ближайшие десятилетия. Включение лекарств в биосовместимые полимерные или супрамолекулярные носители уменьшает концентрацию свободных препаратов в кровотоке и препятствует их быстрому выведению почечной системой, что позволяет уменьшить общую токсичность и увеличить терапевтический индекс за счет улучшения фармакокинетики и биораспределения. Накопление наноразмерных носителей в опухолях и очагах воспаления осуществляется благодаря дефектной архитектуре формирующейся denovo сосудистой системы и повышенной проницаемости ее эндотелия. В то же время, высокое интерстициальное давление в солидных (твердых) опухолях не позволяет удерживаться в них частицам с размерами менее 30–40 нм (эффект enhanced permeability and retention). Оптимальный размер носителей, обеспечивающий пассивный транспорт лекарств, попадает в интервал 50–150 нм. Липосомы, наряду с липидными наносферами, относятся к наиболее био- и гемосовместимым носителям и пригодны для системного введения в организм. Липосомы более 30 лет назад привлекли внимание в качестве систем доставки лекарств. Исследования получили новый импульс после разработки технологии получения липосом Stealth® (2). Поверхность таких липосом защищена от опсонизации (адсорбции белков плазмы) и преждевременного вывода из кровотока клетками иммунной системы благодаря экранированию привитыми высокогидратированными остатками полиэтиленгликоля. Препараты на основе Stealth-липосом применяются в клинике уже более 10 лет: например, липосомы с доксорубицином (Doxil, Caelix и др. производства США, стран ЕС, Украины) – для лечения саркомы Капоши и рака яичников (3). Однако создание подобных конструкций для широкого спектра водорастворимых средств оказалось невозможным, поскольку метод активной загрузки, применяемый при их производстве, пригоден лишь для ограниченного числа лекарств, имеющих природу слабых амфифильных кислот или оснований (например, антибиотики антрациклинового ряда типа доксорубицина). Альтернативный лабораторный способ – формирование липосом в водно-солевом растворе лекарства с последующим отделением от невключившегося агента – нетехнологичен.
Мы предлагаем включать лекарства в липидный бислой липосом в виде липидных производных – липофильных пролекарств, которые расщепляются внутриклеточными ферментами с высво
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Порядок декларирования лекарственных препапратов
Глава 1. Теоретические основы декларирования1.1 Что такое декларация соответствия1.2 Чем отличаются процессы сертификации и декларирова
- Протокол исследования фармакодинамики лекарственного препарата
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ УКРАИНЫЛУГАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТКАФЕДРА КЛИНИЧЕСКОЙ ФАРМАКОЛОГИИ, ФАРМАЦИИ
- Профилактика и лечение гипогалактии
Рефератна тему: Профилактика и лечение гипогалактииПлан1. Значимость грудного вскармливания2. Становление лактации3. Определение гипо
- Развитие зубов у детей
Развитие зубов – у детей очень важный процесс, начинающийся ещё в утробе матери. Состояние будущих зубов зависит от многих факторов. Су
- Репродуктивное поведение и его безопасность
Актуальность исследования проблем репродуктивного поведения объясняется системным кризисом воспроизводства населения страны, резул
- Реставрация зубов
СодержаниеО реставрации зубов и красоте улыбкиОтносительные противопоказания к проведению реставрацииОсновные принципы реставрации
- Роль сестры руководителя по совершенствованию организации работы ЦСО
Глава 1. Теоретическое исследование проблемы организации повышения качества медицинской услуги1.1 Качество медицинской услуги и деятел
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

