Педосфера и ее значение
Почва – уникальная природная система. Главным свойством почвы является неразрывная связь входящих в нее живых и неживых (косных) компонентов. Их искусственное разделение делает невозможным существование почвы и полностью разрушает ее как систему. В.И. Вернадский удачно назвал почву «биокосным телом».
Состав почвы весьма сложен. В ней имеется не только твердая фаза, но также жидкая (почвенный раствор) и газовая (почвенный воздух). Твердая фаза представляет собой полидисперсную систему, в которой присутствуют относительно крупные обломки размером более 0,01 мм и высокодисперсные частицы размером менее 1 мкм. Компоненты разной крупности различаются механическими и физико-химическими свойствами. Минеральная часть очень разнородна и помимо обломков минералов исходных горных пород представлена также различными почвенно-гипергенными новообразованиями. Почва состоит не только из минеральных, но и из органических соединений. Главное своеобразие почвы в том, что среди ее разнородных компонентов есть живые организмы.
Почва образуется и функционирует как система при сочетании взаимообусловленной жизнедеятельности разных групп организмов. Среди них организмы, осуществляющие фотосинтетическое продуцирование органического вещества (высшие растения); организмы, обеспечивающие деструкцию ежегодно отмирающих органов растений (почвенная мезофауна и животные); организмы, производящие глубокую трансформацию продуктов деструкции, вплоть до их полной минерализации с выделением СО2 и образованием специфических органических соединений почвы (микроорганизмы).
Обеспечение фотосинтезирующих организмов элементами почвенного питания связано с двумя важнейшими компонентами почвы. Первым из них является мертвое органическое вещество, из которого в результате жизнедеятельности мезофауны и микроорганизмов постепенно выделяются элементы, аккумулированные фотосинтетиками и необходимые для их воспроизводства. Благодаря взаимодействию фотосинтетиков и гетеротрофных организмов происходит циклическая миграция элементов в системе растительность – органическая часть почвы. Второй компонент почвы, являющийся источником доступных форм химических элементов Для высших растений, – дисперсные минеральные частицы, которые благодаря огромной поверхности в единице объема содержат значительное количество сорбированных химических элементов.
Эти элементы не могут вымываться фильтрующимися через почву атмосферными осадками, но легко поглощаются корнями растений. Высокодисперсное минеральное вещество играет ответственную роль в механизме биологического круговорота элементов.
Весьма важное значение имеет микроморфология почв. Агрегированность почвенных частиц способствует сохранению и регулированию поступления воды и элементов питания в высшие растения. Система межагрегатных пустот и пор способствует свободному газообмену между почвой и приземным слоем тропосферы, выделению газообразных продуктов почвообразования, в первую очередь СО2.
1. Планетарное значение педосферы
Почва – такой же компонент природной среды Мировой суши, как горные породы, воды, растительность и др. Вместе с тем почва является результатом их взаимодействия. Изменение одного или нескольких из этих компонентов влечет за собой соответствующее изменение почвы. Поэтому каждому природному ландшафту соответствует определенная почва.
Основоположник генетического почвоведения выдающийся ученый и мыслитель В.В. Докучаев называл почву естественноисторическим телом, имея в виду, что природные условия (следовательно, и почвы) изменяются не только в пространстве, но и во времени. Эта идея подтверждается палеогеографическими и палеогеохимическими фактами.
С началом освоения живым веществом суши на ее поверхности стало формироваться особое биогеохимическое образование, отсутствующее в океане, – почва. Возникновение почвы как биокосного тела связано с определенным этапом развития живого вещества на Земле.
Одно из основных свойств живого вещества – стремление к прогрессирующему увеличению постоянно возобновляемой живой массы и к максимальному заполнению доступного пространства (закон Вернадского). Рост массы живого вещества в океане сильно затруднен: фотосинтезирующие организмы локализованы в поверхностном слое океана; увеличение их массы ограничено низкой концентрацией элементов питания в морской воде. Это ограничение компенсируется высокой скоростью жизненных циклов организмов, составляющих массу живого вещества океана. По этой причине большая часть массы химических элементов, необходимых для живого вещества, не выпускается из системы тесно связанных биологических круговоротов разных групп организмов. Через сравнительно небольшую массу фотосинтетиков на протяжении года многократно проходит одно и то же количество химических элементов.
Трофические условия на суше более благоприятны. Практически неограниченное количество большинства химических элементов в земной коре создает возможность для существенного увеличения массы живого вещества на суше по сравнению с океаном. Следовательно, распространение живого вещества на пространство Мировой суши было детерминировано. В то же время освоение суши живыми организмами встретило значительные затруднения.
Рост живой массы на суше лимитируется, с одной стороны, гидротермическими условиями, в первую очередь атмосферным увлажнением, так как без воды жизнь невозможна, а с другой – наличием доступных форм химических элементов, необходимых для организмов, фотосинтезирующих первичное органическое вещество.
Затруднения в освоении суши были связаны, во-первых, с низкой концентрацией доступных форм химических элементов в некоторых горных породах. Во-вторых, длительные сезоны недостаточного увлажнения или полного отсутствия воды не только сами по себе отрицательно влияют на организмы, но также нарушают регулярное поступление элементов питания.
Почва возникла как природный механизм, нейтрализующий неблагоприятные условия окружающей среды и создающий возможность для развития фотосинтезирующих организмов. С течением геологического времени этот механизм совершенствовался и способствовал «расползанию» живого вещества по поверхности суши. Первоначально локализованная на отдельных участках вблизи берегов морей и внутренних водоемов почва постепенно покрыла всю сушу тонкой, почти непрерывной оболочкой, названной В.И. Вернадским (1936) педосферой.
Образование педосферы и освоение Мировой суши живым веществом повлекло за собой изменение его количества и структуры, а также всей динамики глобальных биогеохимических процессов. Биокосная система почвы сложилась как оптимальный природный механизм обеспечения жизнедеятельности фотосинтезирующих растений, создающих основу функционирования биоценозов – первичное органическое вещество. В дальнейшем благодаря разнообразным взаимосвязанным биогеохимическим процессам в почве стало осуществляться взаимодействие всех факторов и компонентов, образующих конкретную биогеосистему (ландшафт). Это взаимодействие происходит путем непрерывной циклической миграции масс химических элементов.
Распространившись на всю поверхность Мировой суши, педосфера приобрела значение главного звена и регулятора глобальных циклических процессов массообмена химических элементов. Педосфера в равной мере связана массообменом элементов с земной корой, живым веществом и атмосферой. В педосфере происходит мобилизация химических элементов, вовлекаемых в водную миграцию и затем выносимых в океан. С поверхности педосферы захватываются мелкие почвенные частицы, формирующие континентальные аэрозоли, частично выносимые за пределы суши. В то же время на поверхность педосферы поступают атмосферные осадки, переносящие химические элементы, в том числе выделенные с поверхности океана. И главное – в педосфере начинается и заканчивается грандиозный кругооборот химических элементов: педосфера – растительность Мировой суши. Все перечисленные процессы являются в основе биогеохимическими. Современные данные позволяют рассматривать педосферу как планетарный механизм, который благодаря сложной системе взаимообусловленных процессов регулирует биосферные циклы массообмена химических элементов.
2. Органическое вещество педосферы
Органическое вещество является одним из наиболее важных компонентов педосферы. Огромная масса органического вещества преимущественно растительного происхождения ежегодно поступает в педосферу. В зависимости от биоклиматических условий в разных районах Мировой суши (за исключением территории, покрытой ледниками, и абсолютных пустынь) поступление мертвого органического вещества колеблется от 100 до 2500 т/км2 в год. Суммарная масса ежегодно отмирающего органического вещества (с учетом сокращения природной растительности человеком) близка к (125–130)×109 т.
Разное количество поступающих растительных остатков, неодинаковая направленность и интенсивность микробиологической деятельности, разнообразные гидротермические условия способствуют образованию весьма сложного комплекса органических соединений гумуса почв. Состав почвенного гумуса динамичен: он непрерывно обновляется в результате разложения и синтеза его компонентов.
В органическом веществе почвы различают три главные группы. Первую группу составляют почти не разложившиеся или слаборазложившиеся остатки преимущественно растительного происхождения. Они образуют лесные подстилки, степной войлок. Это так называемый грубый гумус. В нем под микроскопом хорошо видны все детали растительной ткани – конфигурация клеток, толщина их оболочек и др. Наименее стойкие ткани (камбий, флоэма, паренхима первичной коры) разрушены.
Ко второй группе относятся остатки, образующие рыхлое черное вещество. Только под микроскопом видно, что это вещество состоит из измельченных и сильно измененных растительных остатков: мелких обрывков растительных тканей, лишь отчасти сохранивших реликты клеточного строения и обильно пропитанных новообразованными органическими соединениями. Такая форма почвенного органического вещества называется модер.
Третья группа состоит из специфических почвенных органических образований, не обнаруживающих следов строения растительных тканей и составляющих собственно гумус. Это аморфные скопления от хорошо прозрачных светло-желтых до плохо прозрачных темно-бурых. В одних почвах гумусовые вещества диффузно распределены в почвенном матриксе, в других – склеивают мелкие минеральные частицы, образуя гумус типа муллъ.
Перечисленные формы почвенного органического вещества образуются в условиях хорошей аэрации. При длительном водонасыщении почвы деятельность мезофауны и аэробных микроорганизмов подавляется и преобразование растительных остатков замедляется. В таких условиях из осадков гидрофильных растений, главным образом мхов, образуется торф. Его характерные черты: слабая разложенность растительных осадков (менее 30%) и волокнистое строение благодаря преобладанию мхов среди растений-торфообразователей. Органическое вещество почвы, состоящее из торфяных компонентов, называется гумусом типа мор. Между рассмотренными формами почвенного органического вещества существуют постепенные переходы.
Таким образом, органическое вещество почвы состоит из слабоизмененных остатков растений, продуктов их измельчения и первоначального преобразования мезофауной и микроорганизмами, а также из специфических почвенных органических веществ. Две последние категории составляют собственно почвенный гумус.
Трансформация органического вещества в почве происходит под воздействием жизнедеятельности микроорганизмов. Разные микроорганизмы и свойственные им ферменты взаимодействуют с определенными компонентами растительных остатков. Неспороносные бактерии используют наиболее доступные компоненты: простые углеводы, аминокислоты, простые белки. Целлюлозные миксобактерии перерабатывают устойчивые углеводы. Актиномицеты завершают процесс, разлагая наиболее устойчивые компоненты растительных остатков и гумусовые вещества.
Образование гумусовых веществ протекает при участии процессов двух типов. Процессы первого типа обеспечивают частичное разложение поступивших органических соединений до более простых. Например, белки расщепляются на аминокислоты, углеводы – на простые сахара и т.д.
Процессы второго типа значительно сложнее. Это связано с тем, что гидролиз органических полимеров прерывается, если фермент встречается с неоднородностью в строении полимера.
Примером может служить случай, когда фермент, специализированный на преобразовании целлюлозы, встречается с лигнифицированной частью полимера. Остатки труднопреобразуемых веществ накапливаются и служат исходным материалом для специфических химических реакций конденсации. Эти реакции, отсутствующие среди биологических реакций полимеризации, приводят к образованию весьма устойчивых соединений.
В результате процессов второго типа происходит конденсация ароматических соединений фенолъного типа (продуктов распада лигнина и целлюлозы) с аминокислотами (продуктами распада микроорганизмов). В процессе окисления и конденсации образуются карбоксильные группы, которые вместе с фенолгидроксильными группами способствуют кислотному характеру гумусовых веществ.
Основными компонентами гумуса являются гуминовые и фульвокислоты, их соли, а также гумин – своеобразный комплекс сильно полимеризованных высокомолекулярных гумусовых кислот, связанных с высокодисперсными минеральными частицами. Между этими компонентами существуют переходы.
Гумусовые кислоты – высокомолекулярные соединения со сложной структурой. Согласно Д.С. Орлову (1974), структурная ячейка гуминовых кислот из дерново-подзолистой почвы имеет вид C173H183O86N11, из чернозема – C73H61O32N4; структурная ячейка фульвокислот из дерново-подзолистой почвы – C270H318O206N16, из чернозема – C260H280O177N15. В составе гуминовых кислот содержание углерода колеблется от 40 до 60%, азота – от 3,5 до 6%. Фульвокислоты содержат меньше углерода и азота: соответственно от 35 до 50% и от 3 до 4,5%.
Основными структурными единицами сложных молекул гуминовых кислот являются сконденсированная центральная часть (ядро) и боковые цепи, состоящие из функциональных групп.
Реакционная способность гуминовых кислот связана с карбоксильными и фенолгидроксильными группами, водород которых может замещаться другими катионами. Часть водорода функциональных групп замещается комплексными катионами типа Fe(OH)2 и т.п. В результате образуются сложные внутрикомплексные соединения – хелаты железа, алюминия и других металлов. Гуминовые кислоты не растворяются в воде, но хорошо растворимы в щелочных растворах.
Фульвокислоты имеют похожее строение, но в них боковые цепи преобладают над ядром. Содержание карбоксильных и фенолгидроксильных групп больше, чем у гуминовых кислот. Фульвокислоты растворяются в воде, растворы имеют сильнокислую реакцию (рН 2,6–2,8). Растворяющая способность фульвокислот усиливается их склонностью к хелатированию. Комплексные соединения фульватов могут активно мигрировать в природных водах в таких физико-химических условиях, где свободные катионы металлов выпадают в осадок.
Изучение распределения металлов в гумусовых кислотах, выделенных из подзолистых почв северо-запада европейской части России, показало, что концентрация меди, цинка, свинца и никеля значительно выше в фульвокислотах.
Таблица 1. Концентрация тяжелых металлов в гумусовых кислотах подзолистых почв северо-запада европейской части России, мг/кг сухого вещества
Гумусовые кислоты | Металл | |||||||
Сu | Zn | Pb | N1 | Со | Mn | V | Mo | |
| Дерново-слабоподзолистая глеевая | ||||||||
| Гуминовые кислоты Фульвокислоты | 6,0 25,0 | 10,0 100,0 | 0,2 0,4 | 1,6 15,0 | 0,4 0,9 | 10,0 5,0 | 40,0 4,0 | 0,4 |
| Дерново-среднеподзолистая | ||||||||
| Гуминовые кислоты Фульвокислоты | 8,0 15,0 | 16,0 150,0 | 0,6 3,0 | 0,6 5,0 | 2,0 1,5 | 2,0 1,5 | 6,0 0,5 | 10,0 |
| Подзолистая иллювиально – железистая | ||||||||
| Гуминовые кислоты Фульвокислоты | 6,0 15,0 | 5,0 20,0 | 0,2 15,0 | 0,5 | 2,0 0,5 | 2,0 0,5 | 0,2 | 2,0 1,0 |
И.З. Рабинович (1969) определил содержание некоторых тяжелых металлов в гуминовых кислотах, извлеченных из распространенных почв Молдавии. Обнаружено, что концентрация металлов в гуминовых кислотах значительно выше не только их концентрации в изученных почвах, но и средней концентрации в растительности Мировой суши. Так, в гуминовых кислотах из чернозема, являющихся наиболее важной частью гумуса этих почв, концентрация цинка более чем в 2 раза выше средней концентрации этого элемента в растительности суши, ванадия – в 17 раз, хрома и кобальта – еще больше.
Селективное соединение рассеянных металлов с водорастворимыми компонентами гумуса (фульвокислотами) или с гелями гуминовых кислот имеет важное значение как для вовлечения металлов в миграционные циклы, так и для выведения их из миграции и закрепления в почве.
Таким образом, гумус почв играет двоякую роль. С одной стороны, он выступает как источник азота и других элементов, приоритетно необходимых для высших растений и освобождающихся из органического вещества в результате микробиологической деятельности. Поэтому гумус почв – важный фактор продуктивности фитоценозов и плодородия почв. С другой стороны, гумусовые кислоты и их производные благодаря особенностям молекулярного строения активно влияют на миграцию и аккумуляцию химических элементов в педосфере. По этой причине гумусовые вещества являются важной частью механизма регулирования миграционных потоков в педосфере.
Отмирающие части растений поступают в почву в виде ежегодного опада. Его количество не пропорционально биомассе растительности. Так, лесные сообщества южной тайги, обладающие огромной биомассой (более 3000 ц/га сухого вещества), вносят в почву ежегодно около 50 ц/га сухого вещества, в то время как у растительности луговых степей, имеющей значительно меньшую биомассу (250 ц/га), опад почти в 3 раза больше.
Значительная часть растительных остатков располагается на поверхности почвы в виде лесной подстилки в лесах, травяного войлока в травянистых сообществах, скоплений торфа в заболоченных ландшафтах. Присутствие растительных остатков указывает, что их разложение идет медленнее, чем поступление новых продуктов отмирания.
Об интенсивности переработки растительных остатков мезофауной и микроорганизмами в почвенный гумус можно судить по соотношению количества мертвого органического вещества на поверхности почвы и его ежегодного поступления на поверхность. По данным Л.Е. Родина и Н.И. Базилевич, это соотношение имеет наиболее высокое числовое значение (90) в тундровых ландшафтах. Это означает, что в суровых условиях тундры жизнедеятельность почвенной мезофауны и микроорганизмов настолько сильно подавлена, что полная переработка годового опада растительности растягивается на 90 лет, а биологический круговорот химических элементов сильно заторможен. В ландшафтах степей это соотношение равно 1,0–1,5, т.е. преобразование опада совершается в течение одного–двух лет. В пустыне это происходит еще быстрее, так как растительные остатки на почве практически отсутствуют. В лесных сообществах числовое значение рассматриваемого соотношения зависит от гидротермических условий и длительности теплого сезона, допускающего жизнедеятельность мезофауны и микроорганизмов. В почве таежных лесов полная переработка растительных остатков происходит за 7–8 лет, в широколиственных лесах умеренного пояса за 2–3 года, во влажных экваториальных лесах непрерывно на протяжении года. Столь быстрое разложение растительных остатков происходит при условии свободного газообмена почвы с атмосферой, который способствует активной аэробной мезо- и микробиологической деятельности. В тех местах, где мертвое органическое вещество насыщено водой, газообмен затруднен. Это подавляет деятельность аэробных организмов, сильно замедляет разложение растительных остатков и приводит к образованию торфа. Замедлению процесса также способствует присутствие в торфяных водах растворимых органических соединений с антисептирующими свойствами. В результате полуразложившиеся остатки растений сохраняются в торфяных залежах тысячи лет.
Биогеохимическая трансформация органического вещества в почве не ограничивается переработкой растительных остатков в гумус. Под воздействием микробиологической деятельности процесс продолжается до полного разрушения органического вещества с образованием СО2. Оценить время возобновления почвенного гумуса можно с помощью определения абсолютного возраста гуминовых кислот и гуматов по изотопу 14С с периодом полураспада 5678 лет. Полученные результаты показали, что обновление гумуса в верхнем горизонте современных почв происходит за 300–500 лет. В более глубоких горизонтах процесс обновления происходит значительно медленнее и гумусовые вещества имеют возраст в несколько тысяч лет. Очевидно, это связано с большей насыщенностью живыми организмами верхнего горизонта почв. Количество гумуса уменьшается вниз по разрезу почвы одновременно с уменьшением численности микроорганизмов (рис. 1).
Общая масса мертвого органического вещества педосферы слагается из слаборазложенных растительных остатков лесных подстилок, скоплений торфа и глубокопреобразованного органического вещества почв (гумуса). Массу лесных подстилок в педосфере до начала хозяйственной деятельности человека Л.Е. Родин и Н.И. Базилевич (1965) оценивают в 193,8×109т сухого вещества. С учетом сведения лесов в процессе хозяйственного использования земель эта цифра может быть уменьшена на 5–10%.
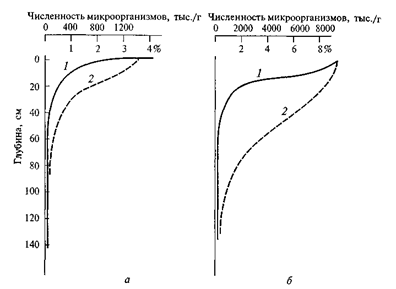
Рис. 1. Распределение по профилю подзолистой почвы (а) и чернозема (б) численности микроорганизмов (1) и органического вещества (2)
Масса неполностью разложившегося растительного материала торфа весьма значительна. Накоплению торфа способствуют условия холодного и влажного климата. Общие запасы торфа в пределах Мировой суши составляют 495×109 т сухого вещества, из них более половины (289×109 т) в бореальном поясе Евразии. Наибольшие количества торфа приурочены к зонам средней и южной тайги.
Почвенный гумус, как правило, сосредоточен в верхнем горизонте почв, но мощность этого горизонта, количество и состав гумуса в разных типах почв сильно различаются. О количестве водорастворимых фульвокислот, образующихся при разложении лесных подстилок разного типа почв, свидетельствует вынос элементов с лизиметрическими водами. Из 1 м2 подстилки, залегающей на подзолистой почве под ельником, на протяжении года выносится от 2600 до 4140 мг Сорг и от 50 до 84 мг оксида железа, связанного с растворимым органическим веществом. Из подстилки под дубовым лесом на черноземе выносится растворимого органического вещества на два порядка меньше – от 50 до 80 мг/м2 в год Сорг, а связанного с органическим веществом железа всего от 3 до 10 мг/м2 в год. Очевидно, что микроорганизмы подзолистой почвы при переработке подстилки активно продуцируют фуль-вокислоты, а микроорганизмы чернозема способствуют образованию водонерастворимых гелей гуминовых кислот и гуматов кальция. Согласно расчетам Г.М. Варшал с годовым речным стоком с суши выносится около 200×106 т в год фульвокислот. Содержание гумуса в лесных почвах меняется в зависимости от биоклиматических условий от 2–3 до 5–6%. Высокое содержание гумуса связано с травянистой растительностью. Наибольшее количество гумуса находится в черноземах, образованных под разнотравно-луговой растительностью, – от 6 до 12% (в некоторых случаях до 20%).
С учетом данных К.И. Кобак (1988), Д.С. Орлова и О.Н. Бирюковой (1995, 2001), М.А. Глазовской (1997) можно считать, что масса органического углерода в педосфере (включая углерод залежей торфа, лесных подстилок и устойчивых органоминеральных образований в нижней части профиля почв), по-видимому, близка к 2,5×1012 т. Это более чем в два раза превышает массу углерода существующей растительности суши.
Углубленное изучение органического вещества почв позволило обнаружить новые факты о динамике образования гумуса и устойчивости составляющих его компонентов. Это существенно дополнило представления о формировании современных почв в голоцене на протяжении последних 10 – 12 тыс. лет.
Как отмечено выше, отмирающие органы растений, поступая в почву, подвергаются интенсивной деструкции. Одновременно происходит образование специфических органических соединений. Вследствие этого состав почвенного органического вещества весьма разнороден и его компоненты обладают неодинаковой устойчивостью и, следовательно, неодинаковой длительностью существования («временем жизни»). Наиболее быстро разрушаются низкомолекулярные органические кислоты, аминокислоты, белки, жиры, моно- и дисахариды. Медленнее осуществляется микробиологическое разложение полисахаридов, целлюлозы и особенно лигнина. Специфические почвенные органические соединения – гуминовые кислоты и особенно гумин устойчивы к микробиологическому воздействию, что, по мнению Д.С. Орлова (1990), обусловлено особенностями их структуры, выдерживающей воздействие ферментов.
Количественное соотношение перечисленных компонентов таково, что более половины массы ежегодно отмирающего и поступающего в почву растительного материала быстро разлагается, и слагающие его химические элементы вовлекаются в биологический круговорот, водную миграцию. По этой причине напочвенная мортмасса значительно меньше массы отмирающих в течение года растительных органов. Процесс микробиологического разложения растительных остатков продолжает интенсивно развиваться в почве, причем, по данным О.Н. Бирюковой и Д.С. Орлова (1998), на образование специфических почвенных органических соединений расходуется всего лишь от 0,6 до 4,8% массы углерода, поступившей в почву с опадом, а остальная часть углерода трансформируется в углекислый газ.
Гумусовые вещества в зависимости от строения ведут себя неодинаково. Слабо сконденсированные соединения группы фульвокислот, во-первых, растворяются, частично выносятся из почвы и далее мигрируют с водным стоком. Во-вторых, эти соединения, оставаясь в почве, постепенно гидролизуются. Соединения, в которых сконденсированное «ядро» сильно преобладает над боковыми цепями, обладают большой устойчивостью. По этой причине доля высокополимеризованных соединений в составе гумуса возрастает в нижней части профиля почв, общее содержание гумуса при этом заметно сокращается.
Применение метода определения абсолютного возраста устойчивых соединений гумуса по содержанию радиоактивного изотопа 14С открыло новые возможности. Многолетние исследования О.А. Чичаговой абсолютного возраста гуминовых кислот черноземов показали, что возраст этих соединений увеличивается вниз по профилю от 500–1000 лет в горизонте 0–20 см до 5000–6000 и даже 7000 лет. В дальнейшем аналогичная тенденция была обнаружена в почвах других типов. На основании этого был сделан вывод о том, что скорость обновления основной части всей массы гумуса (или углерода гумуса) в верхней и нижней частях почвенного профиля различна. По мере получения новых данных выяснилось, что указанное различие для разных типов почв неодинаково. Согласно модели, разработанной А.Е. Черкинским и В.А. Бровкиным (1984), в почвах гумидных ландшафтов умеренного пояса (дерново-подзолистых, подзолистых) скорость обновления гумуса верхней и нижней частей профиля будет различаться в 20–30 раз, в почвах аридных ландшафтов (черноземах и каштановых почвах) – в 2–3 раза, в почвах южной периферии лесной зоны (серых лесных) – в 3–10 раз.
Таким образом, в нижней части почвенного профиля происходит накопление весьма устойчивых органических соединений, которые сохраняются, в то время как преобладающая часть органического вещества почв минерализуется до СО2. М.А. Глазовская (1997) исследовала статистическую зависимость между массами углерода, содержащимися в слое почв 0–100 см, где находится преобладающая часть гумуса, и в слое 100 – 200 см, где присутствуют только его устойчивые компоненты, и установила, что эта связь имеет линейный характер и описывается уравнением регрессии:
у = 1,844x + 2,601; r2 = 0,7726; r = 0,88.
Одновременно с процессом образования органического вещества почвы из отмирающих органов растений происходит закономерная перегруппировка химических элементов, аккумулированных растениями. Сопоставляя состав зеленых, вегетирующих и периодически отмирающих органов деревьев (хвои и листьев) с составом лесной подстилки, можно заметить увеличение относительного содержания одних элементов и уменьшение других.
Данные табл. 5.2 позволяют предположить, что химические элементы, содержащиеся в наименее устойчивых тканях растений, быстро удаляются из вещества лесных подстилок.
Таблица 2. Содержание химических элементов в опадающих органах растений и подстилке
| Растение и район | Объект анализа | Химический элемент | Сумма | |||||||||
| К | Mg | Na | Р | S | Са | Мn | Si | А1 | Fe | |||
| Eriophorum vaginatum, тундра, Якутия (Саха) | I II III | 0,32 0,10 0,12 | 0,14 0,14 0,16 | 0,07 0,10 0,10 | 0,15 0,12 0,20 | __ – | 0,19 0,26 0,91 | 0,02 0,06 0,20 | 0,25 0,35 0,85 | 0,12 0,19 0,49 | 0,03 0,11 0,26 | 1,29 1,39 3,29 |
| Pinus silvestris, тайга, Кольский п-в | I II III | 0,27 0,11 0,27 | 0,08 0,09 0,16 | 0,02 0,02 0,04 | 0,04 0,04 0,05 | 0,03 0,04 0,06 | 0,34 0,54 1,10 | 0,08 0,09 0,09 | 0,04 0,07 0,88 | 0,05 0,03 0,82 | 0,01 0,03 0,62 | 0,96 1,06 4,09 |
| Picea excelsa, тайга, Кольский п-в | 1 11 III | 0,52 0,93 0,44 | 0,38 0,02 0,14 | 0,03 0,02 0,03 | 0,07 0,05 0,04 | 0,07 0,08 0,08 | 0,52 0,93 0,41 | 0,07 0,08 0,08 | 0,31 0,67 0,44 | 0,13 0,09 0,27 | 0,01 0,01 0,14 | 0,84 0,60 1,15 |
| Quercus robur, лиственный лес, Среднерусская возвышенность | I II III | 1,07 0,45 0,14 | 0,12 0,22 0,14 | – – | 0,10 0,17 0,13 | – – | 1,16 1,64 1,41 | 0,03 – | 0,43 0,45 0,57 | 0,03 0,03 0,37 | 0,02 0,04 0,18 | 3,16 3,00 2,94 |
| Parrotia persica, субтропический лес, Ленкорань | I II | 0,70 0,20 | 0,23 0,21 | 0,07 следы | 0,12 0,11 | 0,01 0,03 | 0,96 1,23 | 0,01 0,01 | 0,97 1,09 | 0,04 0,07 | 0,01 0,04 | 2,15 3,04 |
Примечание. Объекты анализа: I – листья или хвоя; II – спад; III – подстилка.
К таким элементам относятся калий, магний, натрий, фосфор, сера, частично кальций. Содержание других элементов, входящих в более устойчивые ткани, возрастает в подстилках. Это характерно для металлов кремния и других элементов. В некоторых растениях кремния так много, что он образует фитолитарии – мелкие выделения аморфного оксида кремния (опала), которые также сохраняются в подстилках. Кроме того, многие рассеянные элементы активно сорбируются подстилками благодаря огромной поверхности в единице объема полуразложившегося растительного опада.
Наиболее полные сведения о содержании тяжелых металлов и других рассеянных элементов относятся к органическому веществу торфа. Торф состоит из не полностью (на 20–30%) разложившихся остатков болотных растений. По сравнению с органическим веществом растительности суши в торфе больше устойчивых компонентов (лигнина, битумов).
Существует два типа биогеохимических обстановок торфона-копления. Первая из них характеризуется избыточным увлажнением почв за счет атмосферных осадков, их слабого испарения и затрудненного дренажа на плоских водоразделах. В такой обстановке образуются так называемые верховые болота, в которых основными растениями-торфообразователями являются сфагновые мхи. Воды верховых болот, образованные из атмосферных осадков, имеют низкую минерализацию (30–70 мг/л). Содержание минеральных веществ в сфагновых мхах небольшое, зольность торфа около 3%. Они обогащены кислыми метаболитами сфагновых мхов и водорастворимыми гумусовыми кислотами, их рН 3,5–4,5. В таких условиях скорость накопления торфа близка к 1 мм/год.
Развитие сфагновой растительности поддерживается за счет элементов, освободившихся из частично разложившихся отмерших растений и поступивших с атмосферными осадками. Экосистемы верховых болот обладают высокой степенью геохимической автономности. Происходящие в них биогеохимические циклы массообмена очень слабо связаны с окружающими ландшафтами и открыты лишь для атмосферных миграционных потоков химических элементов. По этой причине зольность торфа верховых болот ниже средней зольности растительности Мировой суши и равна 2,8.
Геохимическая ситуация верховых болот своеобразна. Количество водорастворимых органических веществ в водах верховых торфяников колеблется от 20 до 50 мг/л, фульвокислоты составляют 55%, гуминовые – 10–20% от растворенного органического вещества. Обилие водорастворимых гумусовых соединений способствует образованию комплексных и внутрикомплексных соединений металлов, способных к активной водной миграции. В то же время миграция затруднена плохим дренажем, а торф обладает весьма высокой сорбционной способностью по отношению к металлам и другим рассеянным элементам. Результаты изучения концентрации тяжелых металлов в торфе верховых болот России приведены в табл. 3.
Таблица 3. Средняя концентрация тяжелых металлов в торфе верховых болот, мкг/г
Категории:
Подобное:
Copyright © https://referat-web.com/. All Rights Reserved |
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

