Одноклеточные альтруисты
А.В.Гордеева, Ю.А.Лабас
Альтруизм (от лат. аlter - другой) - нравственный принцип, заключающийся в бескорыстном служении другим людям, в готовности жертвовать для их блага личными интересами. Такое определение альтруизма дал французский философ Огюст Конт. “Vivre pour altrui” (жить для другого) имеет русский аналог: “Сам погибай, а товарища выручай”.
Альтруистическое поведение присуще не только людям, но и высшим животным. Обычно животные проявляют альтруизм, предупреждая собратьев об опасности. Особь, подавшая сигнал к бегству, часто привлекает к себе внимание хищника и становится его жертвой.
Оказалось, что альтруисты встречаются на всех уровнях организации живой материи, начиная с клеточного. Ради блага организма гибнут не только отдельные клетки, но и целые органы. Этот процесс мы видим всякий раз, когда наблюдаем превращение головастиков в лягушат, ловим ящериц или гуляем по осеннему лесу. Альтруизм свойствен, например, клеткам яблочной плодоножки. Ведь если бы все яблоки оставались на ветвях, как бы они размножались? Запрограммированная смерть клеток получила название “апоптоз”, что в переводе с греческого означает “листопад”.
В последние годы выяснилось, что совершают самоубийство и одноклеточные организмы. Каковы у них механизмы и назначение этого процесса? Как клетки “научились” организованно погибать “по команде” и по какой именно? Этим вопросам и посвящена наша статья. Но вначале рассмотрим, зачем, почему и каким образом совершают самоубийства клетки многоклеточных.
Зачем и почему
Для чего многоклеточному организму может понадобиться гибель отдельных его клеток? Примеры ее использования во благо целого организма мы уже приводили, когда говорили об осенних листьях и яблоках, о хвостах головастиков и ящериц. Белые кровяные клетки - макрофаги - заглатывают болезнетворных бактерий и, совершая самоубийство, убивают их вместе с собой. Образование пальцев у эмбриона происходит оттого лишь, что гибнут клетки в межпальцевых перегородках. Когда клетки соединительной ткани начинают превращаться в раковые, здоровые соседние клетки принудительно отправляют их в апоптоз.
Разумеется, не всегда запрограммированная смерть клеток приносит явную пользу. В отдельных случаях, таких как массовая гибель еще не сформировавшихся яйцеклеток в яичниках эмбрионов, ее назначение непонятно. Апоптоз клеток головного мозга при болезни Альцгеймера (старческом слабоумии) причиняет явный вред организму. Но в подавляющем большинстве случаев апоптоз ответствен за формообразовательные процессы, за избавление от клеток с измененным генетическим материалом или зараженных. Следовательно, для нормальной жизнедеятельности он действительно необходим.
Как отличить клетку-самоубийцу? Такие клетки отделяются от внеклеточного матрикса, их мембраны сморщиваются, ядра сжимаются, молекулы ДНК рвутся на мелкие кусочки и в итоге образуются так называемые апоптозные тельца - мембранные пузырьки с клеточным содержимым. Принимая роковое решение, клетка заблаговременно сама готовит себя к погребению: вызывает “ритуальных агентов”, роль которых исполняют макрофаги или соседние клетки. Один из липидов внутреннего слоя клеточной мембраны, фосфатидилсерин, переходит во внешний слой. Макрофаги постоянно выделяют особый гликопротеин MFG-E8 (milk fat globule-EGF-factor 8 - фактор роста эпидермальных клеток-8 из жировых глобул молока), который специфически связывается с фосфатидилсерином на поверхности клеток, впадающих в апоптоз. Образующиеся комплексы фосфатидилсерина с MFG-E8 и служат теми метками, по которым узнают будущих самоубийц. Макрофаги сбегаются к таким клеткам и быстро поглощают образовавшиеся апоптозные тельца.
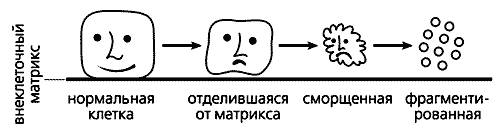
Схема, иллюстрирующая морфологические изменения клетки при апоптозе.
Есть и другой вид запрограммированной смерти, еще недавно не считавшийся таковым, - некроз. При некрозе клетка не съеживается, а, напротив, набухает; то же происходит и со всеми ее органеллами. Это приводит к нарушению целостности всех мембранных структур, в первую очередь лизосом, и, как следствие, к автолизу. Содержимое клетки вместе с активными протеолитическими ферментами изливается в межклеточное пространство, повреждая все вокруг себя. Этот процесс сопровождает воспалительные заболевания, ожоговую болезнь и т.д., иначе говоря, все случаи, когда гибельные стимулы слишком сильны для того, чтобы клетка успела достойным образом подготовиться к смерти. Такой способ самоубийства вряд ли можно считать альтруистическим, поэтому мы не будем на нем останавливаться.
Почему же клетка решает умереть? По приведенным примерам можно судить о причинах, побуждающих клетку к суициду. Убивают себя либо уже больные клетки, либо те, гибель которых в данном месте в данное время выгодна организму. Если больная клетка “не хочет” сама совершать самоубийство, ее могут побудить к этому соседи.
Не счесть орудий самоубийства
Клетка узнает, что должна покончить собой, получив “извещение о предстоящей смерти”. Роль таких извещений выполняют специальные сигнальные белки, в число которых входит и фактор некроза опухолей, выделяемый макрофагами. Приемниками сигнальных молекул служат рецепторные белки, расположенные на поверхности клеток и называемые “рецепторами смерти”. Действие этих сигналов опосредовано особыми протеолитическими ферментами (каспазами) и адаптерными белками, которые помогают им связаться с рецепторным комплексом.
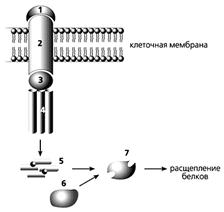
Рецепторный путь апоптоза.
Сигнальная молекула (1) связывается с “рецептором смерти” (2) и далее через адаптерный белок (3) - с прокаспазой-8 (4), после чего она превращается в активный фермент каспазу-8 (5). Она активирует в свою очередь прокаспазу-3 (6), которая, став действующим ферментом (7), расщепляет клеточные белки, и клетка погибает.
У млекопитающих семейство каспаз состоит из 14 постоянно синтезируемых белков. Неактивная каспаза, или прокаспаза, построена из четырех частей: N-концевого домена, большой и малой субъединиц и короткой связующей области между ними. Чтобы прокаспаза превратилась в активный фермент, связующая область и N-концевой домен отщепляются, и образуется гетеродимер из большой и малой субъединиц. Из двух таких димеров и формируется активная каспаза. При апоптозе сначала активируются инициаторные каспазы (-2, -8, -9, -10, -12), а затем, с их помощью, эффекторные (-3, -6, -7). Эти последние расщепляют опорно-двигательные структуры клетки, подавляют биосинтез белков и приводят в действие эндонуклеазу - фермент, расщепляющий ДНК. Остальные каспазы (-1, -4, -5, -11, -13, -14) принимают участие в развитии воспалительных процессов, а также, наряду с эффекторными каспазами, в формировании эпителиальных клеток хрусталика, кератиноцитов (клеток верхнего слоя кожи) и т.д.
После того как сигнальная молекула связалась с “рецептором смерти”, с помощью адаптерного белка к ним присоединяется прокаспаза-8. Став в результате этого работающим ферментом, она активирует прокаспазу-3, стоящую на пересечении двух путей запуска апоптоза - рецепторного и митохондриального. Роль каспазы-3 - расщепление опорных клеточных структур.
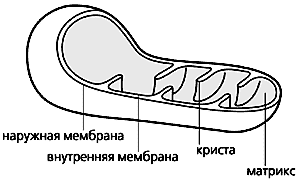
Схема строения митохондрии.
Митохондрии, эти клеточные органеллы с двойной мембраной, обладают, как известно, собственным геномом и способны автономно размножаться. Внутренняя мембрана образует глубокие складки - кристы. В ограниченном ею пространстве, митохондриальном матриксе, находятся ферменты энергетического метаболизма. Митохондрии обеспечивают всю клеточную жизнь, поскольку служат энергетическими станциями: здесь энергия питательных субстратов запасается в доступной для клетки форме, в виде аденозинтрифосфата (АТФ). Он синтезируется за счет энергии, высвобождающейся при переносе электронов с атомов водорода, образовавшихся при переработке субстратов, на конечный акцептор - кислород. Белки, переносящие электроны, встроены во внутреннюю мембрану митохондрий и образуют электронтранспортную цепь (ЭТЦ). Ее конечный элемент - цитохром с-оксидаза - и передает электроны от цитохрома с на кислород (это клеточное дыхание).
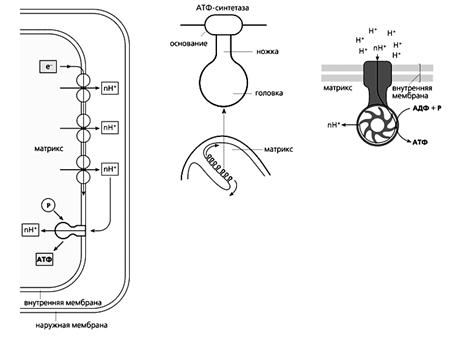
Схема окислительного фосфорилирования (слева), в ходе которого синтезируется АТФ. Высокоэнергетические электроны проходят по переносящей их цепи, и часть высвобождаемой при этом энергии используется для откачивания протонов из матрикса. На внутренней мембране возникает электрохимический протонный градиент, благодаря чему Н+ снова возвращаются в матрикс через АТФ-синтетазу. Этот фермент использует энергию протонного тока для синтеза АТФ из АДФ и неорганического фосфата (P). На рисунке приведены также схема строения АТФ-синтетазы (в середине) и модель действия этого фермента.
Протоны, оставшиеся после отрыва электронов от атомов водорода, за счет энергии электронного транспорта выталкиваются из матрикса в межмембранное пространство. Возникающая при этом разность концентраций (градиент) ионов Н+ создает мембранный потенциал митохондрий (Dym), энергия которого и используется для фосфорилирования аденозиндифосфата (АДФ).
Фермент АТФ-синтетаза, катализирующий образование АТФ из АДФ и неорганического фосфата, представляет собой встроенное во внутреннюю мембрану грибовидное тельце с каналом в центре. Когда ион Н+ прорывается по этому каналу в матрикс, энергия протонного тока идет на синтез АТФ. Других путей возвращения в матрикс у протона нет, поскольку в нормальном состоянии внутренняя мембрана непроницаема для ионов. Процесс синтеза АТФ за счет энергии переноса электронов называется окислительным фосфорилированием.
В матриксе протоны соединяются с кислородом, восстановленным в ходе работы электронтранспортной цепи, и образуется вода. Но если он восстанавливается не полностью, появляются активные формы кислорода (АФК): супероксидный радикал (О2·–), перекись водорода (Н2О2) и гидроксильный радикал (ОН·). В митохондриях образование АФК, этого побочного продукта, усиливается при повышении скорости потока электронов, увеличении концентрации кислорода и разобщении дыхания и окислительного фосфорилирования веществами, которые вызывают проницаемость внутренней мембраны.
Органеллы, обеспечивающие жизнедеятельность клетки, обеспечивают и ее смерть. При сильном стрессовом воздействии (переохлаждении; нагревании; стимуляции образования АФК другими структурами клетки, помимо митохондрий; перекисном окислении липидов плазматической мембраны - чаще всего при облучении) в цитоплазме резко повышается концентрация ионов кальция. Если кальциевые депо клетки не справляются с его утилизацией, открывается так называемая митохондриальная пора диаметром 2.6-2.9 нм. Она представляет собой канал, проходящий через обе митохондриальные мембраны и состоящий из трех белков: транслокатора адениновых нуклеотидов, потенциалзависимого анионного канала (порина) и бензодиазепинового рецептора. Когда этот комплекс связывается с Са2+, через мембранную пору могут проходить вещества с небольшой молекулярной массой. Это приводит к падению мембранного потенциала и набуханию матрикса, целостность внешней мембраны неизбежно нарушается, и из межмембранного пространства в цитоплазму выходят белки апоптоза. Их несколько: фактор, индуцирующий апоптоз (APOptosis-inducing factor - AIF), вторичный митохондриальный активатор каспаз (second mitochondria-derived activator of caspases - Smac) и некоторые прокаспазы. Индуцирующий фактор направляется прямо в ядро, где вызывает деградацию ДНК.
Наряду со специфически апоптозными белками, из митохондрии через открытую пору выходит цитохром с, который в норме служит конечным звеном электронтранспортной цепи. В цитоплазме этот белок связывается с белком Apaf-1 (APOptotic protease activating factor-1 - активирующий протеазу фактор-1) и формирует апоптосомный комплекс. Он с помощью Smac и еще одного фактора (Omi/HtrA2) активирует прокаспазу-9, та, став каспазой-9, превращает два других профермента в каспазы-3 и -7; а они уже расщепляют структурные белки, приводя к появлению биохимических и морфологических признаков апоптоза. В числе первых можно назвать, в частности, переход фосфатидилсерина в наружный мембранный слой и фрагментацию ДНК. Из вторых признаков наиболее характерны “отшелушивание” клетки от матрикса, сморщивание мембраны, сжатие ядра и формирование пузырьков с клеточным содержимым - апоптозных телец.
Цитохром с электростатически и гидрофобно связан с внутренней мембраной митохондрий через фосфолипиды, преимущественно через кардиолипин. Электростатически взаимодействуют между собой положительно заряженные остатки аминокислоты лизина в цитохроме и отрицательно заряженные фосфатные группы в кардиолипине. За счет гидрофобного взаимодействия между углеродной цепью этого фосфолипида и гидрофобными участками молекулы цитохрома еще более укрепляется связь фермента с митохондриальной мембраной, что обеспечивает даже его частичное погружение в ее слой.
Следовательно, для выхода цитохрома с в цитоплазму одного лишь нарушения целостности митохондриальной мембраны недостаточно. Электростатически связанный цитохром с может оторваться от кардиолипина, если изменяется ионная сила, плотность поверхностного заряда или рН, а связанный гидрофобно - за счет окислительной модификации митохондриальных липидов. Последнюю реакцию как раз и вызывают активные формы кислорода, которые неизбежно образуются при любых сильных воздействиях (стрессах), а открывание поры усиливает этот процесс.
Однако цитохром с не всегда нужен для запрограммированной смерти. Апоптоз в сердечной ткани, например, вообще протекает без этого фермента, он так и не выходит из межмембранного пространства.
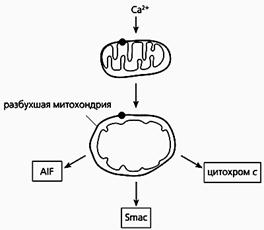
Фрагмент схемы апоптоза, протекающего по митохондриальному пути.
Под действием избытка ионов кальция митохондрия разбухает, через пору из нее выходит цитохром с и два белка - AIF и Smac. Первый белок индуцирует апоптоз, а второй активирует некоторые прокаспазы.
Цитохром с может высвобождаться в ответ на повышение концентрации ионов Са2+, которое вызывает открывание поры. Но выход фермента “на свободу” может и не зависеть от этих ионов, тогда процесс контролируют белки семейства Bcl-2 (B-cell leukaemia-2 - лейкемия В-клеток-2). Именно они регулируют апоптоз на уровне митохондрий. Одни из белков этого большого семейства (Bcl-2, а также Bcl-xL, Bcl-w, Mcl-1, Al и Boo) предотвращают апоптоз; другие (Вах, Bad, Bok, Bcl-xS, Bak, Bid, Bik, Bim, Krk, и Mtd) способствуют самоубийству. Вот один пример работы белков этого семейства регуляторов. Цитозольный белок Bid расщепляется каспазой-8, активируемой через “рецепторы смерти”, и лизосомными протеазами катепсинами, чей выход из лизосом стимулирует эта же каспаза. Образовавшийся активный белок - усеченный Bid (truncated Bid - t-Bid) - изменяет конформацию другого проапоптозного белка, Вах, после чего тот встраивается во внешнюю мембрану митохондрий, где формирует комплекс с порином. Вместе они выстилают канал, по которому из межмембранного пространства выходят цитохром с и проапоптозные белки. Но если в дело вмешивается Bcl-2, действующий как антиоксидант, выход цитохрома блокируется.
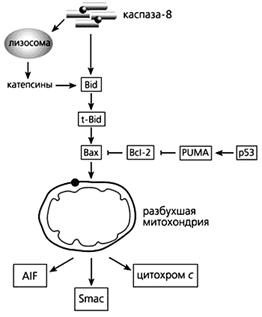
Фрагмент схемы апоптоза, протекающего под контролем белков семейства Bcl-2, а также с участием p53.
Объяснения в тексте.
В запуске апоптоза, вызванного повреждениями ДНК, активацией онкогенов и гипоксией, принимает участие белок-53 (р53), взаимодействуя с Вах, стимулируя “рецепторы смерти” и апоптозные гены. р53 активирует модулятор суицида PUMA (p53 upregulated modulator of APOptosis), который затем связывает Bcl-2 и выводит из строя этот препятствующий апоптозу белок. Тем самым выход цитохрома с из митохондрий уже ничем не сдерживается.
Некоторые белки, связывающие ионы кальция, например ALG-2, кодируемый одноименным геном (APOptosis-linked gene-2), тоже принимают участие в запрограммированной смерти. Так, взаимодействием ALG-2 и белка Alix (ALG-interacting protein X, известный и как AIP1) осуществляется регуляция апоптоза. Часть сложной молекулы ALG-2 представляет собой еще один апоптозный белок кальпоин.
Кальпоины специфически расщепляют белки, содержащие области, называемые PAST-мотивами и богатые остатками четырех аминокислот - пролина (P), аспарагиновой кислоты (A), серина (S) и треонина (T). (Среди этих белков - фермент ДНК-лигаза, у которого такой мотив находится в N-концевой области.) Кроме того, кальпоины освобождают каспазы от связанных с ними ингибиторов апоптозных белков (inhibitors of APOptosis proteins, IAPs).
Впервые обнаруженные у вирусов, гомологи IAP позже были найдены у всех эукариот, от дрожжей до млекопитающих. У последних открыто восемь представителей этого семейства ингибиторов, и каждый имеет от одного до трех 70-аминокислотных участков, называемых BIR-доменами (baculoviruses inhibitor of APOptosis repeat domains - повторяющиеся домены бакуловирусного ингибитора апоптоза). Кодируемый Х-хромосомой IAP (XIAP) и клеточные ингибиторы апоптозных белков (cellular inhibitors of APOptosis protein; cIAP1, 2) содержат по три N-концевых BIR-домена и С-концевой RING-домен, кодируемый геном ring (really interesting new gene - действительно интересный новый ген). Эти белки ингибируют каспазы-3, -7, -9: BIR-домены целенаправленно связываются с ними, блокируя их активные центры; RING-домен обеспечивает деградацию каспаз, пришивая к ним “черную метку” - 76-аминокислотный белок убиквитин. Присоединившие его белки подвергаются расщеплению протеасомой *.
* Об этом специфическом пути деградации белков см.: Абрамова Е.Б., Карпов В.Л. Протеасома: разрушение во имя созидания // Природа. 2003. №7. С.36-45.
Есть и другой эндогенный ингибитор каспаз - FLIP (FLICE-inhibitory protein). Он взаимодействует с пособниками суицида - сигнальными комплексами, блокируя активацию прокаспазы-8 и передачу проапоптического сигнала от “рецепторов смерти”.
Как все ингибиторы протеаз, XIAP, cIAP1 и cIAP2 сами подвержены отрицательной регуляции. В частности, митохондриальный полипептид Smac/DIABLO (direct IAP-binding protein with low pI - белок с низкой pI, прямо связывающий IAP), выходя из митохондрий в цитозоль, связывается с ингибиторами XIAP, cIAP1 и cIAP2 и мешает им взаимодействовать с каспазами. Но XIAP, cIAP1 и 2 способны противостоять ингибирующему действию Smac/DIABLO, присоединяя к нему убиквитин - сигнал для деградации. Одна из изоформ Smac/DIABLO, Smac3, сама стимулирует присоединение убиквитина к XIAP. В высоких концентрациях каспазы-3 и -7 могут расщеплять XIAP и без посредников.
Как видим, клетка никогда не бросается в апоптоз без “раздумий”. Она сначала задает себе гамлетовский вопрос: “Быть или не быть?”. Ответ на него зависит от соотношения про- и антиапоптозных белков; между ними идет борьба, и побеждает та сторона, которая успевает навесить на другую “черную метку” - убиквитин. А протеазам совершенно все равно, на ком эта метка - они беспристрастно расщепляют меченые белки. Таким образом, выбор клетки между жизнью и смертью зависит не столько от внешних обстоятельств, сколько от ее собственного внутреннего состояния. Даже если организм приказывает клетке погибнуть, она подчиняется ему только в том случае, когда сама расположена к такому исходу. Бывают мутанты, которые категорически не хотят умирать, при том что все внешние обстоятельства побуждают их к суициду - как правило, это раковые клетки.
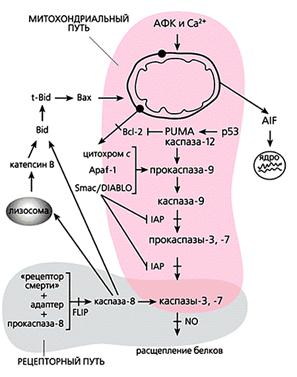
Общая схема “классического” апоптоза млекопитающих.
Мы перечислили все виды орудий самоубийства, которыми клетка многоклеточного организма пользуется, когда он приказывает и когда она сама того хочет. Но следует понимать, что их действие неоднозначно. Например, кальций и активные формы кислорода участвуют во всех без исключения процессах жизнедеятельности как вторичные посредники в передаче сигналов и регулируют все функции клетки: размножение, дыхание, обмен веществ, движение, рост. Тот же кальций способен, в частности, активировать антиоксидантные ферменты, защищающие клетку от окислительного стресса. АФК в микромолярных концентрациях необходимы для пролиферации клеток, их подвижности и хеморецепции; более того, некоторые виды (например, NO) даже блокируют апоптоз посредством избирательного нитрозилирования эффекторных каспаз. Да и каспазы тоже могут выполнять вполне “мирные” функции - управлять дифференцировкой некоторых типов клеток.
Таким образом, лишь немногие из орудий самоубийства служат только этой цели: большинством из них клетка пользуется и в “домашнем быту”. Возникает вопрос: а все ли они необходимы для совершения суицида? И если нет, то зачем производить столь непомерный арсенал орудий? На эти вопросы мы сможем ответить, когда рассмотрим специфику протекания запрограммированной смерти у одноклеточных организмов.
Суицид у одноклеточных
Практически у всех простейших организмов внешние признаки апоптоза те же самые, что у клеток многоклеточных, и, как у них, к гибели приводят разные причины. У одноклеточных водорослей ее вызывает отсутствие света или окислительный стресс, а предотвращают ингибиторы каспаз и антиоксидантный фермент, расщепляющий Н2О2, - каталаза (каспазы у них тоже выявлены - с помощью антител). Паразитические жгутиконосцы кончают жизнь самоубийством, если им помогают ингибитор протеинкиназы С ставроспорин (он же стимулирует апоптоз и в клетках млекопитающих) и перекись водорода, а предотвращают тоже ингибиторы каспаз. Экстракт цитоплазмы паразитического простейшего Leishmania major в опытах вызывал характерные для апоптоза изменения в изолированных ядрах млекопитающих, свидетельствуя о присутствии в нем AIF-подобных белков. Изолированные митохондрии L.major теряли цитохром c при инкубации с рекомбинантным Вах человека даже тогда, когда Вах был лишен трансмембранного домена, необходимого для встраивания в наружные мембраны митохондрий. Следовательно, у L.major есть белки, способные взаимодействовать с Вах.
У дрожжей найдены практически все орудия суицида, имеющиеся у многоклеточных, кроме лизосомальных катепсинов и представителей семейства Bcl-2. Тем не менее, гены проапоптозных белков млекопитающих при экспрессии в дрожжах вызывают их запрограммированную гибель, а Bcl-2 защищает пекарские дрожжи (Saccharomyces сerevisiae) от гибели, вызванной окислительным стрессом. У Shizosaccharomyces pombe найден Rad9-белок, содержащий последовательность аминокислот, необходимую для взаимодействия с Bcl-2.
К апоптозу дрожжей приводят вещества, которые они сами же и продуцируют: например, уксусная кислота (продукт брожения), перекись водорода или a-фактор - пептидный половой феромон, вырабатываемый a-типом гаплоидных клеток S.сerevisiae. При концентрации <1 мкМ этот феромон стимулирует конъюгацию клеток противоположного типа спаривания с дрожжами a-типа, а при более высокой - вызывает блокаду клеточного цикла и апоптоз. Мутация активируемой феромоном протеинкиназы предотвращает и смерть, и появление ее маркеров.
Слизистые грибы (миксомицеты) - уникальные организмы, проходящие в своем развитии одно- и многоклеточную стадии. Когда в почве достаточно питательных веществ, миксомицеты существуют в виде отдельных амебообразных клеток - миксамеб. Во время голодания они сползаются и образуют одно большое клеточное скопление - плазмодий. Некоторое время он ползает по субстрату, а потом останавливается и начинает формировать плодовое тело. Часть его клеток при этом превращается в споры, а часть - в стебельковые клетки, выполняющие опорную функцию. Именно они подвергаются запрограммированной гибели, в целом похожей на классический апоптоз, но сопровождающейся интенсивным появлением вакуолей. Интересно, что ДНК стебельковых клеток не распадается на фрагменты. Ингибиторы каспаз не препятствуют гибели клеток, но нарушают нормальное развитие плодовых тел. У амеб Dictyostelium discoideum найдены гомологи четырех белков, участвующих в запрограммированной смерти клеток многоклеточных организмов: AIF, Alix и два ALG-2. Примечательно, что гены обоих гомологов ALG-2 экспрессируются в растущих миксамебах. Мутанты, лишенные одного или обоих этих генов, формируют нормальные плодовые тела, однако мутанты по гену alix имеют ярко выраженные дефекты развития.
У инфузорий есть все виды орудий самоубийства (в том числе каспазы-8 и -9, но не -3), кроме белков семейства Bcl-2 (пока их просто не искали). Инфузория Paramecium tetraurelia синтезирует катепсины L и S. У Tetrahymena pyriformis, штамма W, найден катепсин В.
Таким образом, как мы видим на примере самых примитивных простейших, для запуска апоптоза в принципе достаточно двух компонентов: активной формы кислорода и хотя бы одной цистеиновой протеазы, т.е. каспазы. В этой связи отметим, что инициаторные каспазы в ходе эволюции возникают раньше, чем эффекторные; последние не найдены ни у кого из простейших. У большинства эукариот ведущая роль в стимуляции апоптоза принадлежит митохондриальным факторам - цитохрому с и AIF. Тем не менее, не имеющий митохондрий паразит мочеполовой системы человека Trichomonas vaginalis каким-то образом обходится без обоих факторов. Отсутствие гомологов ALG-2 у слизистых грибов не нарушает образования плодовых тел, из чего следует, что и эти белки необязательны для апоптозного процесса. Следовательно, большинство белков, принимающих участие в запрограммированной смерти, предназначено для более тщательной ее регуляции. А тщательность вряд ли была бы возможна при малом количестве звеньев.
* * *
Биологический смысл существования сразу нескольких систем запуска апоптоза, по-видимому, в том, чтобы его могли независимо друг от друга побуждать стимулы разного рода: повреждение генома, стрессовые воздействия, необходимость для организма в целом и т.д. Примитивным одноклеточным организмам просто не нужна столь многокомпонентная система стимуляции апоптоза, они гибнут только при стрессовых воздействиях, потенциально опасных для генома и, следовательно, для популяции в целом. Многоклеточному же организму необходимо, чтобы клетки
- были всегда готовы покончить с собой по его приказу там, где это потребуется;
- сами принимали такое решение при возникновении неполадок в собственном геноме или при угрозе их появления.
Для этого и нужно, чтобы апоптоз могли запустить и специальные сигнальные молекулы (через “рецепторы смерти”), и повышение уровней АФК и цитоплазматического кальция (всегда сопровождающее любые стрессы), и повреждение генома.
Функции апоптоза у организмов разных уровней филогенеза, по-видимому, общие. У одноклеточных организмов этот вид гибели служит не только эффективным средством очистки сообщества от мутантных (дефектных) особей, но и обеспечивает процессы морфогенеза - например, при образовании плодовых тел у слизистых грибов. Недостаток в питании вызывает смерть стареющих и поврежденных дрожжевых клеток, чтобы их молодые и здоровые потомки могли жить безбедно. Однако если питательные вещества полностью отсутствуют (как, например, в дождевой воде), альтруизм теряет смысл и апоптоз не включается. У дрожжей запрограммированную смерть стимулируют факторы, которые накапливаются по мере повышения плотности культуры - уксусная кислота, перекись водорода и a-фактор. Вероятно, таким способом поддерживается оптимальная плотность популяции. У инфузорий Tetrahymena thermophila апоптоз, наоборот, наступает при низкой плотности - потому, вероятно, что этим простейшим для нормального существования необходима высокая плотность, облегчающая конъюгацию. У дрожжей смертельный процесс запускается феромоном, т.е. тем же веществом, что и спаривание - видимо, для того, чтобы девственные (т.е. с большой вероятностью ущербные) клетки не отнимали питание у тех, кто здоров и может спариваться. Так что альтруизм - жертвование собой ради ближнего - свойство, присущее даже одноклеточным.
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- От чего зависит судьба гена
В.Л. Карпов, доктор биологических наук, заместитель директора Института молекулярной биологии им.В.А.Энгельгардта РАН.Все клетки любого
- Симбиоз в мире животных
Реферат по экологии подготовила Морозова Наталья10 класс школы №1328В природе каждый живой организм живёт не изолированно. Его окружает м
- Внезапное творческое озарение
- Неправомерность биогенетического закона
- Молекулярная палеонтология и эволюционные представления о возрасте ископаемых останков
- Смысл человекообразия обезьян
Хоменков А. С. В чем причины сходства между людьми и обезьянами?Современное человечество уже похоже свыклось с тем, в чем его столь долго
- Биостратиграфия
Вертьянов С. Ю. Для подтверждения или опровержения гипотезы макроэволюции, как и любой научной концепции, необходимы теоретическая разр
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

