Методы отделения и выделения следов элементов
Методы отделения и выделения следов элементов
Немногие из применяемых в колориметрии реактивов обладают достаточной избирательностью для определения элемента непосредственно в присутствии сопутствующих элементов, когда соотношения между ними и определяемым элементом неблагоприятны, как это имеет место при анализе следов. По возможности элементы, мешающие определению, «нейтрализуют» регулированием рН раствора, добавлением комплексообразующих реагентов, окислением или восстановлением до другого валентного состояния; если же такие средства не помогают, следует прибегнуть к отделению. Даже в тех случаях, когда мешающие элементы отсутствуют, часто необходимо, особенно при определении ничтожно малых количеств вещества, выделить определяемый элемент тем или иным путем так, чтобы получить его в малом объеме раствора.
В процессе разделения, очевидно, важны два фактора: полнота извлечения выделяемого вещества и степень отделения его от других веществ. Степень извлечения для данного процесса выражается отношением
![]()
где
o - количество вещества;
А в образце;
QA – выделенное количество вещества.
При желании извлечение можно выразить в процентах. Извлечение, равное 9096, иногда можно считать достаточным при анализах образцов, в которых содержание определяемого компонента составляет 0,0001–0,001% или даже 0,01%; 95%-ное извлечение обычно считают удовлетворительным, хотя всегда желательна более высокая степень извлечения.
Степень отделения вещества В определяется как величина, на которую нужно помножить первоначальное отношение В к А, чтобы получить конечное отношение:
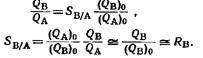
Требуемая степень отделения, конечно, зависит от отношения В к А в в исходной пробе и от допустимого значения Qb/Qa – Если А и В одинаково чувствительны к реагенту, используемому для определения А, то для Qb/Qa допустимо значение от 0,01 до 0,05 в зависимости от требуемой точности. Поскольку отношение o/o может иметь значение 100 000 и более, при анализе следов может потребоваться степень отделения 10~в или даже 10~.
1. Методы осаждения, соосаждения, адсорбции и связанные с ними процессы
Все эти методы имеют общую особенность: раствор пробы подвергается такой обработке, в результате которой образуются две фазы: одна – раствор, содержащий макрокомпоненты пробы, другая – твердая фаза, которая целиком или частично состоит из определяемого вещества. Схему процесса можно представить следующим образом:
![]()
где С – фаза, содержащая макрокомпоненты пробы; с – фаза, содержащая микрокомпонент, который подлежит определению. Процессы, посредством которых можно вызвать представленное выше фазовое изменение, различны. Характерные особенности некоторых из них будут рассмотрены. Классификация процессов, принятая в дальнейшем, по общему признанию, несколько искусственна, однако цель ее состоит в том, чтобы ориентировочно разбить процессы по группам.
а. химическое осаждение и аналогичные процессы
Наиболее простой процесс заключается в осаждении следов определяемого вещества реактивом, который оставляет макрокомпоненты в растворе. Однако осаждение в его простой форме обычно не применимо, когда концентрация определяемого микрокомпонента очень низка. Даже если осадок имеет очень низкую растворимость, его определение может быть связано с трудностями, учитывая, что абсолютное количество осадка мало. Возможны и другие осложнения – образование коллоидальной суспензии или пересыщенного раствора, в котором не происходит выпадения осадка, и т.д. В связи с этим к раствору добавляют небольшое количество другого вещества, образующего с осадителем малорастворимый продукт. Осадок, образовавшийся из добавленного вещества, называют носителем – термином, который весьма точно описывает его функции.
Иногда носитель функционирует более или менее механическим путем. Так, например, когда соль алюминия добавляют к раствору четырехвалентного титана, разбавленному до такой степени, что титан не реагирует даже с тимолом, а затем осаждают алюминий аммиаком, то гидроокись алюминия, выпадая в осадок, увлекает из раствора гидроокись титана, и титан можно определить колориметрически в осадке после его растворения. Этим способом можно определить количество титана порядка 1 у/л.
Носители часто требуются для осаждения сульфидов. Сульфид меди использовали в качестве носителя для молибдена, цинка, свинца, сурьмы и других металлов; сульфид свинца применяли для осаждения меди, сульфид серебра – для осаждения свинца и т.д. Иногда сульфидный носитель функционирует в основном физическим путем, но часто имеет место дополнительный эффект, обусловленный действием процессов, которые называют соосаждением. Например, между носителем и осадком следов вещества могут образоваться смешанные кристаллы. Кроме того, носитель может способствовать осаждению микрокомпонента из его перенасыщенного раствора.
Полнота выделения данного металла путем сульфидного осаждения, естественно, зависит в значительной степени от растворимости его сульфида, особенно если носитель не образует смешанных кристаллов с осаждаемым сульфидом.
Сульфид свинца, который имеет произведение растворимости 3,4–10», нельзя осадить количественно из кислого раствора даже в том случае, если используется такой носитель, как сульфид серебра. Можно вычислить, что ионная растворимость сульфида свинца в 1 н. кислом растворе, насыщенном сероводородом, составляет 3–10 М, что соответствует около 6 мг/л РЬ\ В 0,1 н. растворе кислоты, насыщенном сероводородом, расчетная растворимость Рh равна 0,06 мг/л; это все же довольно большая величина с точки зрения аналитика, определяющего следы веществ. В действительности кажущаяся растворимость может быть больше, чем указывают вычисления, потому что в сульфидной системе металл – водород равновесие устанавливается медленно. Одна из функций носителя состоит в том, чтобы ускорять достижение равновесия. Тем не менее, при осаждении следов сульфидов рекомендуется перед фильтрованием дать постоять раствору в течение ночи; кроме того, кислотность раствора должна быть не выше, чем необходимо для удержания других металлов в растворе.
Другая причина, предостерегающая от переоценки значений растворимостей, вычисленных из произведений растворимости, заключается в том, что определяемый металл может присутствовать в иных, чем простая ионная, формах. Так, например, установлено, что растворимость ртути в 1 М хлорной кислоте, насыщенной сероводородом, благодаря образованию HoHgS, равна 3–10 М. Даже если никакого комплексного сульфида не образуется, несомненно, что в растворе будет присутствовать некоторое количество металла в виде молекулярного сульфида, концентрация которого вполне может превосходить ионную концентрацию, когда последняя очень мала. Применение носителя позволяет преодолеть ограничения, связанные с растворимостью при осаждении ртути. Из 1 л раствора осаждением сероводородом в присутствии меди можно выделить такие количества ртути, как 0,02 у. Иногда слаборастворимые металлоорганические комплексы используют для осаждения следов других металлов, образующих нерастворимые соединения с тем же самым реагентом. Следы циркония, ванадия и титана, встречающиеся в минеральных водах, можно количественно выделить с осадком купферроната железа, образующегося при добавлении купферрона. 8-Оксихинолин также был использован для осаждения следов различных металлов с хинолятами железа или алюминия в качестве носителей.
Иногда при осаждении следов вещества носителем происходит образование соединения. Так, например, гидроокись железа легко осаждает мышьяк и фосфор в виде малорастворимых арсенита, арсената и фосфата железа. Осаждение микроэлемента может быть более полным, чем это следует из растворимости образовавшихся соединений, благодаря тому, например, что происходит сильная адсорбция арсената железа гидроокисью железа. Другой случай образования соединения при осаждении встречается при использовании теллура в качестве носителя для золота, платины и палладия. Эти металлы количественно осаждаются, когда к раствору их солей, содержащему небольшое количество теллурита щелочного металла, добавляют такие восстановители, как сернистую кислоту или хлорид олова. Вероятно, благородные металлы образуют теллуриды при этих условиях и осаждаются в таком виде с восстановленным теллуром. Однако осаждение этих металлов было бы, несомненно, не менее полным, если бы никакого образования соединения не происходило и восстановленные металлы действовали бы просто как кристаллизационные центры для элементарного теллура.
Выбор носителя предопределяется рядом факторов, главным из которых, естественно, является способность носителя осаждать следы вещества достаточно полно. Хорошим носителем считается тот, который при использовании даже в малом количестве полностью захватывает следы определяемого элемента. Ограничение количества носителя часто имеет значение, так как с ним в большей или меньшей степени могут соосаждаться другие вещества, присутствующие в растворе, что приводит к осложнениям при определении искомого вещества. Эффективный носитель можно использовать в минимальных количествах и таким образом уменьшить соосаждение нежелательных компонентов до количества, не представляющего опасности. Предпочтение, конечно, отдается носителю, избирательному в своем действии, но это случай скорее идеальный: в действительности полностью избирательный носитель почти не встречается. В этом отношении удовлетворительны носители, механизм действия которых связан с образованием смешанных кристаллов. Носитель должен быть веществом, которое не мешает конечному определению микрокомпонента. Если это условие не выполнимо, носитель должен быть легколетучим, чтобы его можно было удалить после проведения соосаждения. В этом отношении удобны сульфиды ртути и мышьяка, применяемые для осаждения сульфидов тяжелых металлов; то же самое справедливо для теллура, который используют для выделения благородных металлов.
Если носитель образует смешанные кристаллы с соответствующим соединением микрокомпонента, можно достичь фактически полного осаждения последнего даже в том случае, когда это соединение микрокомпонента само по себе совсем не осаждается из раствора. Процесс настолько важен для выделения следов веществ, что здесь необходимо его кратко рассмотреть.
Образование смешанных кристаллов. Пусть М и N соответственно макро- и микрокомпоненты, образующие малорастворимые смешанные кристаллы X. Рассмотрим раствор М и N, который обрабатывается избытком X.
Если процесс осаждения или кристаллизации протекает так, что микрокомпонент гомогенно распределяется в кристаллической фазе макрокомпонента, т.е. если кристаллическая фаза в целом находится в равновесии с раствором, то в идеальном случае имеет силу следующее соотношение:
![]()
Коэффициент гомогенного распределения D в идеальном случае равен отношению произведений растворимости:
![]()
Чем выше значение D, тем больше доля микрокомпонента N в кристаллической фазе. Это означает, что желательно иметь именно MX более растворимым, чем NX. Однако растворимость MX примерно равнялось 100. Распределение компонентов, описываемое уравнением, соблюдается, если осадок образуется быстро и если затем осадок оставляется в маточном растворе на перекристаллизацию для получения более или менее гомогенного распределения N по MX.
Если во время осаждения равновесие устанавливается между"раствором и бесконечно тонким поверхностным слоем кристалла, то справедливо соотношение
![]()
где Я, – коэффициент логарифмического распределения. Это выражение описывает гетерогенное распределение NX по MX. Показано, что уравнение хорошо применимо для соосаждения хромата радия с хроматом бария, образующимся путем медленного осаждения, вызываемого постепенной нейтрализацией раствора азотной кислоты мочевиной или цианатом. Константа распределения для поверхностного слоя при гетерогенном осаждении должна представлять коэффициент D уравнения.
Процесс осаждения, описываемый уравнением, предпочтительнее для осаждения следов веществ по сравнению с процессом, представленным уравнением. На практике обычно оказывается, что распределение микрокомпонента не подчиняется ни одному из двух краевых уравнений, а находится где-то между ними.
Применение вышеизложенных принципов к системе сульфат свинца – сульфат стронция приводит к выводу, что следы свинца можно выделить соосаждением с сульфатом стронция. Оба эти сульфата изоморфны и образуют смешанные кристаллы. Вычислим значение D из отношения произведений растворимости при 18°:
![]()
Предположим, что при добавлении сульфата осаждается только 50% стронция, содержащегося в растворе. Если осаждение подчиняется закону гомогенного распределения, то отношение концентрации свинца в сульфате стронция к концентрации свинца, оставшегося в растворе, будет:
![]()
т.е. извлечение свинца составит 96%. Опыт подтвердил порядок этой величины. Хан показал, что при осаждении из раствора 50% стронция в осадке находится примерно 99% общего количества свинца, первоначально присутствовавшего в растворе. Поскольку осадить 99% стронция нетрудно, можно осуществить количественно осаждение свинца.
Свинец, содержащийся в осадке сульфата стронция, можно извлечь, переводя сульфаты в карбонаты и растворяя последние в кислоте. Выделение свинца методом соосаждения с сульфатом стронция или бария обычно имеет небольшое практическое значение при колориметрическом определении следов, так как вообще выгоднее отделять следы свинца путем экстракции органическим растворителем с помощью дитизона.
Посторонние вещества могут оказывать заметное влияние на отделение следов веществ вследствие образования смешанных кристаллов. Например, хлорид оказывает вредное действие на соосаждение свинца с сульфатом стронция. Так, когда в 1 н. растворе хлорида калия осаждают 50% стронция, в осадке находят 82% свинца, а если осаждение производят в 2,5 н. растворе хлорида калия, выпадает лишь 30% свинца. Неблагоприятное действие хлоридов может быть связано с образованием комплексного хлорида свинца, который не встраивается в кристаллическую решетку сульфата стронция.
Для отделения следов металлов может найти применение явление образования аномально смешанных кристаллов. Так, например, при кристаллизации некоторых галоидных солей щелочных металлов из водного раствора происходит обогащение свинца. Когда из раствора выкристаллизовывается 18,4% хлорида калия при 0°, 98,8% свинца, содержащегося в этом растворе, концентрируется в кристаллической фазе; при этом коэффициент распределения имеет значение 57.
Так же концентрируется свинец в хлористом натрии, кристаллизуемом из водного раствора; для очень низких концентраций свинца коэффициент распределения имеет значение, равное 60, однако он уменьшается по мере увеличения концентрации свинца. В этих случаях свинец, по-видимому, входит в кристаллическую решетку галогенида щелочного металла в виде хлорплюмбита. Хлорид таллия можно концентрировать в кристаллах хлорида калия; при кристаллизации 5% хлорида калия из водного раствора удаляется 99% таллия. Кадмии в концентрациях ниже 1 ч. на млн. почти полностью выпадает в осадок при выделении из водного раствора первой же 5%-ной фракции кристаллов хлористого натрия; сообщают, что цинк, висмут и марганец остаются в растворе. Эти примеры опровергают распространенное мнение о том, что рекристаллизация любой легко растворимой соли приводит к получению вещества большей чистоты.
Ионные радиусы катионов по Аренсу
Вероятно, избыток заряда, возникающий в результате замещения пятивалентной сурьмы шестивалентным молибденом, компенсируется катионными вакансиями. Аналогично осуществляется действие фторида лантана как носителя четырехзарядного церия и урана.
Фракционное осаждение. Иногда можно обработать вещества таким образом, что общим носителем осаждают фактически полностью микрокомпонент и только часть основного компонента. В этом состоит отличительный признак метода фракционного осаждения, и для его эффективного применения, очевидно, нужно, чтобы осаждающий реактив образовывал с микрокомпонентом менее растворимое соединение, чем с основным компонентом. Осадок основного компонента действует как носитель. Этот метод концентрирования применяется в качестве предварительной ступени при применении другого способа отделения, который неприменим, если отношение количества посторонних веществ и следов вещества очень неблагоприятно. Другими словами, фракционное осаждение позволяет снизить концентрацию основного компонента до такого уровня, когда она заметно не мешает прямому определению следов вещества. Этот принцип концентрирования иногда находит применение при разделениях с помощью сульфидов, как, например, для отделения кадмия в присутствии большого количества цинка или выделения свинца в присутствии большого количества железа.
Осаждение или адсорбция твердым веществом. Иногда для выделения микрокомпонента из раствора в качестве осадителя или адсорбента выгодно применить малорастворимое твердое вещество. Не всегда можно строго различить эффекты осаждения и адсорбции; но и в том и в другом случае твердое вещество действует как носитель. Рассматриваемые процессы могут быть тесно связаны или включены в число процессов, которые обычно называют хроматографическими, тем не менее, ради удобства рассмотрим их здесь.
Для выделения незначительных количеств металлов из больших объемов раствора можно использовать бумагу, пропитанную трудно растворимым составом. Например, при пропускании раствора соли меди очень низкой концентрации через кружок фильтровальной бумаги, пропитанной сульфидом кадмия, медь осаждается на бумаге по реакции
![]()
Произведение растворимости CuS настолько мало по сравнению с произведением растворимости CdS, что при определенных кислотности и скорости протекания раствора через фильтр равновесие этой реакции можно практически полностью сдвинуть слева направо. При необходимости можно последовательно применить несколько пропитанных фильтров. Таким путем из 500 мл раствора 0,01 М по серной кислоте и 0,1 М по ацетату натрия удалось выделить от 90 до 100% меди, содержавшейся в количестве от 20 до 50 у. Бумажные кружки можно сжечь и медь или другой осажденный металл определить любым подходящим колориметрическим методом или же, смыв сульфид кадмия погружением бумаги в теплую 1 М соляную кислоту, оставшееся на фильтре пятно меди можно сравнить со стандартными пятнами, полученными аналогичным образом. Этот метод применим для отделения меди от никеля в количестве до 0,0001%, а также для отделения меди от свинца. Используя бумагу, пропитанную сульфидом цинка, можно выделить следы свинца из нейтрального раствора.
Предельно малые количества золота, платины, палладия, селена, теллура и мышьяка можно выделить из кислого раствора при взбалтывании последнего с каломелью. Эти металлы восстанавливаются до элементарного состояния на поверхности каломели и сообщают ей интенсивную окраску.
Свинец сильно адсорбируется карбонатом кальция и таким путем может быть выделен из водопроводной воды. Сильная адсорбция объясняется малой растворимостью карбоната свинца. Следует также упомянуть, что свинец можно удалить из воды фильтрованием через вату. Этот метод не имеет практического значения для отделения малых количеств свинца, однако сам факт сильных адсорбционных свойств у целлюлозы служит предостережением против опасности полной или частичной потери определяемых следов во время фильтрования раствора через бумагу при некоторых условиях.
Приведенные примеры показывают, что иногда предварительно приготовленное малорастворимое вещество можно эффективно применять для отделения микрокомпонента. Однако, как правило, отделение является более полным и надежным или по крайней мере более быстрым, если твердая фаза образуется в растворе, содержащем определяемый микрокомпонент. Так, если бы главная задача аналитика состояла в выделении следов золота, то он скорее предпочел бы осадить хлорид ртути из раствора, чем взбалтывать раствор с добавленной каломелью. В первом случае для внедрения золота в осадок доступна большая эффективная поверхность хлорида ртути, и, кроме того, соосаждение идет быстрее, чем адсорбция. Если бы, однако, пожелали определить золото в растворе по окрашиванию каломели, то ее, конечно, добавляли бы предварительно приготовленной.
Способы отделения, при которых определяемый микрокомпонент оставляют в растворе, а макрокомпоненты осаждают. Этот случай представляется схемой раствор –> раствор – f – осадок.
Вообще при анализе следов веществ следует по возможности избегать этого метода. Осаждение большого количества вещества заключает в себе опасность большей или меньшей потери определяемых следов в результате соосаждения, и это всегда нужно иметь в виду. Если соосаждение микрокомпонента невелико, то переосаждение осадка может дать достаточно хорошее разделение. Каждую конкретную систему с к С нужно испытать. Даже если окажется возможным достигнуть этим путем удовлетворительного разделения, определяемые следы обычно остаются в большом объеме раствора, и их последующее определение вначале может потребовать концентрирования или выделения микрокомпонентов из этого раствора. Несмотря на указанные недостатки, этот метод разделения иногда приходится применять.
Исключением из сделанных замечаний является применение электролиза для отделения макрокомпонентов, который фактически относится к другой категории процессов.
б. Хроматографическое разделение
Этот метод разделения слишком широк и сложен, чтобы здесь можно было дать даже беглое изложение его, поэтому обсуждение ограничится некоторыми общими замечаниями и примерами применения хроматографии для анализа следов веществ.
Под хроматографическимн понимают такие процессы, которые позволяют разделять смеси растворенных веществ путем селективного удержания их на поверхности твердого тела или носителе и последующего выделения с помощью жидкой фазы, протекающей в определенном направлении. Под это определение подходят процессы, сильно отличающиеся друг от друга. Их классифицируют, как указано ниже, на основе следующих разновидностей адсорбентов.
1. Поверхностноактивные вещества.
2. Жидкости, связываемые или удерживаемые неподвижным носителем.
3. Химически активные твердые вещества.
4. Ионообменные вещества.
Каждый из этих сорбентов применяется для выделения следов веществ перед колориметрическим определением. Применение поверхностноактивных адсорбентов весьма ограниченно. Окись алюминия успешно использовали для выделения кобальта в виде нитрозо-Р-комплексной соли и для концентрирования лития из минеральных вод.
Хотя методом распределительной хроматографии на целлюлозе было выполнено много работ по разделению неорганических веществ, лишь небольшое число их имеет отношение к отделению следов веществ. Это замечание особенно справедливо для разделений, проведенных на хроматографических колонках. Одним из примеров применения распределительной хроматографии для отделения следов вещества служит выделение следов металлов из природных вод с помощью раствора дитизона в четыреххлористом углероде в качестве неподвижной фазы. Для набивки колонки используют ацетат целлюлозы. Пробу воды корректируют, чтобы установить рН равным 7, и пропускают через колонку со скоростью 2–6 л /час. Свинец, цинк, кадмий и марганец элюируют 1 М соляной кислотой, медь и кобальт – концентрированным раствором аммиака. Извлечение меди и цинка из 10 л воды, содержавшей по 10 у каждого металла, составило соответственно 102 и 11496. Полнота извлечения 10 у цинка из 1 л воды с жесткостью 12% была 95%. Эти результаты достаточно благоприятны и заслуживают серьезного внимания с точки зрения применения этой методики в некоторых разновидностях анализов следов веществ.
Другим практическим примером применения распределительной хроматографии на колонках из целлюлозы для анализа следов веществ служит выделение урана.
Распространенная форма распределительной хроматографии состоит в использовании полосок фильтровальной бумаги. Обычно каплю раствора наносят вблизи конца длинной прямоугольной полоски хроматографической бумаги и оставляют сохнуть. Полоску бумаги подвешивают вертикально в закрытой камере и нижний конец ее до пятна опускают в подходящий растворитель, давая ему возможность диффундировать вверх. Разделяемые вещества образуют хроматограмму, зоны которой располагаются на различных расстояниях от границы смачивания растворителем. Если значения Rf достаточно различаются, то зоны не перекрываются.
Поскольку речь идет о разделении, бумага может быть разрезана по обеим сторонам зон, и вещества элюированы или, если это необходимо, бумага может быть подвергнута озолению перед тем, как применить другой способ обработки. Поскольку зоны обычно невидимы, их положение обнаруживается путем опрыскивания дублирующей полоски бумаги реагентом, образующим окрашенные соединения с разделяемыми веществами. Грубое определение количества вещества возможно путем сравнения интенсивности окраски зоны с серией стандартов, полученных подобным же образом. Могут быть сделаны также фотометрические измерения.
В процессе разделения неорганических веществ методом хроматографии на бумаге играет роль ряд факторов. Один из них – растворимость веществ в данном растворителе. Если какой-либо из компонентов смеси фактически нерастворим, он остается неподвижным. Компоненты, растворимые в применяемом растворителе, могут быть разделены в результате того, что они в различных степенях распределяются между более богатым водой слоем растворителя, находящимся у поверхности волокон бумаги, и наружным слоем органического растворителя. Кроме того, компоненты могут быть адсорбированы целлюлозой в различных степенях. Могут иметь место также другие факторы, так что система, вероятно, сложная и в настоящее время эмпирическое приближение при изучении процессов разделения оказывается наиболее плодотворным.
Количество образца, которое может быть обработано обычным методом хроматографии на бумаге, мало – порядка 1 мг или, возможно, меньше сотых долей грамма. Поэтому даже если в остальном метод хроматографии на бумаге удовлетворителен, он не может быть непосредственно применим как средство разделения микроколичеств вещества. Хроматография на бумаге является, вероятно, более ценным методом при отделении следов от второстепенных компонентов образца или следов других веществ. Например, при определении родия в железном метеорите металлы платиновой группы могут быть отделены путем осаждения, а родий затем выделяют из родственных ему элементов методом хроматографии на бумаге.
С точки зрения анализа следов высокая степень локализации разделяемых компонентов, достигаемая в хроматографии на полоске бумаги, имеет важное значение для конечного определения.
Ионный обмен. Этот тип адсорбции находит все возрастающее применение в анализе следов веществ. Ионообменное вещество представляет собой синтетическую смолу. Смола, предназначенная для обмена катионов, является соединением типа сульфоновой кислоты, в котором ионы водорода, находящиеся на внутренней поверхности, могут замещаться катионами металла:
![]()
Пробу раствора медленно пропускают через колонку со смолой. Обычно адсорбционная способность катиона повышается с увеличением его заряда и уменьшается с увеличением радиуса гидратированного иона. Однако этим путем невозможно достаточно хорошо разделить катионы и необходимо прибегнуть к элюированию их из адсорбента подходящим раствором. Например, после адсорбции катионов через колонку со смолой можно пропустить раствор кислоты. Катионы, удерживаемые смолой менее сильно, будут замещаться ионами водорода охотнее катионов, адсорбированных более прочно, и фракционирование в колонке может оказаться настолько аффективным, что приведет к количественному выделению первого катиона до выделения второго. Еще лучшее дифференциальное перемещение ионов тяжелых металлов можно получить, используя в качестве элюента вещество, образующее с разделяемыми ионами комплексы, различающиеся по устойчивости. Разделение анионов можно осуществить путем дифференциальной адсорбции и элюирования на анионообменниках, которые представляют собой смолы, содержащие такие группы, как – nh2, – nhr, – nr2 и – nr.
Вполне очевидно, что отделение катионов, присутствующих в растворе, от анионов или отделение любых из них от нейтральных молекул можно легко осуществить, используя подходящую смолу. При анализе следов разделения такого рода могут найти полезное применение в тех случаях, когда определяемый микрокомпонент находится в растворе в виде иона с зарядом, противоположным заряду компонента, присутствующего в большем количестве. В растворе соляной кислоты, особенно при сравнительно низких концентрациях хлор-иона, некоторые тяжелые металлы будут присутствовать преимущественно в виде катионов, другие – в виде отрицательно заряженных хлор-комплексов. Регулируя концентрацию хлор-иона в пробе анализируемого раствора, а также в элюирующем растворе, с помощью анионообменников можно осуществить разнообразные разделения. Некоторые из них были применены при анализе следов металлов, и литературные ссылки будут даны в следующих главах. В разделениях подобного рода находят применение также другие галоидные комплексы, особенно фториды.
Катионообменные смолы использовали для совместного выделения следов ряда элементов. Предложен ионообменный способ выделения меди, кадмия, никеля, цинка и марганца из настоя растительных материалов и отделения их от фосфата. Раствор пропускают через колонку диаметром 2,5 мм со смолой амберлит ir-100 и отмывают адсорбированные ионы 1 н. раствором соляной кислоты. Высокая ионная сила раствора неблагоприятно сказывается на адсорбции. Полученные данные показывают, что извлечение металлов происходит неполно, например для меди оно составляет 94%. Описан метод выделения меди из молока и молочных продуктов без озоления, в котором медь адсорбируется на смоле амберлит ir-100 в диапазоне рН 3,5–6,5; кальций при концентрации до 250 ч. на млн. не влияет на извлечение меди. Как катионитовые, так и анионитовые смолы нашли применение для концентрирования ионов, присутствующих в мнк-роколичествах в озерных водах.
Пропусканием через катионнтовую смолу можно очистить дистиллированную воду а. При этом такие металлы, как медь, цинк и свинец, почти полностью удаляются из воды.
Электролитическое осаждение
Часто выделение следов тяжелых металлов из больших объемов растворов можно осуществить электролизом. Среди металлов, которые были выделены путем электролитического осаждения на платине или других металлических электродах, можно указать медь г, свинец, ртуть, цинк, серебро и золото. Из-за растворимости в воде ртуть осаждается не полностью.
Электролитическое отделение свинца в виде двуокиси применяли при определении его в силикатных породах. Осажденную окись анализировали колориметрически с помощью тетраметилдиамннодифенилметана. Выделение свинца, однако, не было количественным, и истинное содержание его в породах приходилось устанавливать радиометрическим методом. Отчасти неполное осаждение свинца могло быть обусловлено значительной молекулярной растворимостью двуокиси.
Имеется описание специального прибора для электролитического выделения следов металлов из больших объемов раствора в. Он предназначен для определения следов элементов в объемах 250 мл с содержанием основного металла 5–10 г. Выделенный на электроде металл определяли весовым или объемным методом, при этом можно было определить до 0,1 мг цинка в 5 г алюминия с точностью 1% и 0,1 мг меди в 5 г никеля с точностью 3%. По-видимому, вес анализируемого образца можно значительно уменьшить, если осаждаемый электролитически металл определять подходящим колориметрическим методом, а не весовым или объемным методом.
Электролизом с ртутным катодом из раствора можно эффективно удалять большие количества многих тяжелых металлов, которые нежелательны при анализе. В разбавленном растворе серной кислоты на ртутном катоде осаждаются железо, хром, никель, кобальт, цинк, кадмий, галлий, индий, германий, медь, олово, молибден, рений, висмут, таллий, серебро, золото и металлы платиновой группы; в то же время такие элементы, как алюминий, титан, цирконий, фосфор, ванадий и уран, количественно остаются в растворе. Этот метод особенно ценен при определении последней группы элементов в металлургических материалах. Так, электролиз с ртутным катодом обеспечивает превосходное отделение железа, мешающего при определении алюминия в стали. Не всегда легко без остатка выделить осаждаемые элементы. Микрограммовые количества их остаются в растворе даже при условии, что предпринимаются самые тщательные меры. В раствор будут попадать микроколичества ртути, так как она имеет заметную атомную растворимость. По имеющимся данным, при концентрациях серной кислоты от 0,1 до 6 н. можно достичь фактически полного электролитического осаждения Си, Zn, Cd, In, Tl, Sn, Bi, Fe и, весьма вероятно, также Ag, Au, Hg и некоторых металлов платиновой группы. При кислотности в пределах 0,1–1,5 н. удается полностью выделить Со и Nr. Другие металлы можно осадить только из 0,1 н. серной кислоты. Из серной кислоты в пределах концентраций от 0,1–6н. неполно осаждаются Ge, Sb, Те, Мп, Re и, вероятно, Ru. После проведения электролиза в кислоте в суспендированном состоянии частично остаются As, Sb, Мп, Ge, Se, Те и Сг. Некоторые металлы, которые на ртутном электроде не осаждаются, могут мешать электроосаждению других металлов или не допустить его вовсе, если присутствуют в высоких концентрациях. В электролите всегда остаются следы осаждаемых элементов. Электролитический способ осаждения металлов на ртутном катоде особенно эффективен для отделения больших количеств Си, Zn, Cd, Ga, In, Tl, Sn, Bi, Cr, Fe, Co и Ni.
Экстракционный метод извлечения следов вещества из водного раствора с помощью органического растворителя, не смешивающегося с водной фазой, во многих случаях является идеальным методом отделения микрокомпонента от больших количеств посторонних веществ. Часто он обладает высокой избирательностью и обычно позволяет путем повторения экстракционных операций выделять вещества с желаемой полнотой. Метод экстракции имеет большое значение не только для разделения веществ, но также для выделения малых количеств какого-либо компонента из большого объема водного раствора и концентрирования его в малом объеме несмешивающегося растворителя. Таким путем достигается более высокая чувствительность определения, когда экстрагируемое соединение окрашено. В настоящее время экстракцией несмешивающимся растворителем можно эффективно разделять большее число металлов, чем каким-либо другим методом.
Способные к экстракции вещества, представляющие интерес для анализа следов в неорганических материалах, можно грубо классифицировать, как указано ниже.
1. Неорганические вещества.
а. Элементы и соединения с ковалентной связью. Примеры: J2, OsOt, GeClt.
б. Соединения с ионной связью, такие, как галогениды и нитраты.
2. Органические соединения.
а. Нейтральные координационные комплексы типа MeR». Это преимущественно хелатные комплексы. Примерами являются дитизонаты, 8-оксихиноляты, ннтрозонафтолаты и др.
б. Комплексные соединения, состоящие из ионной пары, или, в более общем смысле, ионные ассоциаты. Металл может находиться в ка
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Методы разделения азеотропных смесей
1. ЛИТЕРАТУРНЫЙ ОБЗОР1.1. Методы разделения азеотропных смесей. 1.1.1. Разделение азеотропных смесей в комплексе колонн, работающих под разн
- Мир солей
- Моделирование газофазных процессов, протекающих при гетерогенно-каталитическом восстановлении оксидов азота
- Пасты, эмульсии. Пены, суспензии
- Переработка вторичного сырья: инструментальных сталей, осколков и пыли на основе твердых сплавов карбида вольфрама
- Переработка жидкого топлива
- Периодическая система элементов. Периоды, группы, подгруппы. Периодический закон и его обоснование
Мне захотелось попробовать раскрыть эту тему и посмотреть на неё со стороны дилетанта в вопросах химии, так как меня заинтересовал сам п
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

