Методы микробиологической диагностики
Микробиологическая диагностика в первую очередь необходима для определения причины инфекционных заболеваний. Существует 5 основных методов лабораторной диагностики: микроскопический, бактериологический, биологический, серологический и аллергический. Их принципы мы и рассмотрим в данном реферате. Также рассмотрим вопросы организации лабораторной микробиологической службы, методы выделения и идентификации бактерий, обнаружения вирусов, грибов и простейших. Данная тема очень актуальна в наше время, так как с развитием общества и с увеличением численности населения все более масштабным становится распространение инфекций и своевременное обнаружение их носителей способно предотвратить возникновение эпидемий. Благо сейчас биологи уже способны определить множество инфекций, но, сколько ещё не найдено!!! А обнаружение новых микроорганизмов, вызывающих заболевания, позволяет своевременно найти способ лечения. Так что есть ещё простор для мысли и опытов. Думаю, самое время перейти к уже известным нам способам распознавания микроорганизмов. Начнём с места проведения диагностики: с лабораторий.
ОРГАНИЗАЦИЯ ЛАБОРАТОРНОЙМИКРОБИОЛОГИЧЕСКОЙСЛУЖБЫ
Объект изучения медицинских микробиологических лабораторий — патогенные биологические агенты (ПБА) — патогенные для человека микроорганизмы (вирусы, бактерии, грибы, простейшие), генно-инженерно модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также материал (включая кровь, биологические жидкости и экскременты организма человека), подозрительный на содержание ПБА. В зависимости от выполняемых исследований, микробиологические лаборатории подразделяют на диагностические, производственные и научно-исследовательские. В соответствии с типами микроорганизмов, изучаемых в них, выделяют бактериологические, вирусологические, микологические и протозоологические лаборатории. С возбудителями инфекционных заболеваний работают только в специализированных лабораториях, обеспечивающих безопасность её персонала и невозможность «утечки» патогенных микроорганизмов за пределы лаборатории.
Группы возбудителей инфекционных заболеваний
Регламентация условий работы с возбудителями инфекционных заболеваний произведена в соответствии со степенью опасности микроорганизмов для человека. По этому признаку выделено четыре группы возбудителей.
Группа I: возбудители особо опасных инфекций: чума, натуральная оспа, лихорадки Ласса, Эбола и др.
Группа II: возбудители высококонтагиозных бактериальных грибковых и вирусных инфекций: сибирская язва, холера, лихорадка Скалистых гор, сыпной тиф, бластомикоз, бешенство и др. В эту группу также включён ботулотоксин (но не сам возбудитель ботулизма).
Группа III: возбудители бактериальных грибковых, вирусных и протозойных инфекций, выделенных в отдельные нозологические формы (возбудители коклюша, столбняка, ботулизма, туберкулёза, кандидоза, малярии, лейшманиоза, гриппа, полиомиелита и др.). В эту группу также включены аттенуированные штаммы бактерий групп I, II и III.
Группа IV: возбудители бактериальных, вирусных, грибковых септицемии, менингитов, пневмоний, энтеритов, токсикоинфекций и острых отравлений (возбудители анаэробных газовых инфекций, синегнойной инфекции, аспергиллёза, амебиаза, аденовирусы, герпесвирусы и др.).
Лаборатории разных групп риска
В зависимости от уровня безопасности работы с микроорганизмами лаборатории подразделяют на четыре группы риска.
Первая группа риска: лаборатории особого режима (максимально изолированные) с высоким индивидуальным и общественным риском.
Вторая группа риска: режимные лаборатории (изолированные) с высоким индивидуальным и низким общественным риском.
Третья группа риска: базовые (основные) лаборатории с умеренным индивидуальным и ограниченным общественным риском.
Четвёртая группа риска: базовые (основные) лаборатории с низким индивидуальным и общественным риском.
Бактериологические лаборатории
В системе Министерства здравоохранения и Государственного комитета санитарно-эпидемиологического надзора РФ наиболее разветвлена сеть бактериологических лабораторий. В соответствии с выполняемыми задачами выделяют:
• бактериологические лаборатории в составе ЛПУ;
• бактериологические лаборатории в составе комитетов Госсанэпиднадзора;
• учебные бактериологические лаборатории вузов;
• проблемные и отраслевые бактериологические лаборатории научно-исследовательских институтов и предприятий по выпуску бактерийных препаратов;
• специализированные бактериологические лаборатории по контролю за особо опасными инфекциями;
• специализированные бактериологические лаборатории по контролю за отдельными группами бактерий: микобактериями, риккетсиями, лептоспирами и др.
Большая часть микробиологических лабораторий работает с ПБА групп III и IV, а изучением возбудителей особо опасных инфекций (группы I и II) занимаются только специализированные лаборатории.
Требования к организации работы с ПБА групп опасности III и IV
Базовые лаборатории, работающие с ПБА групп III и IV, должны располагаться в отдельном здании или в изолированной части здания. Они должны иметь два выхода: один для сотрудников, другой — для доставки материала для исследований (допускается передача материала через передаточное окно). В лабораториях вузов, научно-исследовательских институтов и на предприятиях по выпуску бактерийных препаратов допускается наличие одного входа. Лаборатории должны иметь необходимый набор помещений в соответствии с производственной мощностью и номенклатурой выполняемых исследований. В них должны быть проведены водопровод, электричество, отопление и вентиляция. В системе водоснабжения должны быть предусмотрены раздельные сети подачи воды для лабораторных исследований и бытовых нужд (сеть питьевой воды). Последняя должна быть защищена от обратного тока воды из лабораторной сети. Вентиляция должна быть приточно-вытяжной, при этом наиболее низкое давление вытяжной вентиляции должно быть в помещениях с наибольшей опасностью инфицирования. При необходимости вентиляцию следует оснастить фильтрами тонкой очистки воздуха. Помещения должны иметь естественное и искусственное освещение. Каждая лаборатория должна иметь «чистую» и «грязную» зоны. Их планировка и размещение оборудования должны обеспечивать «проточность>> продвижения ПБА по «грязной» зоне.
«Грязная» зона включает помещения для приёма и регистрации материала, боксы и комнаты дляпроведения микробиологических исследований, помещения для проведения серологических исследований, комната для проведения люминесцентной микроскопии, термостатная, автоклавная для обеззараживания материала. Окна и двери всех помещений должны герметично закрываться. Приточно-вытяжная вентиляция «грязной» зоны должна быть оборудована фильтрами тонкойочистки выбрасываемого воздуха. Помещения для проведения работ с живыми ПБА должны быть оборудованы бактерицидными лампами. Обязательна маркировка автоклавов, столов, стеллажей для чистого и инфицированного материала. Покрытие лабораторной мебели, поверхности пола, стен и потолка должны быть гладкими и устойчивыми к действию моющих и дезинфицирующих средств.
«Чистая» зона включает гардероб для верхней одежды, комнаты отдыха, комнату для работы с документацией, комнату для надевания рабочей одежды, подсобные помещения, душевую, туалет, помещения для предварительных работ (препараторская, моечная, комната приготовления и разлива питательных сред и др.), стерилизационную, помещения с холодильниками для хранения питательных сред и диагностических препаратов. В «чистой» зоне возможна работа с неживыми ПБА (серологические и биохимические исследования).
Требования к проведению работ в микробиологической лаборатории
Работу с ПБА групп III и IV выполняют специалисты с высшим и средним специальным образованием. К ней допускают сотрудников, прошедших инструктаж по соблюдению требований безопасности работы с ПБА; последующий инструктаж следует проводить не реже одного раза в год. Все сотрудники, работающие с ПБА, должны находиться на диспансерном учёте. Приборы, оборудование и средства измерения должны быть аттестованы, технически исправны и иметь технический паспорт. Их метрологический контроль и техническое освидетельствование следует проводить в установленные сроки.
Из правил работы в «грязной зоне» базовой лаборатории:
Использование спецодежды и средств индивидуальной защиты. Перед работой следует проверить качество посуды, пипеток, шприцев и другого оборудования. При пипетировании необходимо пользоваться только резиновыми грушами или автоматическими устройствами. Строго запрещено пипетировать материал ртом, переливать его через край сосуда (пробирки, колбы), а также оставлять без надзора рабочее место во время выполнения любых работ с ПБА. В грязной зоне запрещается курить, пить воду, хранить верхнюю одежду, головные уборы, обувь, пищевые продукты. В помещения зоны нельзя приводить детей и домашних животных.
Послеокончания работы все объекты, содержащие ПБА, должны быть убраны в хранилища (холодильники, термостаты, шкафы) с обязательной дезинфекцией столов. Использованные пипетки полностью (вертикально) погружают в дезинфицирующий раствор, избегая образования пузырьков в каналах. Остатки ПБА, использованную посуду и оборудование собирают в закрывающиеся ёмкости и передают в автоклавную. Категорически запрещено сливать отходы с ПБА в канализацию без предварительного обеззараживания. После окончания работы с ПБА и заражёнными животными, а также после ухода из лаборатории следует тщательно вымыть руки.
ПРИНЦИПЫ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Цель микробиологических исследований — установить факт наличия или отсутствия возбудителя в организме больного и на объектах окружающей среды.
Задачи микробиологических исследований — идентифицировать микроорганизмы в исследуемом материале, определить их видовую принадлежность, морфологические, биохимические, токсигенные и антигенные свойства, а также установить чувствительность выделенных микроорганизмов к антимикробным препаратам. Несмотря на то, что проведение микробиологических исследований относится к компетенции микробиологов, каждый врач, имеющий дело с инфекционными заболеваниями, должен знать, как и когда необходимо отбирать материал для исследований, на какие исследования его направлять и как интерпретировать полученные результаты.
Отбор материала.
Первый этап любого микробиологического исследования составляет правильный выбор материала для исследования. Его определяют свойства возбудителя и патогенез вызываемого им заболевания. При поражениях отдельных органов и систем целесообразно отбирать материал соответствующей локализации. При отсутствии поражений исследуют кровь, а затем отбирают образцы с учётом клинической картины заболевания и доступности материала для исследования. Так, при лихорадке неясного генеза первоначально проводят посев крови; затем, при появлении симптомов более конкретных проявлений, например пневмонии, проводят забор мокроты.
• ![]() Образцы следует забирать до назначения антимикробной терапии, с соблюдением правил асептики для предупреждения загрязнения материала. Каждый образец следует рассматривать как потенциально опасный. При заборе, транспортировке, хранении и работе с ним необходимо соблюдать правила биологической безопасности. Материал собирают в объёме достаточном для всего комплекса исследований. Микробиологические исследования следует начинать немедленно после поступления образца в лабораторию.
Образцы следует забирать до назначения антимикробной терапии, с соблюдением правил асептики для предупреждения загрязнения материала. Каждый образец следует рассматривать как потенциально опасный. При заборе, транспортировке, хранении и работе с ним необходимо соблюдать правила биологической безопасности. Материал собирают в объёме достаточном для всего комплекса исследований. Микробиологические исследования следует начинать немедленно после поступления образца в лабораторию.
• Выбор материала для исследования должен соответствовать характеру инфекционного процесса. Так, например, при установлении этиологии пневмонии материалом должна быть мокрота, а не слюна, а при раневых инфекциях отделяемое следует забирать из глубины раны, а не с её поверхности.
Выбор лабораторных исследований
Основу микробиологической диагностики инфекционных заболеваний составляют микроскопические, микробиологические, биологические, серологические и аллергологические методы.
Микроскопические методы
Микроскопические методы включают приготовление мазков и препаратов для микроскопирования. В большинстве случаев результаты микроскопических исследований носит ориентировочный характер (например, определяют отношение возбудителей к окраске), так как многие микроорганизмы лишены морфологических и тинкториальных особенностей. Тем не менее микроскопией материала можно определить некоторые морфологические признаки возбудителей (наличие ядер, жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах.
Микробиологические методы
Микробиологические методы — «золотой стандарт» микробиологической диагностики, так как результаты микробиологических исследований позволяют точно установить факт наличия возбудителя в исследуемом материале. Идентификацию чистых культур (до вида микроорганизма) проводят с учётом морфологических, тинкториальных, культуральных, биохимических, токсигенных и антигенных свойств микроорганизма. Большинство исследований включает определение чувствительности к антимикробным препаратам у выделенного возбудителя. Для эпидемиологической оценки роли микроорганизма проводят внутривидовую идентификацию определением фаговаров, биоваров, резистентваров и т.д.
Биологические методы
Биологические методы направлены на определение наличия токсинов возбудителя в исследуемом материале и на обнаружение возбудителя (особенно при незначительном исходном содержании в исследуемом образце). Методы включают заражение лабораторных животных исследуемым материалом с последующим выделением чистой культуры патогена, либо установлением факта присутствия микробного токсина и его природы. Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм-макроорганизм. Для проведения биологических проб используют только здоровых животных определённых массы тела и возраста. Инфекционный материал вводят внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно и подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат из брюшины, после гибели — кровь, кусочки различных органон, СМЖ, экссудат из различных полостей.
Серологические методы
Серологические методы выявления специфических АТ и Аг возбудителя – важный инструмент в диагностике инфекционных заболеваний. Особую ценность они имеют в тех случаях, когда выделить возбудитель не представляется возможности. При этом необходимо выявить повышение титров АТ, в связи с чем исследуют парные образцы сыворотки, взятые в интервале 10-20 суток (иногда этот интервал может быть более длительным). АТ обычно появляются в крови на 1-2-ю неделю заболевания и циркулируют в организме относительно долго, что позволяет использовать их выявление для ретроспективных эпидемиологических исследований. Определение классов lg чётко характеризует этапы инфекционного процесса, а также может служить косвенным прогностическим критерием. Особое значение имеют методы выявления микробных Аг. В значимых количествах они появляются уже на самых ранних сроках, что делает их идентификацию важным инструментом экспресс-диагностики инфекционных заболеваний, а количественное их определение в динамике инфекционного процесса служит критерием эффективности проводимой антимикробной терапии.
Аллергологические методы
Аг многих возбудителей обладают сенсибилизирующим действием, что используют для диагностики инфекционных заболеваний, а также при проведении эпидемиологических исследований. Наибольшее распространение нашли кожно-аллергические пробы, включающие внутрикожное введение Аг (аллергена) с развитием реакции ГЗТ. Кожные пробы нашли применение в дианостике таких заболеваний как сап, мелиодиоз, бруцеллёз. Наиболее известна проба Манту. Используемая как для диагностики туберкулёза, так и для оценки невосприимчивости организма к возбудителю.
МЕТОДЫ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ
Микроскопия материала
Любое бактериологическое исследование начинается с микроскопии материала и его последующего посева на питательные среды. Эффективность выделения возбудителя в значительной степени обусловлена правильной техникой отбора образцов клинического материала, своевременностью их доставки в лабораторию и правильным хранением образцов.
СВЕТООПТИЧЕСКАЯ МИКРОСКОПИЯ
Для световой микроскопии применяют микроскоп — оптический прибор, позволяющий наблюдать мелкие объекты (рис. 1-1). Увеличение изображения достигают системой линз конденсора, объектива и окуляра. Конденсор, расположенный между источником света и изучаемым объектом, собирает лучи света в поле микроскопа. Объектив создаёт изображение поля микроскопа внутри тубуса. Окуляр увеличивает это изображение и делает возможным его восприятие глазом. Предел разрешения микроскопа (минимальное расстояние, на котором различимы два объекта) определяется длиной световой волны и апертурой линз. Теоретически возможный предел разрешения светового микроскопа равен 0,2 мкм; реальное разрешение можно повысить за счёт увеличения апертуры оптической системы, например путём увеличения коэффициента преломления. Коэффициент преломления (иммерсии) жидких сред больше коэффициента преломления воздуха («=1,0), при микроскопировании применяют несколько иммерсионных сред: масляную, глицериновую, водную. Механическая часть микроскопа включает штатив, предметный столик, макро- и микрометрический винты, тубус, тубусодержатель.
Темнопольная микроскопия позволяет наблюдать живые бактерии. Для этого используют темнопольный конденсор, выделяющий контрастирующие структуры неокрашенного материала. Перед началом работы свет устанавливают и центрируют по светлому полю, затем светлопольный![]() конденсор удаляют и заменяют соответствующей системой (например, ОИ-10 или ОИ-21). Препарат готовят по методу «раздавленной капли», делая его как можно более тонким (толщина покровного стекла не должна быть толще 1 мм). Наблюдаемый объект выглядит как освещенный на тёмном поле. При этом лучи от осветителя падают на объект сбоку, а в линзы микроскопа поступают только рассеянные лучи (рис. 1-2). В качестве иммерсионной жидкости пригодно вазелиновое масло.
конденсор удаляют и заменяют соответствующей системой (например, ОИ-10 или ОИ-21). Препарат готовят по методу «раздавленной капли», делая его как можно более тонким (толщина покровного стекла не должна быть толще 1 мм). Наблюдаемый объект выглядит как освещенный на тёмном поле. При этом лучи от осветителя падают на объект сбоку, а в линзы микроскопа поступают только рассеянные лучи (рис. 1-2). В качестве иммерсионной жидкости пригодно вазелиновое масло.
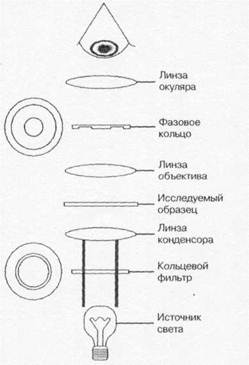
Фазово-контрастная микроскопия позволяет изучать живые и неокрашенные объекты за счёт повышения их контрастности. При прохождении света через окрашенные объекты происходит изменение амплитуды световой волны, а при прохождении через неокрашенные — фазы световой волны, что используют для получения высококонтрастного изображения в фазово-контрастной (рис. 1-3) и интерференционной микроскопии. Для повышения контрастности фазовые кольца покрывают металлом, поглощающим прямой свет, не влияя на сдвиг фазы. В оптической системе микроскопа применяют специальный конденсор с револьвером диафрагм и центрирующим устройством; объективы заменяют на иммерсионные объективы-апохроматы.
Поляризационная микроскопия позволяет получать изображения неокрашенных анизотропных структур (например, коллагеновых волокон, миофибрилл или клеток микроорганизмов). Принцип метода основан на изучении объекта в свете, образованном двумя лучами, поляризованными во взаимно перпендикулярных плоскостях.
Интерференционная микроскопия объединяет принципы фазово-контрастной и поляризационной микроскопии. Метод применяют для получения контрастного трёхмерного изображения неокрашенных объектов. Принцип метода основан на раздвоении светового потока в микроскопе; один луч проходит через объект, другой — мимо него. Оба луча соединяются в окуляре и интерферируют между собой.
Люминесцентная микроскопия. Метод основан на способности некоторых веществ светиться при воздействии коротковолнового излучения. При этом испускаемые световые волны длиннее волны, вызывающей свечение. Иными словами, флюоресцирующие объекты поглощают свет одной длины волны и излучают в другой области спектра (рис. 1-4). Например, если индуцирующее излучение синее, то образующееся свечение может быть красным или жёлтым. Эти вещества (флюоресцеин изоцианат, акридиновый оранжевый, родамин и др.) используют как флюоресцирующие красители для наблюдения флюоресцирующих (люминесцирующих) объектов. В люминесцентном микроскопе свет от источника (ртутная лампа сверхвысокого давления) проходит через два фильтра. Первый (![]() синий) фильтр задерживает свет перед образцом и пропускает свет длины волны, возбуждающей флюоресценцию образца. Второй (жёлтый) задерживает синий свет, но пропускает жёлтый, красный, зелёный свет, излучаемый флюоресцирующим объектом и воспринимаемый глазом. Обычно исследуемые микроорганизмы окрашивают непосредственно либо с помощью AT или лектинов, помеченных флюорохромами. Препараты взаимодействуют с Аг или другими связывающими лиганд структурами объекта. Люминесцентная микроскопия нашла широкое применение для визуализации результатов иммунохимических реакций, основанных на специфическом взаимодействии меченных флюоресцирующими красителями AT с Аг изучаемого объекта. Варианты I иммунофлюоресцентных реакций представлены рис. 1-5 и 1-6.
синий) фильтр задерживает свет перед образцом и пропускает свет длины волны, возбуждающей флюоресценцию образца. Второй (жёлтый) задерживает синий свет, но пропускает жёлтый, красный, зелёный свет, излучаемый флюоресцирующим объектом и воспринимаемый глазом. Обычно исследуемые микроорганизмы окрашивают непосредственно либо с помощью AT или лектинов, помеченных флюорохромами. Препараты взаимодействуют с Аг или другими связывающими лиганд структурами объекта. Люминесцентная микроскопия нашла широкое применение для визуализации результатов иммунохимических реакций, основанных на специфическом взаимодействии меченных флюоресцирующими красителями AT с Аг изучаемого объекта. Варианты I иммунофлюоресцентных реакций представлены рис. 1-5 и 1-6.
Рис. 1-3. Схема фазово-контрастного микроскопа |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Механизм взаимодействия вируса и клетки
1. Типы взаимодействия вируса с клеткой2. Адсорбция вируса3. Проникновение вируса в клетку4. Синтез вирусных белков5.
- Механизмы выживания бактерий в окружающей среде
- Механика микрочастиц
- Микробная коррозия и ее возбудители
ВведениеВ связи с бурным развитием промышленности резко возросли размеры коррозионных повреждений металлических и неметаллических к
- Микроклональное размножение Ириса Низкого путем изолирования зародыша как способ сохранения вида
- Микроорганизмы, выделенные из различных природных жиров
- Млекопитающие
Класс Млекопитающие (Mammalia) высший класс позвоночных животных, венчающий всю систему животного мира. Наиболее важными чертами общей орг
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.