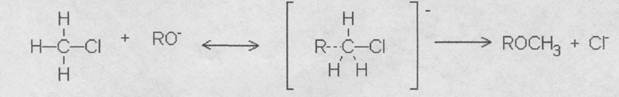Метилцеллюлоза и карбоксиметилцеллюлоза: свойства растворов и пленок
Метилцеллюлоза является первым членом гомологического ряда 0-алкильных производных целлюлозы (простых эфиров). По степени замещения метиловые эфиры целлюлозы можно разделить на низкозамещенные, растворимые в водных растворах сильных щелочей определенной концентрации, и высокозамещенные, растворимые как в воде, так и в органических растворителях. Метиловые эфиры целлюлозы могут быть получены при реакции целлюлозы с различными алкилирующими реагентами: диметилсульфатом, хлористым (или йодистым и бромистым) метилом, диазометаном, метиловым эфиром бензолсульфоновой кислоты. В настоящее время метилцеллюлоза (главным образом водорастворимая) является промышленным продуктом.
Препараты 0-карбоксиметилцеллюлозы в зависимости от степени замещения, так же как и других 0-алкильных производных, можно разделить на низкозамещенные и высокозамещенные. Получение препаратов КМЦ со степенью замещения γ более 100, однако, весьма затруднено ввиду электростатических эффектов отталкивания заряженных одноименно групп (хлорацетатного иона и карбоксиметильной группы). Поэтому практически «высокозамещенными» препаратами КМЦ являются продукты, имеющие степень замещения γ=50—100 и являющиеся водорастворимыми.
Получение метилцеллюлозы
В промышленности для получения метилцеллюлозы чаще всего применяют метод, основанный на алкилировании щелочной целлюлозы хлористым метилом (1).
Процесс алкилирования алкилгалогенидами происходит при температурах 353—373 К. Так как хлористый метил имеет точку кипения 248К, реакция алкилирования производится в автоклавах под высоким давлением.
В процессе алкилирования происходят побочные реакции между хлористым метилом и щелочью с образованием спирта и соли и между спиртом и хлористым метилом с образованием диметилового эфира:
NaOH+CH3Cl+CH3OH→CH3OCH3+NaCl+H2O
CH3Cl+NaOH→CH3OH+NaCl
Поэтому необходимо применять избыток хлористого метила и значительное количество твердой щелочи, так как с увеличением концентрации щелочи разложение хлористого метила уменьшается.
Легче всего подвергается обмену (наиболее подвижен) атом йода, что связано с его большей поляризуемостью, однако алкилиодиды относительно дороги. Хлориды и бромиды мало различаются по реакционной способности, поэтому в промышленных синтезах предпочитают использовать более доступные хлористые алкилы.
|
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Методы активации химических процессов
Для интенсификации технологических процессов применяют различные физические факторы воздействия, в частности акустические колебания.
- Методы количественного обнаружения в образцах экологически опасных радионуклидов
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИМАРИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТКАФЕДРА ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИМетоды колич
- Методы обессоливания нефти и нефтяного
- Методы разделения иммуноглобулинов
- Методы умягчения воды
- Миграция химических элементов
- Минеральный состав организма
ПВИ ВВ МВД РФКафедра общенаучных дисциплинКурсовая работа по химииТема: Минеральный состав организмаВыполнил: Подполковник в отставке
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.