Комплексные соединения в аналитической химии
1. Основные понятия и терминалогия
2. Химическая связь в комплексных соединениях и особенности их строения
2.1 Тип гибридизации атомных орбиталей комплексообразователя и структура внутренней сферы комплексного соединения
3. Химические свойства комплексных соединений
3.1 Диссоциация в растворах
3.2 Образование комплексных соединений
3.3 Трансформация или разрушение комплексных соединений
3.4 Кислотно-основные свойства комплексных соединений
4. Комплексные соединения в аналитической химии
4.1 Качественный анализ катионов
5. Комплексонометрия
5.1 Понятие
5.2 Комплексонометрическое титрование — комплексонометрия
Заключение
Список использованной литературы
Введение
Обширную группу химических соединений составляют комплексы, в молекулах которых всегда можно выделить центральный атом или ион, вокруг которого сгруппированы другие ионы или молекулярные группы.
Комплексы имеют исключительно большое значение в живой и неживой природе. Гемоглобин, благодаря которому осуществляется перенос кислорода из легких к клеткам ткани, является комплексом железа, а хлорофилл, ответственный за фотосинтез в растениях, – комплексом магния. Значительную часть природных минералов, в том числе многие силикаты и полиметаллические руды, также составляют комплексы. Химические методы извлечения металлов из руд связаны с образованием легкорастворимых, легкоплавких и высоколетучих комплексов. Современная химическая промышленность широко использует комплексы как катализаторы.
С использованием комплексов связана возможность получения многообразных лаков и красок, прочных электрохимических покрытий, фотоматериалов, надежных средств переработки и консервирование пищи.
Огромное значение имеют комплексные соединения в аналитической химии. Они используются как в качественном, так и в количественном анализах. Такое разнообразие применений заключается в особенностях строения, структуре химических связей.
При изучении литературы я перед собой ставил следующие цели:
- иметь представление о следующих понятиях и величинах: комплексообразователь, лиганд, координационное число, дентатность лиганда, внутренняя и внешняя сферы комплексного соединения, хелатные и полиядерные комплексные соединения;
- знать особенности химической связи во внутренней сфере комплексных соединений; условия образования, разрушения и трансформации комплексных соединений; особенности строения и функции в организме миоглобина, гемоглобина, метгемоглобина, цитохромов, ионофоров;
- понимать сущность металлолигандного гомеостаза и возможностей его нарушения и восстановления; комплексонометрии и ее применения в санитарно-клиническом анализе.
1. Основные понятия и терминалогия
Многие процессы жизнедеятельности протекают с участием комплексных соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ. Характерной особенностью комплексных соединений является наличие в них химической связи, возникшей по донорно-акцепторному механизму.
Поэтому сущность реакции комплексообразования заключается во взаимодействии двух противоположностей: акцептора электронной пары и донора электронной пары.
Комплексные соединения - устойчивые химические соединения сложного состава, в которых обязательно имеется хотя бы одна связь, возникшая по донорно-акцепторному механизму.
Комплексные соединения состоят из комплексообразователя и лигандов, образующих внутреннюю сферу, и внешней сферы, состоящей из ионов, которые компенсируют заряд внутренней сферы.
Комплексообразователь (центральный атом) - атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении.
Роль комплексообразователя в основном выполняют атомы или ионы d- и f-металлов, так как они имеют много свободных атомных орбиталей на валентном уровне и достаточно большой положительный заряд ядра, за счет которого способны притягивать электронные пары доноров. Число свободных атомных орбиталей, предоставляемых комплексообразователем, определяет его координационное число. Значение координационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя. Наиболее характерными координационными числами являются 2, 4 и 6.
В комплексных соединениях комплексообразователь связан с лигандами.
Лиганды - молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем.
Обычно лигандами являются ионы или молекулы, содержащие неподеленные (свободные) электронные пары или достаточно подвижные π-электронные пары.
Лиганды-анионы: F- , Cl-, Br-, I-, OH-, NO2-, CN-, CNS-, RCOO-
фторид хлорид бромид иодид гидроксид нитрит цианид роданид карбоксилат
Лиганды-молекулы: H2O, ROH, R—O—R, CO, NH3
вода спирты эфиры монооксид углерода аммиак
По числу связей, образуемых лигандом с комплексообразователем, лиганды делятся на моно-, би- и полидентатные. Все вышеуказанные лиганды являются монодентатными, так как они выступают донорами только одной электронной пары.
К бидентатным лигандам относятся молекулы или ионы, содержащие две функциональные группы и способные выступать донорами двух электронных пар:
H2NCH2CH2NH2-OOC—COO-,H2NCH2COOмолекула этилендиамина дианион щавелевой кислоты анион аминоуксусной кислоты
Примерами полидентатных лигандов являются:
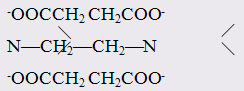
тетраанион этилендиаминтетрауксусной кислоты (EDTA)
В соответствии со своей дентатностью лиганд может образовывать соответствующее число связей с комплексообразователем.
Лиганды координируются вокруг комплексообразователя, образуя внутреннюю сферу комплексного соединения.
Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов.
Во внутренней сфере связь комплексообразователя с лигандами имеет донорно-акцепторное происхождение и является ковалентной. При записи формулы комплексного соединения его внутреннюю сферу выделяют квадратными скобками, например (NН4)С1; К3(Fе(СN)6). Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов. Внутренняя сфера может быть:
а) заряжена положительно - катион:
(Сu2+(NН3)40)z z = +2 + 4 -0 = +2
б) заряжена отрицательно - анион:
(Fe3+(CN-)6)z z = +3 + 6*(-1) = -3
в) электронейтральна:
(Fе0(СО)0)z z = 0 + 5*0 = 0
В соответствии с зарядом внутренней сферы комплексные соединения подразделяются на анионные, катионные и нейтральные комплексы.
Заряд внутренней сферы компенсируется ионами внешней сферы комплексного соединения.
Внешняя сфера комплексного соединения — это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона и связанные с ним ионной связью.
Суммарный заряд ионов внешней сферы всегда равен по значению и противоположен по знаку заряду внутренней сферы, чтобы молекула комплексного соединения была электронейтральна
(Сu(NH3)4)S04
внутренняя внешняя
сфера сфера
2. Химическая связь в комплексных соединениях и особенности их строения
В образовании химической связи во внутренней сфере комплексного соединения важнейшую роль играет донорно-акцепторное взаимодействие лигандов и комплексообразователя. При этом между ними возникает ковалентная и не сильно полярная связь. Именно этим объясняются главные особенности свойств внутренней сферы комплекса: строго определенное пространственное расположение лигандов вокруг комплексообразователя и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем. Вначале рассмотрим структуру внутренней сферы комплексного соединения. Комплексообразователь предоставляет свободные орбитали, которые формируются из незанятых s-, p- и d-атомных орбиталей внешних электронных слоев. При этом комплексообразователь предоставляет не чистые s-, р- и d- орбитали, а энергетически равноценные гибридные орбитали, оси которых определенным образом располагаются в пространстве. Это и создает структуру внутренней сферы комплекса, которая определяется типом гибридизации исходных свободных атомных орбиталей комплексообразователя.
2.1Тип гибридизации атомных орбиталей комплексообразователя и структура внутренней сферы комплексного соединения
Для комплексных соединений, содержащих во внутренней сфере различные лиганды, характерна геометрическая изомерия, наблюдаемая в тех случаях, когда при одинаковом составе внутренней сферы лиганды в ней располагаются по-разному относительно друг друга. Если два одинаковых лиганда расположены рядом, то такое соединение называется цис-изомером, если эти лиганды расположены по разные стороны от комплексообразователя, то это трансизомер. Например, комплекс (Pt(NН3)2Сl2). Геометрические изомеры комплексных соединений различаются не только по физическим и химическим свойствам, но и по биологической активности. Так, цис-изомер комплекса (Pt(NН3)2Сl2) проявляет ярко выраженную противоопухолевую активность, а трансизомер - нет. Следовательно, не только состав, но и геометрия внутренней. Эффективность донорно-акцепторного взаимодействия лиганда и комплексообразователя, а следовательно, и прочность связи между ними определяются их поляризуемостью, т. е. способностью трансформировать свои электронные оболочки под внешним воздействием. По этому признаку реагенты подразделяются на "жесткие", или малополяризуемые, и "мягкие" - легкополяризуемые. Поляризуемость атома, молекулы или иона прежде всего зависит от размера молекулы и числа электронных слоев. Чем меньше радиус и число электронов у частицы, тем менее она поляризуема. Частицы с большим радиусом и большим числом электронов, наоборот, легко поляризуются. По этим признакам можно расположить в ряд комплексообразователи и лиганды, участвующие в процессах метаболизма:
Комплексообразователи:
Увеличение мягкости комплексообразователя:
à à à à à à à à à à à à à à à à à à à
Na+, K+, Mg2+, Ca2+, Mn2+, Fe2+, Со2+, Ni2+, Сu2+, Zn2+, Сd2+,Pb2+, Hg2+.
Увеличение мягкости лиганда:
à à à à à à à à à à à à à
F-, ОН-, Н2О, Сl-, Вr-, I-, RСОO-, NR3, RSН, СN-
В соответствии с общим принципом "подобное в подобном" и спецификой донорно-акцепторного взаимодействия наиболее прочная и устойчивая к диссоциации ковалентная связь возникает между мягкими комплексообразователями и мягкими лигандами. С учетом того что белки, включая ферменты, содержат мягкие легкополяризуемые группы —СОO-, —NН2 и —SН, становится понятным, почему все "металлы жизни", относящиеся к (d-элементам, в организме встречаются практически только в виде комплексов с биосубстратами. С другой стороны, ясно, почему катионы тяжелых металлов Сd2+, Рb2+, Нg2+ сильно токсичны. Эти катионы очень "мягкие", особенно катион Нg2+, и поэтому они активно образуют прочные комплексы с жизненно важными белоксодержащими субстратами, нарушая их метаболизм. Особенно легко в реакцию комплексообразования вступают белки, содержащие группу —SН:
2RSН + 2Нg2+ è (R—S—Не—S—R) + 2Н+
Склонностью к комплексообразованию объясняется также токсичность цианидов, так как анион СN- -- очень мягкий лиганд -- активно взаимодействует с катионами d-металлов в комплексах, замещая в них биосубстраты и тем самым инактивируя эти биокомплексы. Катионы Na+ и К+ вследствие своей жесткости практически не образуют устойчивых комплексов с биосубстратами и в физиологических средах находятся в основном в виде гидратированных ионов. Катионы Мg2+ и Са2+ способны образовывать достаточно устойчивые комплексы с белками, и поэтому в физиологических средах они встречаются как в ионизованном, так и в связанном состоянии (в виде комплексов с белками, а также нерастворимых солей — фосфатов, оксалатов и уратов). Таким образом, прочность и устойчивость к диссоциации ковалентной связи между комплексообразователем и лигандами зависит от их природы, и прежде всего от способности вызывать и проявлять поляризуемость.
3. Химические свойства комплексных соединений
3.1 Диссоциация в растворах
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения — это распад комплексного соединения в растворе на комплексный ион внутренней сферы и ионы внешней сферы.
В водных растворах первичная диссоциация комплексных соединений связана с разрывом в них ионной связи, и поэтому она практически необратима и ее уравнение следует записывать так:
(Ag(NН3)2)Сl è (Ag(NН3)2)+ + Сl-
К4(Fе(СN)6) è 4К+ + (Fе(СN))4-
Возникающий в результате первичной диссоциации подвижный комплексный ион ведет себя в растворе как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. Так, в водных растворах (Аg(NН3)2)Сl не удается обнаружить присутствие катионов Аg+ и молекул NН3, в растворах К4(Fе(СN)6) - катионов Fе2+ и анионов СN-,
Вторичная диссоциация комплексного соединения -это распад внутренней сферы комплекса на составляющие ее компоненты.
Вторичная диссоциация связана с разрывом ковалентной связи, поэтому она сильно затруднена и имеет ярко выраженный равновесный характер подобно диссоциации слабых электролитов. Отрыв лигандов из внутренней сферы комплексного иона происходит ступенчато:
1-я ступень: (Ag(NН3)2)+ ßà (Ag(NН3))+ + NH3
2-я ступень: (Ag(NН3))+ ßà Ag+ + NH3
Вторичная диссоциация, как всякий равновесный процесс, характеризуется константой равновесия, причем каждая стадия имеет свою константу. Для количественной характеристики устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию, называемую константой нестойкости комплекса Kнест. Для комплексного иона (Аg(NН3)2)+ выражение константы нестойкости имеет вид: Чем меньше Кнест, тем стабильнее внутренняя сфера комплекса, т. е. тем меньше она диссоциирует в водном растворе. Значения Кнест комплексных соединений, приведенные в табл. 2, свидетельствуют о том, что в результате процесса комплексообразования происходит очень прочное связывание ионов в водных распорах, особенно ионов комплексообразователей. Следовательно, для связывания ионов из раствора можно чрезвычайно эффективно использовать реакцию комплексообразования. Особенно эффективное связывание ионов комплексообразователя происходит при реакции с полидентатными ("многозубыми") лигандами. Эти лиганды благодаря наличию в них двух и более электронодонорных центров способны образовывать несколько связей с ионами металлов, формируя устойчивую циклическую структуру. Образно говоря, ион металла захватывается полидентатным лигандом подобно жертве, попавшей в клешни рака. В связи с этим такие комплексные соединения получили названия хелатов.
Таблица 2 Константы нестойкости комплексных ионов
| Комплексный ион | Кнест |
(NH4)+/NH3+H+ | 5,4*10-10 |
(Ag(NН3)2)+/Ag++2NH3 | 9,3*10-8 |
(Cu(NH3)4)2+/Cu2++4NH3 | 2,1*10-13 |
(Zn(OH)4)2-/Zn2++4OH- | 3,6*10-16 |
(Fe(CN)6)3-/Fe3++6CN- | 1*10-31 |
(Fe(CN)6)4-/Fe2++6CN- | 1*10-36 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Оксогидроксид марганца (III) MnO(OH) и его синтез
- Химические элементы, их связи и валентность
1. Химический элемент2. Химическая связь и типы химической связи3. Закон постоянства состава вещества Пруста4. Закон кратных отноше
- Харчова добавка аспартам Е951
РефератНа тему:«Харчова добавка аспартам Е951»1. Загальна характеристика аспартамуАспартам – штучний підсолоджувач, замінник цукру (хар
- Розрахунок реактора
ЗМІСТВступ1. Теоретична частина1.1 Класифікація устаткування1.2 Вимоги до устаткування1.3 Порядок розрахунку апаратури1.3.1 Технологічний р
- Атомно-эмиссионный спектральный анализ
Цель практического эмиссионного спектрального анализа состоит в качественном обнаружении, в полуколичественном или точном количеств
- История открытия и подтверждения периодического закона Д.И. Менделеева
- Кинетика химических и электрохимических процессов
Министерство образования и науки Российской ФедерацииФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮФедеральное государственное образователь
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

