К вопросу о металлической связи в плотнейших упаковках химических элементов
«К вопросу о металлической
связи в плотнейших упаковках
химических элементов»
Г.Г.Филипенко
Гродно
АННОТАЦИЯ.
Обычно в литературе металлическая связь описывается, как осуществленная посредством обобществления внешних электронов атомов и не обладающая свойством направленности. Хотя встречаются попытки (см. ниже ) объяснения направленной металлической связи т.к. элементы кристализуются в определенный тип решетки.
В работе «К вопросу о металлической связи в плотнейших упаковках химических элементов» показано, что металлическая связь в плотнейших упаковках (ГЕК и ГЦК) между центральноизбранным атомом и его соседями в общем случае, предположительно, осуществляется посредством 9 (девяти) направленных связей, в отличие от числа соседних атомов равного 12 (двенадцати) (координационное число). Металлическая валентность элемента в его монокристалле и валентность этого элемента по кислороду, водороду- разные понятия.
Введение.
Пока невозможно в общем случае вывести из квантовомеханических расчетов кристаллическую структуру металла по электронному строению атома, хотя, например, Ганцхорн и Делингер указали на возможную связь между наличием кубическойобъемно-центрированной решетки в подгруппах титана, ванадия, хрома и наличием в атомах этих металлов валентныхd- орбиталей. Нетрудно заметить, что четыре гибридные орбитали направлены по четырем телесным диагоналям куба и хорошо приспособлены для связи каждого атома с его 8 соседями в кубической объемноцентрированной решетке. При этом оставшиеся орбитали направлены к центрам граней элементарной ячейки и, возможно, могут принимать участие в связи атома с шестью его вторыми соседями /3/ стp. 99.
Первое координационное число (К.Ч.1) “8” плюс второе координационное число (К.Ч.2) “6” равно “14”.
Попытаемся связать внешние электроны атома данного элемента со структурой его кристаллической решетки, учитывая необходимость направленных связей (химия) и наличие обобществленных электронов (физика), ответственных за гальваномагнитные свойства.
Согласно /1/ стр.20, числоZ- электроны в зоне проводимости, получено авторами, предположительно, исходя из валентности металла по кислороду, водороду и обязано быть подвергнуто сомнению, т.к. экспериментальные данные по Холлу и модулю всестороннего сжатия близки к теоретическим только для щелочных металлов. ОЦК решетка, Z=1 не вызывает сомнений. Координационное число равно 8.
На простых примерах покажем, что на одну связь у алмаза при плотности упаковки 34% и координационном числе 4 приходится 34%:4=8,5%.
У кубической примитивной решетки плотность упаковки 52% и координационное число 6 приходится 52%:б=8,66%.
У кубической объемноцентрированной решетки плотность упаковки 68% и координационное число 8 приходится 68%:8=8,5%.
У кубической гранецентрированной решетки плотность упаковки 74% и координационное число 12 приходится 74%:12=6.16%, а если 74%:9=8,22%.
У гексагональной решетки плотность упаковки 74% и координационное число 12 приходится 74%:12=6,16%, а если 74%:9=8,22%.
Очевидно, что эти 8,66-8,22% несут в себе некий физический смысл. Оставшиеся 26% кратны 8,66 и 100% гипотетическая плотность упаковки возможна при наличии 12 связей. Но реальна ли такая возможность?
Внешние электроны последней оболочки или подоболочекатома металла образуют зону проводимости. Число электронов в зоне проводимости влияет на постоянную Холла, коэффициент всестороннего сжатия и т.д.
Построим модель металла-элемента так, чтобы оставшиеся, после заполнения зоны проводимости, внешние электроны последней оболочки или подоболочек атомного остова неким образом влияли на строение кристаллической структуры (например: для ОЦКрешетки-8"валентных" электронов, а для ГЕКи ГЦК -12 или 9).
Очевидно, что для подтверждения нашей модели необходимо сравнить экспериментальные и теоретические данные по Холлу, коэффициенту всестороннего сжатия и т.д.
ГРУБОЕ, КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА ЭЛЕКТРОНОВ В ЗОНЕ ПРОВОДИМОСТИ МЕТАЛЛА - ЭЛЕМЕНТА.
ОБЪЯСНЕНИЕ ФАКТОРОВ, ВЛИЯЮЩИХ НА ОБРАЗОВАНИЕ ТИПА
РЕШЕТКИ МОНОКРИСТАЛЛА И НА ЗНАК ПОСТОЯННОЙ ХОЛЛА.
(Алгоритм построения модели)
Измерения поля Холла позволяют определить знак носителей заряда в зоне проводимости. Одна из замечательных особенностей эффекта Холла заключается, однако, в том, что в некоторых металлах коэффициент Холла положителен, и поэтому носители в них должны, видимо, иметь заряд, противоположный заряду электрона /1/. При комнатной температуре это относится к следующим металлам:: ванадий, хром, марганец, железо, кобальт, цинк, цирконий, ниобий, молибден, рутений, родий, кадмий, церий, празеодим, неодим, иттербий, гафний, тантал, вольфрам, рений, иридий, таллий, свинец /2/. Решение этой загадки должна дать полная квантовомеханическая теория твердого тела.
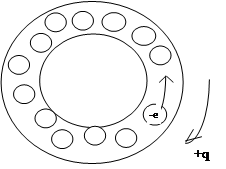
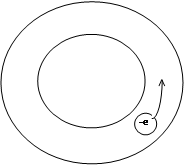
Примерно, как для некоторых случаев применения граничных условий Борна-Кармана, рассмотрим сильно упрощенный одномерный случай зоны проводимости. Вариант первый: тонкая замкнутая трубка, полностью заполненная электронами кроме одного. Диаметр электрона примерно равен диаметру трубки. При таком заполнении зоны, при локальном передвижении электрона, наблюдается противоположное движение "места" незаполнившего трубку, электрона, то есть движение неотрицательного заряда. Вариант второй: в трубке один электрон - возможно движение только одного заряда - отрицательно заряженного электрона. Из этих двух крайних вариантов видно, что знак носителей, определяемых по коэффициенту Холла, в какой-то степени, должен зависеть от наполнения зоны проводимости электронами. Рисунок 1.
 | |||||
 | |||||
 | |||||
![]()
а) б)
Рис .1. Схематическое изображение зоны проводимости двух разных металлов. (Масштабы не соблюдены).
а) - вариант первый;
б) - вариант второй.
На порядок движения электронов также будут накладывать свои условия и структура зоны проводимости, и температура, и примеси, дефекты, а для магнитных материалов и рассеяние на магнитных квазичастицах - магнонах.
Так как рассуждениянаши грубые, учитываем в дальнейшем пока только наполнение зоны проводимости электронами. Заполним зону проводимости электронами так, чтобы внешние электроны атомных остовов оказывали влияние на образование типа кристаллизационной решетки. Предположим, что число внешних электронов на последней оболочке атомного остова, после заполнения зоны проводимости, равно числу атомов соседей (координационному числу) /5/. Координационные числа ГЕК, ГЦК(гексагональной и гранецентрированной) плотнейших упаковок 12 и 18, а объемноцентрированной решетки (ОЦК)8и14/3/. Для ГЕК и ГЦК рассмотрим также число 9.
Построим таблицу с учетом вышеизложенного. Температура комнатная .
Элемент | (м3/K) | (шт.) | Z остов. (шт.) | Тип решетки | |
Натрий | Na | -2,30 | 1 | 8 | |
| Магний | Mg | -0,90 | 1 | 9 | ГЕК |
Алюминий или | Al | -0,38 | 2 | 9 | ГЦК |
Алюминий | Al | -0,38 | 12 | ГЦК | |
Калий | K | -4,20 | 1 | 8 | ОЦК |
Кальций | Ca | -1,78 | 1 | 9 | ГЦК |
| Кальций | Ca | T=737K | 2 | 8 | ОЦК |
или | Sc | -0,67 | 2 | 9 | ГЕК |
Скандий | Sc | -0,67 | 1 | 18 | ГЕК |
| Титан | Ti | -2,40 | 1 | 9 | ГЕК |
| Титан | Ti | -2,40 | 3 | 9 | ГЕК |
| Титан | Ti | T=1158K | 4 | 8 | ОЦК |
Ванадий | V | +0,76 | 5 | 8 | ОЦК |
| Хром | Cr | +3,63 | 6 | 8 | ОЦК |
или | Fe | +8,00 | 8 | 8 | ОЦК |
| Железо | Fe | +8,00 | 2 | 14 | ОЦК |
или | Fe | Т=1189K | 7 | 9 | ГЦК |
| Железо | Fe | Т=1189K | 4 | 12 | ГЦК |
Кобальт или | Co | +3,60 | 8 | 9 | ГЕК |
| Кобальт | Co | +3,60 | 5 | 12 | ГЕК |
| Никель | Ni | -0,60 | 1 | 9 | ГЦК |
Медь или | Cu | -0,52 | 1 | 18 | ГЦК |
Медь | Cu | -0,52 | 2 | 9 | ГЦК |
Цинк или | Zn | +0,90 | 2 | 18 | ГЕК |
| Цинк | Zn | +0,90 | 3 | 9 | ГЕК |
| Рубидий | Rb | -5,90 | 1 | 8 | ОЦК |
| Y | -1,25 | 2 | 9 | ГЕК | |
| Цирконий | Zr | +0,21 | 3 | 9 | ГЕК |
| Цирконий | Zr | 4 | 8 | ОЦК | |
| Ниобий | Nb | 5 | 8 | ОЦК | |
| Молибден | Mo | +1,91 | 6 | 8 | ОЦК |
| Ru | +22 | 7 | 9 | ГЕК | |
Родий или | Rh | +0,48 | 5 | 12 | |
| Родий | Rh | +0,48 | 8 | 9 | ГЦК |
| Pd | -6,80 | 1 | 9 | ||
Серебро или | Ag | -0,90 | 1 | 18 | ГЦК |
| Ag | -0,90 | 2 | 9 | ||
Кадмий или | Cd | +0,67 | 2 | 18 | ГЕК |
Кадмий | Cd | +0,67 | 3 | 9 | ГЕК |
Цезий | Cs | -7,80 | 1 | 8 | |
| La | -0,80 | 2 | 9 | ГЕК | |
Церий или | Ce | +1,92 | 3 | 9 | ГЦК |
| Церий | Ce | +1,92 | 1 | 9 | ГЦК |
Празеодим или | Pr | +0,71 | 4 | 9 | ГЕК |
| Празеодим | Pr | +0,71 | 1 | 9 | ГЕК |
Неодим или | Nd | +0,97 | 5 | 9 | ГЕК |
| Неодим | Nd | +0,97 | 1 | 9 | ГЕК |
| Гадолиний | Gd | -0,95 | 2 | 9 | ГЕК |
| Гадолиний | Gd | T=1533K | 3 | 8 | ОЦК |
| Тербий | Tb | -4,30 | 1 | 9 | ГЕК |
| Тербий | Tb | 2 | 8 | ОЦК | |
| Dy | -2,70 | 1 | 9 | ГЕК | |
| Dy | 2 | 8 | ОЦК | ||
Эрбий | Er | -0,341 | 1 | 9 | ГЕК |
| Tu | -1,80 | 1 | 9 | ГЕК | |
Иттербий или | Yb | +3,77 | 3 | 9 | |
| Иттербий | Yb | +3,77 | 1 | 9 | |
| Лютеций | Lu | -0,535 | 2 | 9 | ГЕК |
| Гафний | Hf | +0,43 | 3 | 9 | ГЕК |
| Гафний | Hf | 4 | 8 | ||
| Тантал | Ta | +0,98 | 5 | 8 | |
| Вольфрам | W | +0,856 | 6 | 8 | ОЦК |
| Рений | Re | +3,15 | 6 | 9 | ГЕК |
Осмий | Os | <0 | 4 | 12 | ГЕК |
| Иридий | Ir | +3,18 | 5 | 12 | ГЦК |
| Платина | Pt | -0,194 | 1 | 9 | ГЦК |
Золото или | Au | -0,69 | 1 | 18 | ГЦК |
| Золото | Au | -0,69 | 9 | ГЦК | |
Таллий или | Tl | +0,24 | 3 | 18 | ГЕК |
| Таллий | Tl | +0,24 | 4 | 9 | ГЕК |
| Свинец | Pb | +0,09 | 4 | 18 | ГЦК |
| Свинец | Pb | +0,09 | 5 | 9 | ГЦК |
Где: RH - Постоянная Холла (коэффициент Холла)
Z - предполагаемое число электронов, отданное одним атомом в зону проводимости
Z остов. - число внешних электронов атомного остова.
Тип решетки - тип кристаллической структуры металла при комнатной температуре в некоторых случаях для температур фазовых переходов (T).
Выводы.
Несмотря на грубые допущения, из таблицы видно, что, чем больше атом элемента отдает электронов в зону проводимости, тем положительнее постоянная Холла, и, наоборот, постоянная Холла отрицательна для элементов, отдавших в зону проводимости один-два электрона, что не противоречит выводам Пайерлса , а также просматривается связь между электронами проводимости (Z) и валентными электронами (Zостов), обуславливающими кристаллическую структуру.
Фазовые переходы элемента из одной решетки в другую можно объяснить перебросом в зону проводимости металла одного из внешних электронов атомного остова или его возвратом из зоны проводимости на внешнюю оболочку остова под воздействием внешних факторов (давление, температура) .
Пытались дать разгадку, а получили новую, довольно хорошо объясняющую физико-химические свойства элементов, загадку - это «координационное число орбиталей» = 9 (девять) для ГЦК и ГЕК. Такое частое явление числа-9 в приведенной таблице наводит на мысль, что плотнейшие упаковки недостаточно исследованы.
Методом обратного отсчета от экспериментальных значений коэффициента всестороннего сжатия к теоретическим по формулам Ашкрофта и Мермина /1/, определяя число Z, можно убедиться о его близком совпадении с приведенным в таблице 1.
Приложение 2.
Металлическая связь представляется обусловленной: как обобществленными электронами проводимости, так и “валентными” - внешними электронами атомного остова.
Литература:
1. Н.Ашкрофт, Н.Мермин "Физика твердого тела". Москва, 1979г.
2. Г.В.Самсонов "Справочник "Свойства элементов".Москва, 1976г.
3. Г.Кребс "Основы кристаллохимии неорганических соединений". Москва, l971r.
4. Я.Г.Дорфман,И.К.Кикоин "Физика металлов". Ленинград, 1933г.
5. Г.Г.Скидельский "От чего зависят свойства кристаллов". "Инженер" № 8, 1989г.
Гродно Г. Г. Филипенко
март 199бг.
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Как правильно выбрать весы для работы в лаборатории (аналитические и лабораторные весы Госметр)
- Калий и натрий
- Каменный уголь
- Керамика
КОКИНСКАЯ СРЕДНЯЯ ШКОЛАРЕФЕРАТпо химии на тему: «Керамика»Выполнил: ученик 9б класса Голубев А.М.Проверила: Макшанцева М.А.2003ПланГлина и
- Кислород и водород как химические элементы и простые вещества. Их получение и применение
Цели: обобщить и систематизировать в игровой форме знания учащихся о кислороде и водороде как химических элементах и простых веществах,
- Кобальт - химический элемент
Министерство общего и профессионального образования РФУссурийский Государственный Педагогический ИнститутТЕМА : «Кобальт – химическ
- Кокс и коксование
Кокс-серое, чуть серебристое, пористое и очень твердое вещество, более чем на 96% состоящее из углерода и получаемое при нагревании камен
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

