Инвентаризация выбросов загрязняющих веществ в атмосферу
В нынешнее время, когда происходит рост различных новых производств и следующее за этим распространение пожароопасных технологий, что значительно повышает пожароопасность объектов, в связи с чем и возрастает ответственность подразделений пожарной аварийно-спасательной службы МЧС Беларуси.
Успех тушения пожара достигается комплексом служебных и оперативно-тактических действий. Среди них особое значение имеют – умение анализировать явления, происходящие на пожаре, факторы способствующие и препятствующие распространению огня а так же тушению пожара.
Для оценки реальной обстановки и ее прогнозирования на пожаре, разработке мероприятий по тушению и управлению боевыми действиями подразделений необходимо знать закономерности развития пожара, его параметры, характеристику огнетушащих средств, возможности подразделений и многие другие вопросы пожаротушения.
Таким образом, работники пожарной аварийно-спасательной службы должны в совершенстве владеть методикой расчета сил и средств, необходимых для тушения пожаров, проектирования стандартных систем пожаротушения, проведения исследования процессов горения а так же тушения различных веществ и материалов, что изучает дисциплина «Физико-химические основы теории горения и взрыва».
I. Исходные данные для выполнения 1 части.
Наименование горючей жидкости: гептан
Химическая формула: С7H16
Смесь газов:
Н2 – 20%
С4Н10– 30%
С2Н2 – 17%
H2S – 13%
Параметры окружающей среды:
t = 40С
Р = 740 мм.рт.ст.
Коэффициент избытка воздуха:
aВ = 1,2
Характеристика вещества
Гептан - С7H16
ЛВЖ
Молекулярная масса: 100,203
Температура кипения: 98,43 0С
Температура плавления:-90,6 0С
Температура воспламенения: -4 0С
Температура вспышки: -4 0С
Температура самовоспламенения: 223 0С
Коэффициент диффузии пара в воздухе: 0,0609 см![]() /с
/с
Плотность: 683,76 кг/м3
Теплота образования: -187,7 кДж/моль.
Теплота сгорания: -4501 кДж/моль
Концентрационные пределы распространения пламени:
нижний: 1,07%
верхний: 6,7%
Температурные пределы распространения пламени:
нижний: -7 0С
верхний:26 0С
Водород Н2
Молекулярная масса: 2,016
Температура кипения: 252,8 0С
Температура самовоспламенения: 510 0С
Плотность по воздуху: 0,0695 кг/м3
Концентрационные пределы распространения пламени
нижний 4,12 %
верхний 75,0 %
Водород Н2
Молекулярная масса: 2,016
Плотность при 200С: 0,0695 кг/м3
Температура кипения: 252,8 0С
Температура самовоспламенения: 510 0С
Пропан – С3Н8
Бутан С4Н10
Молекулярная масса: 58,123
Температура кипения: -0,5 0С
Температура самовоспламенения: 4050С
Теплота сгорания:-2657 кДж/моль
Температура вспышки:-69 0С
Максимальное давление взрыва:843 кПа
Нормальная скорость распространения пламени:0,45 м/с
Концентрационные пределы распространения пламени в воздухе
нижний 1,8 %
верхний 9,1 %
Ацетилен С2Н2
Молекулярная масса: 26,04
Температура кипения: 83,6 0С
Температура самовоспламенения: 335 0С
Плотность по воздуху: 0,9107 кг/м3
Концентрационные пределы распространения пламени
нижний 2,5 %
верхний 81 %
Молекулярная масса: 44
Сероводород – Н2S
Молекулярная масса: 34,08
Плотность в воздухе: 1,19 кг/м3
a = 2,60
Температура кипения: 319,25 0С
Температура плавления: 160,9 0С
Часть 1.Аналитическая оценка параметров пожароопасности веществ
1.1 определение теоретического количества воздуха, необходимого для горения исследуемого вещества
а) Индивидуальное химическое соединение:
С7Н16+ 11![]() О2+ 11
О2+ 11![]() 3,76 N2 = 7
3,76 N2 = 7![]() CO2 +8
CO2 +8![]() H2O + 11
H2O + 11![]() 3,76 N2
3,76 N2
Определение объема 1-го киломоля воздуха при заданных условиях:
![]() м3/кмоль.
м3/кмоль.
Определение объема воздуха, необходимого для горения 1 кг горючего вещества при нормальных условиях:
![]() м3/кг.
м3/кг.
Определение объема воздуха, необходимого для горения 1 кг горючего вещества при заданных условиях:
![]()
![]()
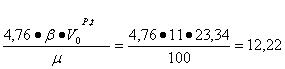 м3/кг.
м3/кг.
Определение объема воздуха, необходимого для горения 1 кг горючего вещества при нормальных условиях с учетом коэффициента избытка воздуха:
![]() м3/кг.
м3/кг.
Определение объема воздуха, необходимого для горения 1 кг горючего вещества при заданных условиях с учетом коэффициента избытка воздуха:
![]() м3/кг.
м3/кг.
б) Горение смеси газов
Н2+ 0,5О2+ 0,5![]() 3,76 N2 = H2O + 0,5
3,76 N2 = H2O + 0,5![]() 3,76 N2
3,76 N2
С4Н10+ 6,5![]() О2+ 6,5
О2+ 6,5![]() 3,76 N2 = 4CO2 + 5H2O + 6,5
3,76 N2 = 4CO2 + 5H2O + 6,5![]() 3,76 N2
3,76 N2
C2H2 + 2,5O2 + 2,5![]() 3,76N2 = 2CO2 + H2O +2,5
3,76N2 = 2CO2 + H2O +2,5![]() 3,76N2
3,76N2
H2S+ 1,5О2 + 1,5![]() 3,76N2= SО2 + H2O + 1,5
3,76N2= SО2 + H2O + 1,5![]() 3,76N2
3,76N2
Определение объема воздуха, необходимого для горения 1 м3 смеси при нормальных условиях:
![]() м3/ м3
м3/ м3
Определение объема воздуха, необходимого для горения 1 м3 смеси при заданных условиях:
![]() м3/кмоль.
м3/кмоль.
Определение объема воздуха, необходимого для горения 1 м3 смеси при нормальных условиях с учетом коэффициента избытка воздуха:
![]() 12,71·1,2 = 15,25 м3
12,71·1,2 = 15,25 м3
Определение объема воздуха, необходимого для горения 1 м3 смеси при заданных условиях с учетом коэффициента избытка воздуха:
![]() 13,24·1,2 = 15,89 м3
13,24·1,2 = 15,89 м3
1.2 Определение объема и состава продуктов горения в единице объема
а) Индивидуальное химическое соединение: С7Н16
С7Н16+ 11![]() О2+ 11
О2+ 11![]() 3,76 N2 = 7
3,76 N2 = 7![]() CO2 +8
CO2 +8![]() H2O + 11
H2O + 11![]() 3,76 N2
3,76 N2
Определение объемных долей продуктов горения в единице объема:
![]() (12,4 %)
(12,4 %)
![]() (14,2 %)
(14,2 %)
![]() (73,4 %)
(73,4 %)
Определение объема продуктов горения для 1 кг вещества при нормальных условиях:
![]() 12,62 м3/кг.
12,62 м3/кг.
Определение объема продуктов горения для 1 кг вещества при заданных условиях:
![]() 13,15 м3/кг.
13,15 м3/кг.
Определение объемов компонентов продуктов горения для 1 кг вещества при нормальных условиях:
![]() 12,62 ·0,124 = 1,56 м3/кг;
12,62 ·0,124 = 1,56 м3/кг;
![]() 12,62 · 0,142 = 1,79 м3/кг;
12,62 · 0,142 = 1,79 м3/кг;
![]() 12,62 · 0,734 = 9,26 м3/кг.
12,62 · 0,734 = 9,26 м3/кг.
Определение объемов компонентов продуктов горения для 1 кг вещества при заданных условиях:
![]() 13,15 · 0,124= 1,63 м3/кг;
13,15 · 0,124= 1,63 м3/кг;
![]() 13,15 · 0,142= 1,87 м3/кг;
13,15 · 0,142= 1,87 м3/кг;
![]() 13,15 · 0,734 = 9,65 м3/кг.
13,15 · 0,734 = 9,65 м3/кг.
Определение объема продуктов горения для 1 кг вещества при нормальных условиях с учетом коэффициента избытка воздуха:
![]() 11,72· (1,2 - 1) = 2,34 м3/кг;
11,72· (1,2 - 1) = 2,34 м3/кг;
![]() 12,62 + 2,34= 14,96 м3/кг.
12,62 + 2,34= 14,96 м3/кг.
Определение объема продуктов горения для 1 кг вещества при заданных условиях с учетом коэффициента избытка воздуха:
![]() 12,22 · (1,2 - 1) = 2,44 м3/кг;
12,22 · (1,2 - 1) = 2,44 м3/кг;
![]() 13,15 +2,44 = 15,59 м3/кг.
13,15 +2,44 = 15,59 м3/кг.
Определение объемов компонентов продуктов горения для 1 кг вещества при нормальных условиях с учетом коэффициента избытка воздуха:
![]() 1,56 м3/кг;
1,56 м3/кг;
![]() 1,79 м3/кг;
1,79 м3/кг;
![]() 9,26 +2,34 · 0,79 = 11,10 м3/кг;
9,26 +2,34 · 0,79 = 11,10 м3/кг;
![]() 2,34 · 0,21 = 0,49 м3/кг.
2,34 · 0,21 = 0,49 м3/кг.
Определение объемов компонентов продуктов горения для 1 кг вещества при заданных условиях с учетом коэффициента избытка воздуха:
![]() 1,63 м3/кг;
1,63 м3/кг;
![]() 1,87 м3/кг;
1,87 м3/кг;
![]() 9,65 + 2,44 · 0,79 = 11,57 м3/кг;
9,65 + 2,44 · 0,79 = 11,57 м3/кг;
![]() 2,44 · 0,21 = 0,51 м3/кг.
2,44 · 0,21 = 0,51 м3/кг.
Определение объемных процентов компонентов продуктов горения с учетом коэффициента избытка воздуха:
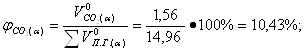
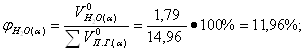
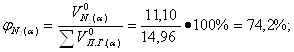
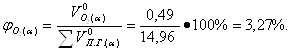
б) Смесь газов
Н2 – 20%
С4Н10 – 30%
С2Н2 – 17%
Н2S – 13%
Н2+ 0,5О2+ 0,5![]() 3,76 N2 = H2O + 0,5
3,76 N2 = H2O + 0,5![]() 3,76 N2
3,76 N2
С4Н10+ 6,5![]() О2+ 6,5
О2+ 6,5![]() 3,76 N2 = 4CO2 + 5H2O + 6,5
3,76 N2 = 4CO2 + 5H2O + 6,5![]() 3,76 N2
3,76 N2
C2H2+ 2,5O2 + 2,5![]() 3,76N2 = 2CO2 + H2O +2,5
3,76N2 = 2CO2 + H2O +2,5![]() 3,76N2;
3,76N2;
Н2S + 1,5![]() О2 + 1,5
О2 + 1,5![]() 3,76N2= SО2 + H2O +1,5
3,76N2= SО2 + H2O +1,5![]() 3,76N2.
3,76N2.
Определение объемов компонентов продуктов горения для 1 м3 смеси при нормальных условиях:
![]() 4
4![]() 0,30 + 2
0,30 + 2![]() 0,17= 1,54 м3/м3
0,17= 1,54 м3/м3
![]() 1
1![]() 0,20 + 5
0,20 + 5![]() 0,30+ 1
0,30+ 1![]() 0,17 + 1
0,17 + 1![]() 0,13= 2 м3/м3
0,13= 2 м3/м3
![]() 1,88·0,2+24,44 · 0,3 + 9,4 · 0,17+ 5,64 ·0,13 = 10,04 м3/м3
1,88·0,2+24,44 · 0,3 + 9,4 · 0,17+ 5,64 ·0,13 = 10,04 м3/м3
![]() 1
1![]() 0,13 = 0,13 м3/м3
0,13 = 0,13 м3/м3
Определение объема продуктов горения для 1 м3 смеси при нормальных условиях:
![]() 1,54+2+10,04+0,13=13,71 м3/м3
1,54+2+10,04+0,13=13,71 м3/м3
Определение объемов компонентов продуктов горения для 1 м3 смеси при заданных условиях:
![]() м3/м3
м3/м3
![]() м3/м3
м3/м3
![]() м3/м3
м3/м3
![]() м3/м3
м3/м3
Определение объема продуктов горения для 1 м3 смеси при заданных условиях:
![]() м3/м3
м3/м3
Определение объемных процентов компонентов продуктов горения без учета коэффициента избытка воздуха:
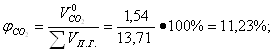
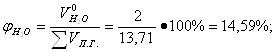
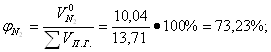
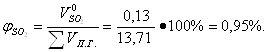
Определение объема продуктов горения для 1 м3 смеси при нормальных условиях с учетом коэффициента избытка воздуха:
![]() = 12,71
= 12,71![]() (1,2 – 1) = 2,54м3/м3
(1,2 – 1) = 2,54м3/м3
![]() 13,71+ 2,54 = 16,25 м3/м3
13,71+ 2,54 = 16,25 м3/м3
Определение объемов компонентов продуктов горения для 1 м3 смеси при нормальных условиях с учетом коэффициента избытка воздуха:
![]() 2 м3/м3
2 м3/м3
![]() 1,54 м3/м3
1,54 м3/м3
![]() 10,04 + 2,54
10,04 + 2,54![]() 0,79 = 12,05 м3/м3
0,79 = 12,05 м3/м3
![]() 2,54
2,54![]() 0,21 = 0,53 м3/м3
0,21 = 0,53 м3/м3
![]() 0,13 м3/м3
0,13 м3/м3
Определение объема продуктов горения для 1 м3 смеси при заданных условиях с учетом коэффициента избытка воздуха:
![]() = 13,24
= 13,24![]() (1,2 – 1) = 2,65м3/м3
(1,2 – 1) = 2,65м3/м3
![]() 14,29+2,65= 16,94 м3/м3
14,29+2,65= 16,94 м3/м3
Определение объемов компонентов продуктов горения для 1 м3 смеси при заданных условиях с учетом коэффициента избытка воздуха:
![]() 2,08 м3/м3
2,08 м3/м3
![]() 1,6 м3/м3
1,6 м3/м3
![]() 10,46+2,65
10,46+2,65![]() 0,79 = 12,55 м3/м3
0,79 = 12,55 м3/м3
![]() 2,65
2,65![]() 0,21 = 0,56 м3/м3
0,21 = 0,56 м3/м3
![]() 0,13 м3/м3
0,13 м3/м3
Определение объемных процентов компонентов продуктов горения с учетом коэффициента избытка воздуха:
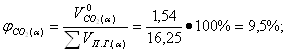
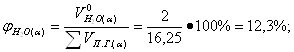
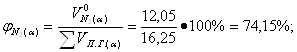
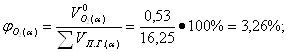
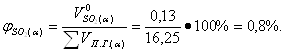
Теоретическое количество воздуха, необходимого для горения веществ, объем и состав продуктов горения.
| № п/п | Показатель | Инд. хим. соединение | Смесь газов | ||
|
|
|
| ||
| 1. |
| 11,72 | 14,06 | 12,71 | 15,25 |
| 2. |
| 12,22 | 14,66 | 13,24 | 15,89 |
| 3. |
| 12,62 | 14,96 | 13,71 | 16,25 |
| 4. |
| 13,15 | 15,59 | 14,29 | 16,94 |
| 5. |
| 1,79 | 1,79 | 2,00 | 2,00 |
| 6. |
| 1,56 | 1,56 | 1,54 | 1,54 |
| 7. |
| 9,26 | 11,10 | 10,04 | 12,05 |
| 8. |
| - | 0,49 | - | 0,53 |
| 9. |
| - | - | 0,13 | 0,13 |
| 10. |
| 1,87 | 1,87 | 2,08 | 2,08 |
| 11. |
| 1,63 | 1,63 | 1,6 | 1,6 |
| 12. |
| 9,65 | 11,57 | 10,46 | 12,55 |
| 13. |
| - | 0,51 | - | 0,56 |
| 14. |
| - | - | 0,13 | 0,13 |
| 15. |
| 14,2 | 11,96 | 14,59 | 12,3 |
| 16. |
| 12,4 | 10,43 | 11,23 | 9,5 |
| 17. |
| 73,4 | 74,2 | 73,23 | 74,15 |
| 18. |
| - | - | 0,95 | 0,8 |
| 19. |
| - | 3,27 | - | 3,26 |
Определяем QН по закону Гесса:
С7Н16+ 11![]() О2+ 11
О2+ 11![]() 3,76 N2 = 7
3,76 N2 = 7![]() CO2 +8
CO2 +8![]() H2O + 11
H2O + 11![]() 3,76 N2
3,76 N2
![]()
Из справочной литературы находим:
![]() кДж/моль;
кДж/моль;
![]() кДж/моль;
кДж/моль;
![]() кДж/моль;
кДж/моль;
![]() = 4528,2кДж/моль = 45282кДж/кг.
= 4528,2кДж/моль = 45282кДж/кг.
б) Смесь газов:
Определяем QH для Н2:
Н2+ 0,5О2+ 0,5![]() 3,76 N2 = H2O + 0,5
3,76 N2 = H2O + 0,5![]() 3,76 N2
3,76 N2
![]() кДж/моль;
кДж/моль;
![]() 242,2 кДж/моль =10812,5кДж/ м3
242,2 кДж/моль =10812,5кДж/ м3
Определяем QН для С4Н10 по формуле Менделеева:
С4Н10+ 6,5![]() О2+ 6,5
О2+ 6,5![]() 3,76 N2 = 4CO2 + 5H2O + 6,5
3,76 N2 = 4CO2 + 5H2O + 6,5![]() 3,76 N2
3,76 N2
![]() ;
;
![]()
![]() 2483160,38 кДж/моль =110855,37кДж/ м3
2483160,38 кДж/моль =110855,37кДж/ м3
Определяем QН для С2Н2 по формуле Менделеева:
С2Н2+2,5O2 +2,5 · 3,76 N2 = 2CO2 + H2O +2,5 · 3,76N2
![]() кДж/моль;
кДж/моль;
![]() 1262,75 кДж/моль = 1262750 кДж/кмоль =
1262,75 кДж/моль = 1262750 кДж/кмоль =
= 56372,77 кДж/м3
Определяем QН для Н2S по формуле Менделеева из-за отсутствия в справочной литературе значения ![]() :
:
![]() ;
;
![]() ;
;
![]() 16312,54 кДж/моль == 24760,11 кДж/м3
16312,54 кДж/моль == 24760,11 кДж/м3
Определяем QН для смеси по формуле:
![]() =10812,5
=10812,5![]() 0,2+110855,37
0,2+110855,37![]() 0,3+56372,77
0,3+56372,77![]() 0,17+24760,11
0,17+24760,11![]() 0,13= 45322,3кДж/м3
0,13= 45322,3кДж/м3
1.4 Определение теоретической температуры горения, давления взрыва паров горючего вещества
а) Индивидуальное химическое соединение:
Определяем среднее теплосодержание продуктов горения гептана:
![]() кДж/м3
кДж/м3
Принимаем Т1 по ![]() из приложения 2 и при Т1 определяем теплосодержание продуктов горения:
из приложения 2 и при Т1 определяем теплосодержание продуктов горения:
Т1 = 22000С
![]()
![]() 1,56
1,56![]() 5392,5+1,79
5392,5+1,79![]() 4405,8+9,26
4405,8+9,26![]() 3306,3=46915,02 кДж/м3
3306,3=46915,02 кДж/м3
Так как ![]() > QН, принимаем Т2 < Т1:
> QН, принимаем Т2 < Т1:
Т2 = 21000С
![]() 1,56
1,56![]() 5118,2+1,79
5118,2+1,79![]() 4166,1+9,26
4166,1+9,26![]() 3142,9=44544,97 кДж/м3
3142,9=44544,97 кДж/м3
Так как ![]() < QН <
< QН < ![]() , температуру горения определяем по методу линейной интерполяции:
, температуру горения определяем по методу линейной интерполяции:
![]() =
=
![]() 0С
0С
Определяем давление взрыва:
![]() атм.
атм.
б) Смесь газов:
Определяем среднее теплосодержание продуктов горения смеси газов:
![]()
![]() =45322,3/13,71 = 3035,78 кДж/м3
=45322,3/13,71 = 3035,78 кДж/м3
Принимаем Т1 по ![]() из приложения 2 и при Т1 определяем теплосодержание продуктов горения:
из приложения 2 и при Т1 определяем теплосодержание продуктов горения:
Т1 = 2000 0С
![]()
![]() 1,54·4847,8+2·3928,5+10,04·2979,9+0,13·4667,6=45847,6 кДж/м3
1,54·4847,8+2·3928,5+10,04·2979,9+0,13·4667,6=45847,6 кДж/м3
Так как ![]() , принимаем Т2 <Т1
, принимаем Т2 <Т1
Т2 = 1900 0С
![]() 1,54·4579,7+2·3693,5+10,04·2818,2+0,13·4529,8=43323,34 кДж/м3
1,54·4579,7+2·3693,5+10,04·2818,2+0,13·4529,8=43323,34 кДж/м3
Так как ![]() <
<![]() <
<![]() , температуру горения определяем по методу линейной интерполяции:
, температуру горения определяем по методу линейной интерполяции:
![]() =
=
![]() 1979
1979
Определяем давление взрыва:
![]() атм
атм
1.5 Определение концентрационных пределов воспламенения газов и паров горючей жидкости
а) Индивидуальное химическое соединение:
φН(В) = 100/ (а · n + в)
φН = 100/(8,684 · 11+4,679 ) =1,0%
φВ = 100/(0,768 · 11 + 6,554) = 6,66 %
б) Смесь газов:
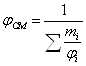
![]() 100/(8,684 · 6,5 + 4,679) = 1,64 %
100/(8,684 · 6,5 + 4,679) = 1,64 %
![]() 100/(8,684 · 0,5 + 4,679) = 11,09%
100/(8,684 · 0,5 + 4,679) = 11,09%
![]() 100/(8,684 · 2,5 + 4,679) = 3,79 %
100/(8,684 · 2,5 + 4,679) = 3,79 %
![]() 100/(8,684 · 1,5 + 4,679) = 5,65 %
100/(8,684 · 1,5 + 4,679) = 5,65 %
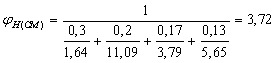 %
%
![]() 100/(1,55 · 6,5 + 0,56) =9,69 %
100/(1,55 · 6,5 + 0,56) =9,69 %
![]() 100/(1,55 · 0,5 + 0,56) =74,9 %
100/(1,55 · 0,5 + 0,56) =74,9 %
![]() 100/(1,55 · 2,5 + 0,56) =22,55 %
100/(1,55 · 2,5 + 0,56) =22,55 %
![]() 100/(1,55 · 1,5 + 0,56) =34,66 %
100/(1,55 · 1,5 + 0,56) =34,66 %
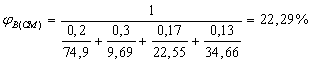
1.6 Определение температуры вспышки и температурных пределов воспламенения паров горючей жидкости
а) Определение температуры вспышки.
![]()
![]()
Определим Р по уравнению Антуана:
![]() ,
,
где А = 6,07647 (кПа);
В = 1295,405 (кПа);
СА = 219,819 (кПа) – постоянные Антуана для гептана.
Берем:
t1 = 10 0C; Т1 =283 0К
![]() = 2753 Па
= 2753 Па
Р1 · Т1 = 2753 · 283 = 779157 Па · К
Выбираем:
t2 = 2 0C; Т2 = 275 0К
![]() = 1724 Па
= 1724 Па
Р2 · Т2=1724 · 275= 487907 Па · К
Так как Т2 · Р2 < Твсп · Рвсп < Т1 · Р1, то методом линейной интерполяции определяем Твсп:
![]()
![]()
б) Определение температурных пределов воспламенения.
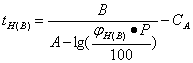
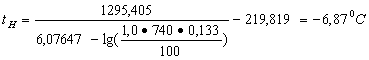

| Показатель | Размерность | Расчетные значения | Справочные значения | Относительная ошибка,% |
| Теплота горения QН | кДж/кг | 45282 | 45010 | 0,6 |
| Температура горения Тгор | 0С | 2131,1 | - | - |
| Давление взрыва Рвзр | атм. | 6,96 | - | - |
| НКПВ (φн) | % | 1,0 | 1,07 | 6,5 |
| ВКПВ (φв) | % | 6,66 | 6,7 | 0,6 |
| НТПВ (tн) | 0С | -6,87 | - | - |
| ВТПВ (tв) | 0С | 26,5 | - | - |
| Температура вспышки Твсп | 0С | 5,75 | Подобное:
Copyright © https://www.referat-web.com/. All Rights Reserved |
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

