Изучение растворимости бензоата свинца в различных растворителях
Знание растворимости какого-либо продукта изучаемого взаимодействия, в частности в нашем случае бензоата свинца, имеет большое значение при решении различных практических задач (1). Например, зная растворимость продукта в конечных растворителях можно выбрать такой из них, в котором этот продукт будет накапливаться преимущественно в твердой фазе и затем отделяться от реакционной смеси путем простого фильтрования. Такие данные нужны при выборе растворителя при перекристаллизации продукта, и также, чтобы узнать температурной ход растворимости в выбранном для такой операции растворителе. А также нужны и количественные оценки скорости растворения, которые являются одним из кинетических параметров, характеризующих химическую реакцию (2).
Кинетические данные дают возможность уточнить механизм реакции, выявить корреляционные зависимости между реакционной способностью молекул и их строением; они необходимы при проектировании реакторов для химического синтеза, при разработке новых и модернизации старых технологических процессов (3).
Первые данные кинетических экспериментов представляют собой набор концентраций химических компонентов реагирующей системы при разных значениях времени реакции. Кинетическая кривая - изменение концентрации реагента или продукта, или связанные с ним свойства системы во времени в результате протекания химического процесса (4).
Целью данной работы является получение информации о растворимости бензоата свинца в органических растворителях, таких как: этиленгликоль, ДМФА, ацетон и других.
Для достижения поставленной цели необходимо решить ряд следующих задач:
- получить первичные сведения о растворимости бензоата свинца в статистических условиях;
- изучить кинетику растворения;
- изучить температурный ход растворимости.
1. Обзор литературы
Свине́ц — элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb (лат. Plumbum). Простое вещество свинец (CAS-номер: 7439-92-1) — ковкий, сравнительно легкоплавкий металл серого цвета. (7)
Бензойная кислота впервые выделена возгонкой в 16 веке из бензойной смолы (росного ладана), отсюда и получила своё название. Этот процесс был описан у Нострадамуса (1556), а затем у Жироламо Рушелли (1560, под псевдонимом Alexius Pedemontanus) и у Blaise de Vigenère (1596)(6).
В 1832 году немецкий химик Юстус фон Либих определил структуру бензойной кислоты. Он также исследовал, как она связана с гиппуровой кислотой.
В 1875 немецкий физиолог Эрнст Леопольд Зальковский исследовал противогрибковые свойства бензойной кислоты, которая долгое время использовалась в консервировании фруктов.
Бензойная (или росноладанная), Acidum benzoicum sublimatum, Flores Benzoës — весьма распространенное в природе вещество состава С7Н6О2, или С6Н5—СООН; содержится в некоторых смолах, бальзамах, в травянистых частях и в корнях многих растений (согласно прежним, до сих пор не проверенным наблюдениям), а также в цветах Unona odoratissima (в эссенции алан-жилан, или иланг-иланг), в бобровой струе, а главным образом в бензойной смоле, или росном ладане, откуда и ее название. О продуктах сухой перегонки этой смолы есть указания еще в сочинениях, относящихся к XVI ст.; Blaise de Vigenère в своем трактате (1608 г.) "Traité du feu et du sel" первый упоминает о кристаллическом веществе из бензойной смолы, которое впоследствии было исследовано ближе и получило название Flores benzoës. Состав его окончательно установлен Либихом в 1832 г., а Кольбе предложил рассматривать его как фенилкарбоновую кислоту. Бензойная кислота может быть получена из бензола синтетически и образуется при многих реакциях, совершающихся с телами ароматического ряда. Для технических целей как исходный материал берут гиппуровую кислоту, содержащуюся в моче травоядных. Мочу быстро выпаривают до ⅓ первоначального объема, фильтруют и обрабатывают избытком соляной кислоты, причем гиппуровая кислота выделяется в кристаллическом виде. По прошествии суток кристаллы отделяют от маточного раствора и очищают повторной кристаллизацией, пока почти вовсе не исчезнет упорно удерживающийся запах мочи. Очищенную гиппуровую кислоту кипятят с соляной кислотой, причем происходит расщепление на бензойную кислоту и гликокол:
HOOC—CH2(NH(C7H5O)) + H2O = HOOC—CH2(NH2) + C6H5—COOH.
В больших количествах бензойную кислоту можно получать из толуола С6Н5—СН3, окисляя его азотной кислотой; но выгоднее (как и практикуется на заводах) брать для этой цели не толуол, а хлористый бензенил С6Н5CCl3; этот последний нагревают с водой в герметически закрытых сосудах; образующаяся таким путем кислота упорно удерживает галоидозамещенные продукты. Далее, бензойную кислоту получают нагреванием известковой соли фталевой кислоты с едкой известью; наконец, значительные количества ее остаются в виде побочного продукта при фабрикации масла горьких миндалей вследствие окисления последнего. Добытую бензойную кислоту очищают перекристаллизацией из горячей воды; обесцвечивание растворов производится посредством обработки животным углем или нагреванием со слабой азотной кислотой. Синтетически бензойную кислоту получил Кекуле, действуя угольной кислотой на бромбензол в присутствии металлического натрия:
C6H5Br + 2Na + CO2 = C6H5CO2Na + NaBr.
Фридель и Крафтс приготовили ее прямо из бензола и угольной кислоты в присутствии хлористого алюминия. Чистая бензойная кислота представляет бесцветные одноклиномерные иглы или таблички, уд. веса 1,2 (при 21°), не изменяющиеся на свету, тогда как полученная сублимацией из росного ладана желтеет спустя некоторое время вследствие разложения содержащегося в ней эфирного масла. Вещество плавится при 121,°4 Ц., кипит при 249°,2 без разложения и возгоняется ниже температуры кипения; не имеет запаха. Пары его действуют раздражающим образом на слизистые оболочки дыхательных органов. С парами воды кислота летит уже ниже 100°, а потому водные растворы ее нельзя сгущать посредством выпаривания. 1000 ч. воды растворяют при 0° 1,7 вес. ч., а при 100° 58,75 ч. Б. кислоты. Так же хорошо растворима она в алкоголе, эфире, хлороформе, эфирных и жирных маслах.
Бензойная кислота и ее соли обладают высокой бактерицидной и бактериостатической активностью, резко возрастающей с уменьшением рН среды. Благодаря этим свойствам, а также нетоксичности бензойную кислоту применяют:
- консервант в пищевой промышленности (добавка 0,1% кислоты к соусам, рассолам, фруктовым сокам, джемам, мясному фаршу и др.);
- в медицине при кожных заболеваниях как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а её натриевую соль – как отхаркивающее средство.
Кроме того, бензойную кислоту и её соли используют при консервировании пищевых продуктов (пищевые добавки E210, E211, E212, E213). Эфиры бензойной кислоты (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности.
Бензойную кислоту используют в производстве:
- фенола;
- капролактана;
- бензоилхлорида;
- добавка к алкидным лакам, улучшающая блеск, адгезию, твердость и химическую стойкость покрытия.
Большое практическое значение имеют соли и эфиры бензойной кислоты (бензоаты).
Бензоат свинца применяется как пластификатор целлюлозы и других полимеров, очищенные продукты могут быть использованы в качестве эссенции и в области медицины (коклюш, астма). Также применяется в парфюмерии в качестве фиксатора ароматов и для стабилизации других важных ингредиентов.
2. Экспериментальная часть
2.1 Описание методики изучения растворимости
1. Приготовить 10 растворов кислоты в соответствующем растворителе. Проверить концентрацию полученных растворов, полученные значения внести в таблицу.
2. Получить первичные сведения о растворимости солей металлов следующим образом. В хорошо закрывающиеся емкости внести порошок соли и раствор кислоты в растворителе. Содержимое емкости интенсивно встряхнуть, а сами емкости поместить под тягой. Наблюдать и фиксировать все происходящие изменения. Встряхивание проводить два раза в сутки. После того как видимые изменения в системе прекращаются, из отстоянной жидкой фазы отобрать пробу, в которой определить содержание соли соответствующим методом (8).
3. Изучение кинетики растворения провести следующим образом: в колбу, с помещенной в него телом вращения, или стеклянный реактор бисерной мельницы вертикально типа ввести одновременно соль, раствор кислоты в соответствующем растворителе (исходя из предварительно определенного значения растворимости) и бисер. Включить перемешивание, этот момент принять за начало процесса. По ходу процесса через определенные промежутки времени отбирать пробы массой -0,1 г, отфильтровать при необходимости и взвесить. Количественно перенести в стеклянный стакан для определения концентрации соли. Результаты занести в таблицу. По полученным данным построить кинетические кривые растворения соли в координатах C = f(x)(9).
4. Изучение температурного хода растворения.
В результате получить данные о растворимости оксалата меди в органических растворителях с помощью различных методов. И дать оценку растворимости такой соли.
2.2 Описание методики анализа соединений свинца
Для определения соединений бензоата свинца, из пробы реакционной смеси содержащую соль свинца, отбирают 0.5 грамма раствора, добавляют 10мл аммиачно-тартатного буфера, щепотку аскорбиновой кислоты, эриохром черный т – окраска приобретет вино-красный оттенок и титруем трилоном, до появления синего оттенка(10).
Расчет ведем по формуле(1):
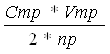
(PbА2)= , моль/л
где Vпр - объем реакционной смеси взятый на титрование, мл
Cтр – концентрация трилона (0, 05), г-экв/л
Vтр – объем трилона пошедший на титрование, мл
2.3 Описание установки
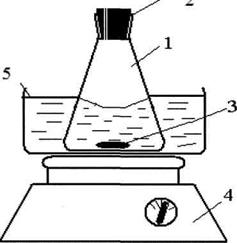
Для исследования кинетики растворения бензоата свинца использовали установку, представленную на рисунке 2.
Затем, для разделения твердой и жидкой фаз использовалась центрифуга, в которую были помещены пробы, взятые через определенный промежуток времени, состоящие из смеси бензойной кислоты с растворителем, содержащей изучаемую соль, то есть бензоат свинца.
|
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Преимущества и недостатки способов очистки коксового газа от сероводорода
Канд. техн. наук Е. Т. КОВАЛЕВ, И. М. ДАВИДЕНКО (НПО «Коксохимия»)В мире в настоящее время используют более 15 вариантов технологий очистки
- Живой свет морей
- Клетка единая, но делимая
Ю.М. ВАСИЛЬЕВ, д.м.н., профессор, член-корреспондент РАН, Московский государственный университет им. М.В. Ломоносова Общеизвестно, что к
- Абелия
К роду Абелия (Abelia) относится около 30 видов листопадных и вечнозеленых кустарников или небольших деревьев. Они отличаются характерными
- Разработка и исследование процесса выделения нафталина и других летучих веществ из конденсата вакуум-содовой сероочистки
А.Ф.Гре6енюк (ДонГТУ), Ю.И.Елисеев, П.Ф.Касторный, А.В.Квасов, В.И.Милютин (Авдеевский коксохимический завод) и В.Ф.Шипицын (Коксохимстанция)
- Производство ацетилена
- Равновесные и поляризационные диаграммы потенциал-pH
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.