Изучение обменных свойств мягких контактных линз по отношению к ципрофлоксацину
Одной из важных проблем в современной медицине, имеющей большое социальное значение, является лечение органов зрения. В частности, рассматриваются вопросы о совместимости и эффективности мягких контактных линз с антибиотиками, применяемыми при этом лечении.
Мягкие контактные линзы (МКЛ) были созданы чехословацкими учеными Вихтерле и Лимом в 1960 году. Контактные (т.е. надевание непосредственно на глазное яблоко под веки) линзы получили в последнее время большое распространение для улучшения зрения при близорукости, дальнозоркости, астигматизме. В разных странах ими пользуется от 2 до 10% населения. Мягкие контактные линзы (МКЛ) изготавливают из гидрофильных полимеров, которые легко поглощают воду до определенной максимальной концентрации, уровень которой определяется такими физическими параметрами как температура, давление, рН и др. Гидрогелем называется состояние полимерного каркаса с включенной в него водой. Полимерный каркас может содержать различные гидрофильные группы (гидроксильные, амидные, лактамные, карбоксильные) и поперечные сшивки, которые и определяют равновесное состояние наполненного водой гидрогеля.
В основном МКЛ используют для коррекции зрения, для усиления или изменения цвета глаз и как бандажное средство в офтальмотерапии (1). Известно также, что МКЛ, пропитанные лекарственными веществами, продлевают их лечебное действие и вследствие этого являются более эффективным методом введения препаратов в глаз по сравнению с инстилляционным. Возможность применения МКЛ в качестве средства для введения лекарственных веществ в орган зрения зависит от сорбции данного вещества материалом линзы и последующей десорбции (2,3).
Человек постоянно совершенствует разнообразные материалы, ищет новые области их применения. С полным основанием это относится и к полимерным гидрогелям. В проблемной научно-исследовательской лаборатории КемГУ разработан высокогидрофильный полимерный материал для МКЛ Кемерон-1, признанный соответствующим зарубежным аналогам и рекомендованный к промышленному производству (4). Кемерон-1 представляет собой сополимер на основе N-винилпирролидона и метилметакрилата, синтезированный в присутствии дивинилового сшивающего агента методом радиационной (гамма-излучение 60Co) блочной полимеризации.
Помимо традиционных направлений применения линз из этого материала предствляет интерес их использование для непосредственного введения лекарственных препаратов в орган зрения, в том числе антибиотиков фторхинолонового ряда. В настоящее время известны фторхинолоны четырех поколений. Они обладают широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой (5). «Золотым стандартом» фторхинолонов II поколения стал ципрофлоксацин (6).
Целью дипломной работы является изучение транспортных свойств МКЛ из материала «Кемерон» по отношению к антибиотику фторхинолонового ряда – ципрофлоксацину.
В работе были поставлены следующие задачи:
1. Поиск и апробация чувствительной методики для определения ципрофлоксацина.
2. Исследование обменных свойств МКЛ из материала «Кемерон» по отношению к ципрофлоксацину путем изучения динамики сорбции ципрофлоксацина МКЛ из препарата и динамики десорбции из МКЛ в воду или физраствор.
2. Литературный обзор
2.1 Химическая природа антибиотиков
К настоящему времени выделено и описано достаточно много антибиотиков, причем для многих из них установлена химическая структура. Для идентификации антибиотиков с неизвестной структурой используют особенности их действия и физико-химические свойства (5). Согласно имеющейся информации, антибиотики в химическом отношении представляют очень гетерогенную группу (6).
1. Молекулярная масса антибиотиков варьируется от 150 до 5000.
2. Молекулы одних антибиотиков состоят или только из углерода и водорода, или чаще из углерода, кислорода, водорода и азота; другие антибиотики содержат также атомы серы, фосфора или галогенов.
3. В молекулах антибиотиков представлены почти все функциональные группы, известные в органической химии (гидроксильная, карбоксильная, карбонильная, азотсодержащие функциональные группы и т. д.), а также структуры, характерные для органических веществ (алифатические и алициклические цепи, ароматические кольца, гетероциклы, углеводы, полипептиды и т. д.).
Общим для всех антибиотиков является то, что это твердые органические вещества. Почему практически отсутствуют жидкие антибиотики – не вполне ясно. При комнатной температуре в твердом состоянии находятся обычно высокомолекулярные вещества или вещества, молекулы которых содержат несколько полярных групп (6). Обычно антибиотики действительно содержат полярные группы, участвующие во взаимодействии с макромолекулами бактерий, что и приводит к подавлению роста последних. Возможно, именно поэтому даже низкомолекулярные антибиотики являются твердыми веществами (7).
2.2 Механизм действия антибиотиков
Антибиотики подавляют рост чувствительных к ним микроорганизмов, ингибируя функции макромолекул, необходимых для жизнедеятельности клетки, таких как ферменты или нуклеиновые кислоты (16). Молекула антибиотика связывается со специфическим участком макромолекулы - мишени, образуя нефункциональный молекулярный комплекс.
Чтобы определить механизм действия антибиотика, нужно выявить макромолекулу - мишень и установить ее функции. Обычно легче выяснить, какая функция нарушена, чем определить, какая макромолекула является мишенью (8). Поэтому считают, что антибиотики подавляют синтез клеточной стенки, белка или РНК, репликацию ДНК или функционирование мембран, в зависимости от того, что является первичным эффектом антибиотика.
Некоторые антибиотики представляют собой антиметаболиты, действующие по типу конкурентных ингибиторов (6). По структуре они близки к нормальным метаболитам, таким как аминокислоты или коферменты, и, связываясь с ферментом, для которого нормальный метаболит является субстратом или кофактором, инактивируют его.
Избирательность действия антибиотиков и, следовательно, причина подавления роста только определенных типов клеток обычно связаны с механизмом их действия (7).
2.3 Химическая модификация антибиотиков
У сравнительно сложных веществ, к которым относятся и некоторые антибиотики, определенные компоненты структуры или химические группировки непосредственно участвуют в образовании комплекса с макромолекулой - мишенью. Другие структурные компоненты или группировки не принимают прямого участия во взаимодействии с мишенью, и их можно модифицировать без значительного изменения активности препарата (7).
Благодаря таким изменениям структуры удается модифицировать некоторые физико-химические свойства молекулы антибиотика, в частности растворимость в воде или липидах, что сильно сказывается на фармакокинетике препарата и, следовательно, на возможности его использования в лечебных целях (6). Те же самые свойства (растворимость в воде или липидах и т. д.) могут влиять на спектр действия препарата, поскольку от них зависит его способность проникать в клетку.
Изменения свойств молекулы, которые не влияют на ее активность, на молекулярном уровне, т. е. на способность антибиотика образовывать комплекс с макромолекулой в бактериальной клетке, имеют важное значение для биологической активности in vivo и для практической ценности этого антибиотика (4). Более или менее значительные модификации исходной молекулы могут сопровождаться существенными изменениями ее способности проникать через клеточную мембрану, поступать в ткани организма хозяина, а также восприимчивости к действию различных ферментов (1).
В 50-х годах 20 века к возможности значительного улучшения лечебных свойств антибиотиков с помощью химической модификации природных продуктов относились весьма скептически (7). Эти взгляды основывались на безуспешности попыток модификации препаратов, применявшихся в то время, и на убеждении, что невозможно повысить активность природного продукта.
Первый аргумент был совершенно неправомочен, поскольку при этом подразумевалось, что все антибиотики являются представителями одного класса, и свойство, справедливое только для некоторых случаев, приписывалось всем антибиотикам. Что же касается высказывания о том, что природу невозможно улучшить, то это действительно так, если речь идет о продукте, являющемся результатом естественного отбора, действующего в течение миллионов лет (8). Однако в случае антибиотиков этот естественный отбор так или иначе был направлен на выживание организма - продуцента в природной среде обитания, но, конечно, не на повышение терапевтической активности антибиотика, а именно это последнее и является для нас мерой «улучшения» (7).
Из всего сказанного ясно, почему получили столь широкое развитие работы по химической модификации природных антибиотиков, сыгравшие в последние годы важную роль в создании новых терапевтических препаратов. Действительно, сегодня многие антибиотики, применяемые в клинике, являются полусинтетическими (6).
2.4 Фторхинолоны как один из классов антибиотиков нового поколения
Принципиально новым классом сильнодействующих антибактериальных препаратов являются соединения фторхинолонового ряда.
В конце ХХ столетия среди основных химиотерапетических средств для лечения инфекций одно из важных мест заняли фторхинолоны – большая группа высокоэффективных антимикробных препаратов с широкими показаниями к применению (5). Термин «фторхинолоны» (наиболее точно – 6-фторхинолоны) характеризует принадлежность препаратов к классу хинолонов (или родственным по структуре соединениям) с наличием атома фтора в молекуле, причем в строго определенном положении 6 хинолонового цикла.
Все препараты класса хинолонов, независимо от наличия или отсутствия фтора в молекуле, объединены единым механизмом действия на микробную клетку: их основной мишенью является ДНК-гираза – один из ключевых ферментов клетки, определяющий нормальный процесс биосинтеза ДНК и деления клетки. Поэтому данный класс веществ часто обозначают общим термином - ингибиторы ДНК-гиразы (8).
В медицинской химии существует более широкое понятие класса хинолонов, структурной основой которого является фрагмент 1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Начало этому классу химиопрепаратов было положено в 1962 году с внедрением в медицинскую практику налидиксовой кислоты (невиграмона), а затем ее близких структурных аналогов: оксолиниевой, пиромидиевой и пипемидиевой кислот (6).
Представители первого поколения хинолонов:
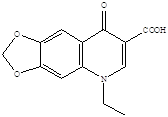
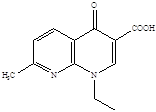
Налидиксиновая кислота Оксолиниевая кислота (грамурин) (6)
(невиграмон, неграм)
Нефторированные хинолоны (первое поколение) имеют ограниченный спектр действия с преимущественной активностью в отношении некоторых грамотрицательных бактерий, главным образом из группы энтеробактерий. Особенности фармакокинетики нефторированных хинолонов позволяют применять эти препараты при чувствительном возбудителе только для лечения инфекций мочевыводящих путей и некоторых кишечных инфекций (16). Достаточно быстрое развитие лекарственной резистентности к нефторированным хинолонам у клинических штаммов бактерий существенно ограничивает их применение в клинике, хотя некоторые препараты этой группы до сих пор представлены на фармацевтическом рынке (например, налидиксовая кислота, оксолиниевая кислота, пипемидиевая кислота) (6).
Принципиально новые по степени активности, широте антимикробного спектра и особенностям фармакокинетики соединения получены при введении в молекулу хинолона атома фтора в положение 6 цикла и строго определенных заместителей в положение 7 (шестичленный пиперазинильный радикал или его аналоги) (7). Относительно невысокая токсичность полученных соединений позволила разработать серию высокоактивных антимикробных препаратов, некоторые из которых уже прочно вошли в мировую клиническую практику и определили формирование важнейшей группы антимикробных препаратов – фторхинолонов (8).
Второе поколение хинолонов представлено широким рядом производных (норфлоксацин, пефлоксацин, ципрофлоксацин и др.).
Представители второго поколения хинолонов – монофторированные производные:
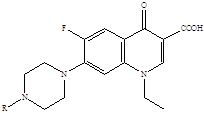
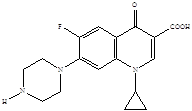
R = H норфлоксацин (нолицин, норбактин); Ципрофлоксацин (ципробай,
R = CH3 пефлоксацин цифран, ципринол, ципролет)
Они появились на мировом фармацевтическом рынке в середине 80-х годов и быстро завоевали признание как препараты с исключительно высоким уровнем активности (в десятки и сотни раз превосходящей ![]() -лактамные антибиотики) и широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой и практически полным отсутствием резистентности (22). Благодаря своим уникальным характеристикам фторхинолоны сразу привлекли внимание ведущих фармацевтических фирм, которые в сжатые сроки наладили промышленный выпуск серии (более 20 наименований) клинически наиболее важных фторхинолонов. О бурном развитии научных исследований в этой области можно судить по числу синтезированных веществ фторхинолонового ряда, которое уже превысило отметку 10 000 (5). «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций (6).
-лактамные антибиотики) и широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой и практически полным отсутствием резистентности (22). Благодаря своим уникальным характеристикам фторхинолоны сразу привлекли внимание ведущих фармацевтических фирм, которые в сжатые сроки наладили промышленный выпуск серии (более 20 наименований) клинически наиболее важных фторхинолонов. О бурном развитии научных исследований в этой области можно судить по числу синтезированных веществ фторхинолонового ряда, которое уже превысило отметку 10 000 (5). «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций (6).
Следующее поколение хинолонов представлено молекулами спарфлоксацина, ломефлоксацина и темафлоксацина, содержащими два и три атома фтора.
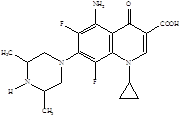
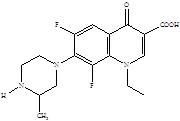
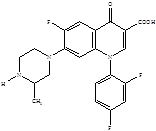
Ломефлоксацин Спарфлоксацин Темафлоксацин (5)
(максаквин)
Дальнейшие модификации химической структуры привели к появлению соединений, активных и в отношении анаэробов. Однако многие из вновь разработанных препаратов не достигли пациентов или были быстро отозваны с рынка вследствие развития тяжелых нежелательных реакций (7). Одним из новых препаратов, который стал успешно применяться, явился моксифлоксацин – представитель IV поколения фторхинолонов.
Наиболее важными в молекуле фторхинолонов, отвечающими за их антимикробные свойства, являются группы, занимающие позиции 1, 7 и 8. Циклопропиловая группа в положении 1 обеспечивает активность против грамотрицательных микроорганизмов (6). Присоединение дополнительного кольца в позиции 7 придает высокую активность по отношению к грамположительной микрофлоре, включая пневмококки.
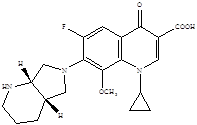
Химическая структура моксифлоксацина:
1-Циклопропил-7((S,S)-2,8-диаза-бицикло(4.3.0.)-8-ил)-6-фтор-1,4-дигидро-4-оксо-3-хинолкарбоновой кислоты гидрохлорид
Добавление в структуру молекулы метоксигруппы в положении 8 привело к повышению активности в отношении анаэробов без увеличения риска потенциальной фототоксичности.
Классификация фторхинолонов (6) представлена в таблице П.1.1..
2.4.1 Отличие фторхинолонов от других групп антибактериальных
агентов
Сравнение антибактериальной активности фторхинолонов с ![]() -лактамными (пенициллинами, цефалоспоринами) и другими антибиотиками свело эти две совершенно разные по своему происхождению группы антибактериальных агентов в рассмотрение в одни и тех же книгах (8). Следует подчеркнуть, однако, что фторхинолоны не имеют отношения к биотехнологии и являются продуктами синтетическими. Это отличает их от полусинтетических антибиотиков, отдельные фрагменты которых получают с участием микроорганизмов (5).
-лактамными (пенициллинами, цефалоспоринами) и другими антибиотиками свело эти две совершенно разные по своему происхождению группы антибактериальных агентов в рассмотрение в одни и тех же книгах (8). Следует подчеркнуть, однако, что фторхинолоны не имеют отношения к биотехнологии и являются продуктами синтетическими. Это отличает их от полусинтетических антибиотиков, отдельные фрагменты которых получают с участием микроорганизмов (5).
Различен и механизм действия фторхинолонов. Соединения этого класса обладают способностью проникать через клеточные мембраны и селективно воздействовать на размножение бактерий путем ингибирования бактериальной ДНК-топоизомеразы II (ДНК-гиразы) – фермента, отвечающего за разрыв и восстановление суперскрученной спирали ДНК. Согласно современным представлениям, молекулы хинолона связываются с ДНК, образуя сложный комплекс из четырех молекул фторхинолона, двойной спирали ДНК- и ДНК-гиразы (6). Образование такого комплекса происходит в тот момент, когда гираза осуществляет разрезание обеих цепей ДНК. Тем самым нарушается процесс размножения бактерий. Следует отметить, что механизм действия фторхинолонов принципиально отличается от механизмов действия других групп бактериальных препаратов: пенициллинов, цефалоспоринов, аминогликозидов, сульфамидов, что особенно важно для лечения инфекционных заболеваний, вызванных резистентными к этим препаратам штаммами бактерий (8).
2.4.2 Механизм действия фторхинолонов
Все фторхинолоны действуют бактерицидно благодаря ингибированию ферментов класса топоизомераз – ДНК-гиразы (топоизомеразы II) и топоизомеразы IV (16).
Эти ферменты выполняют строго определенные функции в процессе формирования пространственной структуры молекулы ДНК при ее репликации: ДНК-гираза катализирует расплетение (отрицательиую суперспирализацию) нитей ДНК, а топоизомераза IV участвует в разъединении (декатенации) ковалентно-замкнутых кольцевых молекул ДНК. Ингибированне этих ферментов нарушает процессы роста и деления бактериальной клетки, что приводит к ее гибели (23).
Основной мишеныо в грамположительных микроорганизмах преимущественно является топоизомераза IV, а в грамотрицательных – ДНК-гираза (6).
Механизмы резистентности
Развитие резистентности связано с мутациями в генах gyrAи gyrB(кодируют ДНК-гиразу), раrС (grlA) и _are (grlB) – кодируют топоизомеразу IV, а также в гене norА (кодирует мембранные белки, которые участвуют в активном выбросе – эффлюксе – фторхинолонов из клетки). Высокий уровень резистентности возникает вследствие сочетания этих механизмов (7).
Мутации,возникающие в генах gyrA, gyrB, раrС и раrЕ, достаточно значительно влияют на активность фторхинолонов I, II, III поколений, а на активность моксифлоксацина – фторхинолона IV поколения – меньше. Например, мутации у S. Aureusвгенах, кодирующих топоизомеразы,меньше снижают активность моксифлоксацина, чем ципрофлоксацина, офлоксацина, левофлоксацина, спарфлоксацина (8).
У Escherichiacoliдвойнаямутация гена gyrAприводит к снижению IC150 норфлоксацниа, ципрофлоксацина и спарфлоксацина по сравнению с таковой у немутировавшего типа более чем в 500 раз, в то время как для моксифлоксацина этот показатель не превышает 12 раз (5).
Эффлюкс (мутация в гене nor А) значительно меньше влияет на активность гидрофобных препаратов, таких, как моксифлоксацин, по сравнению с таковой у гидрофильных препаратов, например у ципрофлоксацина.
При применении моксифлоксацинавероятность развития резистентности у грамположительных микроорганизмов, возможно, ниже, чем при применениидругих фторхинолонов, что связано с его высоким сродствомкак к топоизомеразе IV, так и к ДНК-гиразе (6).
2.4.3 Применение фторхинолонов и связанные с этим проблемы
Фторхинолоны хорошо сочетаются с пенициллинами и аминогликозидами. Допустимо совместное применение с макролидами и тетрациклинами, хотя может проявляться ослабление их действия (6).
Не рекомендуется назначать фторхинолоны с нестероидными противовоспалительными средствами и нельзя сочетать с метилксантинами – кофеином и, особенно, теофиллином, т.к. возможны судороги (8).
Из других побочных явлений – раздражающее воздействие на желудочно-кишечный тракт (при пероральном назначении). Возможно негативное влияние на печень, ЦНС, появление кожно-аллергических сыпей, но у небольшого количества пациентов (7). В целом фторхинолоны малотоксичные соединения. Применяются при многих бактериальных инфекциях и в хирургической практике.
На сегодняшний день синтезировано достаточное количество фторхинолонов, таких как: ципрофлоксацин, эноксацин, норфлоксацин, офлоксацин, ломефлоксацин, флероксацин, перфлоксацин, энрофлоксацин и др. Зарубежные фирмы выпускают фторхинолоны специально для ветеринарии в форме премиксов и растворов с 5 и 10% содержанием АДВ (17).
Например, энрофлоксацин (энроксил) активен в отношении грамположительной и грамотрицательной микрофлоры, в т.ч. микоплазм. Препарат малотоксичен, LD50 для белых крыс 5000 мг/кг. Собаки переносят дозы в 40 раз превышающие терапевтические. После введения терапевтической дозы препарат циркулирует в организме в лечебных концентрациях уже через 0,5 ч, сохраняясь на этом уровне более 24 ч (9).
Назначают телятам, поросятам, цыплятам, плотоядным при инфекциях дыхательных путей, желудочно-кишечного тракта, мочевыводящих путей, кожи в форме инъекций (внутримышечно) и в форме порошка (с водой) в дозах 2,5-5 мг/кг, однократно. Выпускается в форме 5% растворов и 5% порошка (9).
В результате неправильного применения, увеличения лечебной дозы, а так же несоблюдения сроков ожидания, остаточные количества фторхинолонов могут попадать в молоко, мясо, яйца, предназначенные в пищу людям. Это является причиной развития дисбактериозов, пищевых аллергий, повышения устойчивости патогенных микроорганизмов (10). Кроме того, наличие следовых количеств фторхинолонов в продуктах питания является причиной развития функциональных нарушений со стороны центральной нервной системы, особенно у детей, что проявляется судорогами, расстройствами слуха и зрения (9).
Согласно европейскому законодательству (Директива ЕС 2377/90) установлены максимально допустимые уровни фторхинолонов в продукции животного происхождения для 2-х соединений этой группы: энрофлоксацина и ципрофлоксацина (10).
Согласно Постановлению Минсельхозпрода РБ от 16.12.2005 г. № 78 об утверждении «Правил осуществления контроля за содержанием вредных веществ и их остатков в живых животных и продукции животного происхождения при экспорте их в страны Европейского Союза» энрофлоксацин включен в перечень фармакологических веществ, на который установлен максимально допустимый уровень остатков (10).
2.5 Методы определения ципрофлоксацина – антибиотика фторхинолонового ряда
2.5.1 Определение содержания ципрофлоксацина методом ВЭЖХ
Ципрофлоксацин методом ВЭЖХ определяют в таблетках и глазных каплях. Данным методом можно определить 90 - 110% активного вещества от заявленного количества. Разделение проводят на колонке SS 4,0 мм ![]() 250 мм, C18 (L1) в системе фосфорная кислота, доведенная до pH = 3 триэтиламином – вода – ацетонитрил при скорости потока 1,5 мл/мин. Детектирование - в УФ свете при длине волны 278 нм (11).
250 мм, C18 (L1) в системе фосфорная кислота, доведенная до pH = 3 триэтиламином – вода – ацетонитрил при скорости потока 1,5 мл/мин. Детектирование - в УФ свете при длине волны 278 нм (11).
2.5.2 Определение ципрофлоксацина методом ТСХ
Разделение проводят на пластинках, покрытых слоем смеси силикагеля (0,25 мм). GF 254 (20 ![]() 20 см) в присутствии стандарта. Подвижная фаза: метиленхлорид : метанол : аммония гидроксид : ацетонитрил в соотношении 4 : 4 : 2 : 1. детектирование проводится в УФ свете при 254 и 366 нм. Основное пятно на хроматограмме испытуемого раствора по величине Rf и интенсивности должно соответствовать основному пятну на хроматограмме стандартного раствора (11).
20 см) в присутствии стандарта. Подвижная фаза: метиленхлорид : метанол : аммония гидроксид : ацетонитрил в соотношении 4 : 4 : 2 : 1. детектирование проводится в УФ свете при 254 и 366 нм. Основное пятно на хроматограмме испытуемого раствора по величине Rf и интенсивности должно соответствовать основному пятну на хроматограмме стандартного раствора (11).
2.5.3 Определение антибиотиков фторхинолонового ряда с помощью тест – систем RIDASCREEN Enro/Cipro
Тест-система RIDASCREEN Enro/Cipro предназначена для количественного определения ципрофлоксацина и энрофлоксацина в продуктах животного происхождения методом конкурентного иммуноферментного анализа.
| Вид продукта | Предел обнаружения | Извлекаемость, % |
| Молоко | 1 мкг/кг | 84% |
| Мясо | 10 мкг/кг | 87% |
| Рыба | 10 мкг/кг | 85% |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Иммунитет и его место в патологии
ҚАЗАҚСТАН РЕСЕЙ МЕДИЦИНА УНИВЕРСИТЕТІКАФЕДРА МИКРОБИОЛОГИИ, ИММУНОЛОГИИ С КУРСОМ ЭПИДЕМИОЛОГИИ, ИНФЕКЦИОННЫХ И ТРОПИЧЕСКИХ БОЛЕ
- Иммунологическая толерантность
- Иммунология опухолей
РЕФЕРАТИммунология опухолей2009Идея о том, что опухоли могут вызывать иммунный ответ, была высказана уже очень давно. Еще в начале века Па
- Имунномодулирующие свойства лекарственных растений
- Инородные тела в различных частях организма
Министерство образования Российской ФедерацииПензенский Государственный УниверситетМедицинский ИнститутКафедра ХирургииРефератна
- Институт акушерства и гинекологии им. Д.О. Отта
- Интерпретация показателей электрокардиограммы
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

