Диаграммы состояния трехкомпонентных систем
Министерство общего и профессионального образования
Российской Федерации
Уральский Государственный Университет
химический факультет
кафедра высокомолекулярных соединений.
Реферат:
Диаграммы состояния трехкомпонентных систем.
Исполнитель:
студент IV курса Белоусов М.В.
Руководитель:
профессор, д.х.н. Вшивков С.А.
Екатеринбург
1999 г.
Фазовые диаграммы трехкомпонентных систем.
Добавление третьего компонента к бинарной системе всегда влияет на взаимную растворимость данных двух компонентов. При этом критическая температура бинарной системы может возрастать или уменьшаться, т.е. взаимная растворимость первых двух компонентов может улучшаться или ухудшаться. Это зависит от способности третьего компонента растворяться в первых двух. Допустим , что компоненты А и Б ограниченно смешиваются. Если третий компонент С в равной степени растворим в компонентах А и Б, то взаимная смешиваемость компонентов А и Б улучшается., ВКТР понижается и НКТР повышается. Если третий компонент растворим в компоненте А значительно лучше чем в компоненте Б (или наоборот), то взаимная растворимость А и Б ухудшается, ВКТР повышается, а НКТР понижается. Проиллюстрируем это следующим примером. Система фенол-вода обладает ВКТР, равной 338К. Добавление 1% нафталина, который растворяется в феноле и не растворяется воде, приводит к повышению ВКТР до 353 К; добавление 1% олеата натрия, хорошо растворимого и в воде и в феноле, понижает Tc до 316К.
Аналогичная картина наблюдается при добавлении неорганических солей и кислот к двум ограниченно смешивающимся жидкостям А и Б. Если электролит хорошо растворим в обеих жидкостях, то при его добавлении их взаимная растворимость улучшается; если только в одной из них - то ухудшается. Так, электролиты NaCl, KCl, MgSO4 и др., хорошо растворимые в воде и не растворимые в феноле, вызывают сильное повышение критической температуры и искажение бинодали, связанное с тем, что система уже не является строго бинарной. При большом количестве добавленного электролита, не растворимого в одном из компонентов бинарной смеси, может произойти ее расслоение даже в том случае, если компоненты полностью смешивались. Это явление получило название высаливания. Если электролит растворим в обеих ограниченно смешивающихся жидкостях, то его добавление вызывает улучшение их взаимной растворимости, что обозначается термином 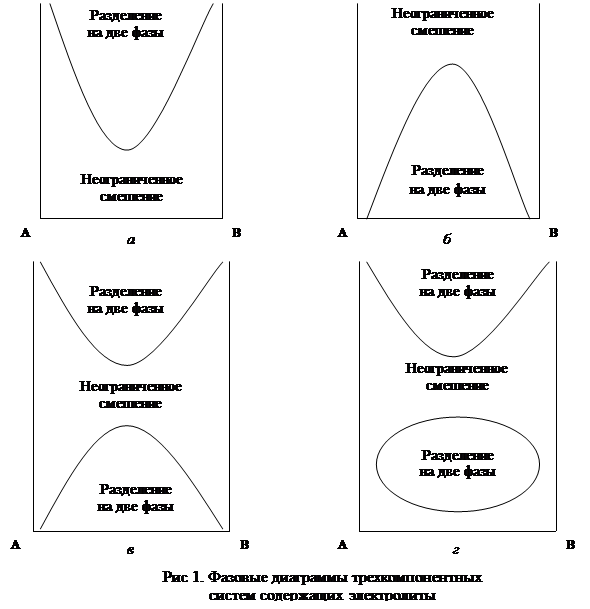
всаливание.
Явление высаливания очень подробно изучено для водных растворов белков, а для низкомолекулярных жидкостей имеющиеся в литературе данные были обобщены Блешинским, который трехкомпонентные системы жидкость-жидкость-электролит представил в виде диаграмм, одной осью которых является концентрация электролита (рис. 1). Из рисунка следует возможность различных случаев:
Две жидкости при данной температуре смешиваются неограниченно. Добавление электролита вызывает высаливание и расслаивание системы (рис. 1а).
Две жидкости при данной температуре смешиваются ограниченно, добавление электролита улучшает их взаимное смешение, и при некотором количестве добавленного электролита жидкости начинают смешиваться неограниченно (всаливание) (рис. 1б).
Добавление первых количеств электролита может вызвать улучшение взаимной растворимости жидкостей. (рис 1в) или ухудшение (рис 1г).
Фазовые диаграммы трехкомпонентных систем при постоянной температуре обычно выражают в виде равностороннего треугольника, вершины которого отвечают 100% каждого компонента, а точки, лежащие на его сторонах - составам бинарных систем. Любая точка, лежащая внутри треугольника, отражает состав трехкомпонентной системы. Для построение таких диаграмм требуется любым методом определить состав трехкомпонентной системы, при котором она расслаивается. Часто для этой цели используют метод точек помутнения, т.е. при заданной температуре фиксируют количество третьего компонента, вызывающего помутнение бинарной смеси заданного состава. Затем строят диаграмму по методам Розебома или Гиббса.
Метод Гиббса и Розебома.
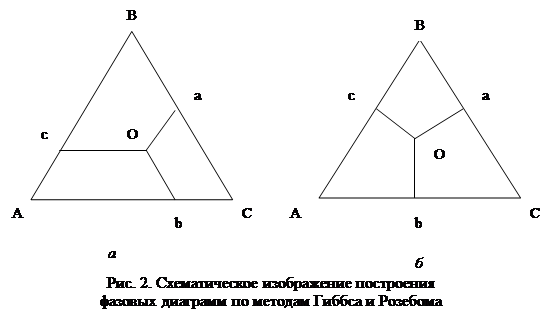 |
В методе Розебома за единицу принимается сторона равностороннего треугольника, на который откладывают мольные доли трех компонентов в расслаивающейся системе (рис. 2а). Через точки M и N проводят линии параллельные сторонам треугольника до пересечения их в точке О. Отрезок Оа, т.е. линия, соединяющая точку О со стороной, лежащей против угла А, отвечающего 100% данного компонента, равна его содержанию в трехкомпонентном растворе. Аналогично этому, отрезок Оотвечает содержанию компонента Б и отрезок Ос - содержанию компонента С.
В методе Гиббса за единицу принимается высота треугольника и состав смеси выражают линиями, перпендикулярными сторонам треугольника, соединяющими точки внутри его со сторонами, лежащими против углов, отвечающих 100% данного компонента (рис. 2б).
Примеры фазовых диаграмм
В зависимости от природы трех компонентов и их взаимодействия друг с другом фазовые диаграммы трехкомпонентных систем имеют различный вид.

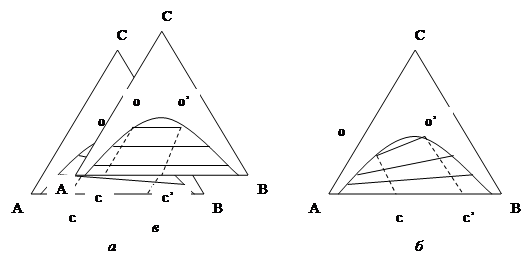 |
1. Три компонента образуют одну пару ограниченно смешивающихся жидкостей. Компоненты А и Б смешиваются друг с другом ограниченно, а компонент С растворяется в каждом из них. Точки фазового разделения образуют одну бинодаль, которая большей частью имеет параболическую форму. Однако ноды, т. е. линии соединяющие точки, отвечающие составам сосуществующих фаз, не всегда параллельны. Они могут иметь разный наклон в зависимости от растворимости компонента С в компоненте А и Б, т. е. от его коэффициента распределения между фазами:
а) Компонент С растворим лучше в компоненте А, чем в компоненте Б, т. е. имеет к нему большее термодинамическое сродство. Он будет содержаться в большем количестве в фазе, обогащенной компонентом А. Следовательно длина отрезка ОС > О'С' (рис. 3а). По мере увеличения количества компонента С составы фаз сближаются, ноды укорачиваются и вырождаются в точку, являющуюся критической. Она лежит не на вершине кривой, а на ее правой ветви;
б) Компонент С лучше растворяется в компоненте Б, чем в компоненте А. Он в большем количестве содержится в фазе, обогащенной компонентом Б, т. е. О'С' > ОС - ноды имеют противоположный наклон , и критическая точка лежит на левой ветви бинодали (рис 3б). Такой вид имеют например фазовые диаграммы системы уксусная кислота - вода - хлороформ. Вода ограниченно смешивается с хлороформом, уксусная кислота лучше растворяется в воде, чем в хлороформе. Если растворимость компонента С в компоненте А и Б совершенно одинакова, то бинодаль симметрична и критическая точка совпадает с ее максимумом (рис 3в).
 |
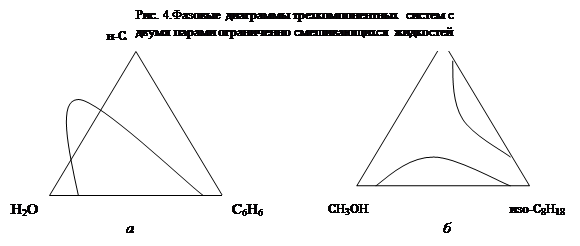
2. Три компонента образуют две пары ограниченно смешивающихся жидкостей. Фазовые диаграммы имеют одну или две гетерогенные области. Так, для системы вода - бензол - н-бутанол фазовая диаграмма имеет вид, представленный на рис 4а. Неограниченно смешиваются только бензол с н-бутанолом. Две другие пары смешиваются ограниченно. Имеется одна гетерогенная область: две кривые являются частями одной бинодали. На фазовой диаграмме метанол - изооктан - нитробензол имеются две гетерогенные области (рис 4б).
Три пары ограниченно смешивающихся жидкостей. В этом случае на фазовой диаграмме могут быть две или три гетерогенные области, но имеется область неограниченного смешения всех трех компонентов (рис 5,а и б).
Работы Бренстеда.
Для построения диаграммы точную навеску полимера растворяют в определенном количестве хорошего растворителя и к прозрачному раствору постепенно добавляют плохой для этого полимера растворитель до появления помутнения. Зная количества всех трех компонентов в образовавшейся смеси, откладывают их доли на одной из сторон треугольника и через эти точки проводят линии, параллельные его сторонам. Точка их пересечения отвечает составу трехкомпонентного раствора.
Таким путем Бренстедом впервые были получены диаграммы состояния систем полимер-жидкость I-жидкостьII. Они представлены на рис. 6. Сплошная линия отделяет область гомогенных растворов от гетерогенной области. Ноды соединяют токи, отвечающие составам двух сосуществующих слоёв, один из которых представляет собой бинарную смесь жидкостей. Размер области неограниченного смешения зависит от природы компонентов. Так, если взяты две жидкости, в одной из которых полимер набухает неограниченно, а в другой ограниченно, то область неограниченного смешения велика (рис. 6а). Если в одной жидкости полимер набухает неограниченно, а с другой совсем не взаимодействует, то область неограниченного смешения мала. Эта область ещё меньше, если в одной жидкости полимер набухает ограниченно, а с другой совсем не взаимодействует (рис. 6б).
Для полимерных систем характерен случай расслаивания, представленный на рис. 6в: полимер в обеих жидкостях только ограниченно набухает, и в трехкомпонентной смеси образуется две фазы. Но существует область составов, в которой наблюдается неограниченное смешение трех компонентов. Такие смеси часто используют на практике. Например, нитрат целлюлозы, содержащий 10-12 % азота ограниченно набухает в этиловом спирте и этиловом эфире. Смесь этих жидкостей, взятых в определенных соотношениях, неограниченно растворяет нитрат целлюлозы, 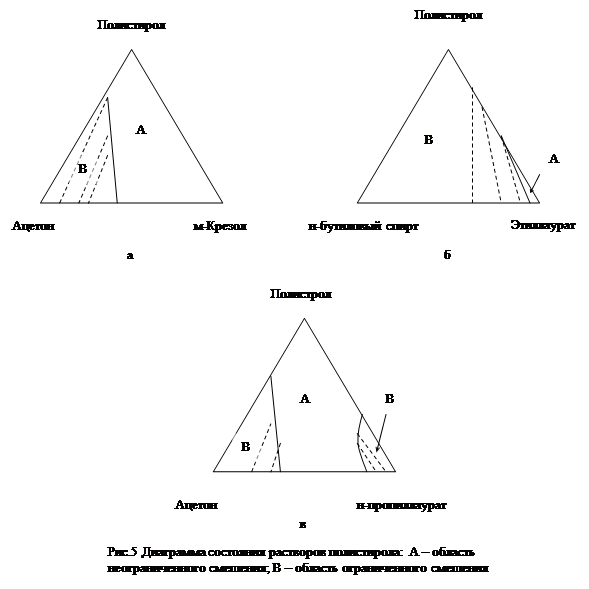
что и используется для получения коллодия.
Для некоторых полимеров, имеющих группы, различающиеся по полярности, иногда наблюдается улучшение растворяющей способности растворителя при добавлении к нему небольших порций осадителя, или нерастворителей. Дальнейшее их добавление приводит к ухудшению растворяющий способности и к выпадению полимера в осадок.
Метод треугольных диаграмм широко применяется для изучения систем содержащих полимер и две низкомолекулярные жидкости (полимер-жидкость I-жидкостьII), а также более сложных систем, содержащих два разных полимера и одну низкомолекулярную жидкость (полимер I – полимер II – жидкость).
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Диеновые углеводороды
К диеновым углеводородам относятся органические соединения с общей формулой CnH2n-2 , в молекулах которых имеются две двойные связи.Углево
- Дисперсные системы, электролиты, РН показатель
Министерство общего и профессионального образования Российской Федерации.ОмГТУКафедра Химии.Реферат по курсу «Химия».Выполнил:Студен
- Дмитрий Иванович Менделеев и его Система элементов
На заседании 6 марта 1869 года. Русского химического общества (учредительное собрание которого состоялось в ноябре 1868 года) Д.И.Менделеев х
- Жизнь и деятельность Сванте Аррениуса
Главное, что внёс в науку С.Аррениус – это теория электролитической диссоциации и представление об энергии активации в химических реак
- Жизнь и деятельность академика Григория Алексеевича Разуваева
- Жизнь и научные открытия А.Л.Лавуазье и К.Л.Бертолле
...27 октября 1788 года в одном из помещений пороховой фабрики в Париже собралось довольно большое общество. Присутствовали и дамы. Академик
- Загадочная вода
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

