Важкі метали та їх виявлення в стічних водах підприємств
Зміст
Вступ. 3
Розділ 1. Коротка характеристика впливу важких металів на біологічні об’єкти 4
1.1. Поняття важких металів. 4
1.2. Токсикологічна характеристика деяких важких металів. 5
1.2.1. Залізо. 6
1.2.2. Кадмій. 6
1.2.3. Кобальт. 7
1.2.4. Мідь. 8
1.2.5. Нікель. 8
1.2.6. Ртуть. 9
1.2.7. Свинець. 9
1.2.8. Цинк. 10
1.3. Забруднення важкими металами стічних вод. 10
1.4. Вплив важких металів на біологічні об’єкти. 11
Розділ 2. Сучасні методи аналізу. 14
2.1 Хімічні методи. 15
2.2 Фізико – хімічні методи. 16
Розділ 3. Практична частина. Отримання та аналіз важких металів із стічних вод підприємств методом сорбції 20
3.1 Виділення важких металів із стічних вод методом сорбції 21
3.2 Методика виявлення іонів важких металів у розчинах. 26
3.2.1 Визначення концентрації міді 28
3.2.2 Визначення концентрації свинцю.. 28
3.2.3 Визначення концентрації цинку. 28
3.2.4 Визначення концентрації нікелю.. 29
3.2.5 Визначення концентрації кадмію.. 29
3.2.6 Визначення концентрації кобальту. 29
3.2.7 Визначення концентрації ртуті 30
3.2.8 Визначення концентрації заліза. 30
Висновки. 31
Список використаної літератури. 32
Із кожним роком зростає техногенне навантаження на навколишнє середовище. Одним із факторів такого навантаження є зростання кількості побутових та промислових викидів, які вимагають своєї утилізації та захоронення. Проблема утилізації та захоронення промислових та побутових викидів вже давно стала надзвичайно важливою. Для вирішення її будують фабрики по переробці побутового сміття, та очисні споруди. Промислові викиди, якщо порівняти їх із побутовими будуть більш токсичні і чинитимуть більш негативний вплив на навколишнє середовище. Адже до промислових викидів відносяться викиди теплових електростанцій, різноманітних промислових підприємств. Особливо небезпечні по впливу на екологічну систему водойм важкі метали. Їх можна знайти в стічних водах металургійних та металообробних підприємств, гальванічних цехів, автопідприємств. В залежності від виду підприємства буде змінюватися картина викидів, в викидах автопідприємств переважають викиди сполук свинцю, гальванічні цехи скидають в стічні води сполуки цинку, кобальту, кадмію.
Якою б довершеною не була очистка стічних вод, але значна кількість важких металів потрапляє в природне середовище. Адже іноді підприємству вигідніше заплатити штрафи чим побудувати чи модернізувати очисні споруди.
Завданням даної роботи буде розглянути, що ж розуміють під поняттям «важкі метали», якою є їх біологічна роль та вплив на екологічну систему водойм, також розглянемо способи виділення важких металів із стічних вод підприємств методом сорбції, що може бути використано як для аналітичного виявлення важких металів у стічних водах так і як перспективний метод очистки стічних вод. Також одним із завдань роботи буде розгляд основних методів виявлення важких металів в стічних водах підприємств на основі державних стандартів України по якості води та виявленню важких металів: ДСт. 18293 – 72, ДСт. 4152 – 72, ДСт. 4011 – 72, ДСт. 4388 – 72, ДСт. 18963 – 72, ДСт. 4151 – 72.
Розділ 1. Коротка характеристика впливу важких металів на біологічні об’єкти
Розглянемо, що ж розуміють під поняттям «важкі метали», які їх шляхи потрапляння в природне середовище та їх вплив на біологічні об’єкти.
1.1. Поняття важких металів
Поняття «важкі метали» досить часто зустрічається у літературі, але у різних авторів до них відносять різні метали. Тобто трактування цього поняття у різних авторів різне. Тому потрібно визначитися, які ж саме метали відносять до важких, які їхні характеристики є визначальними при їх класифікації.
Термін «важкі метали» пов'язаний з високою відносною атомною масою елемента. Ця характеристика звичайно ототожнюється з уявленням про високу токсичність. Також однією із ознак «важких металів» є їхня густина. У сучасній кольоровій металургії розрізняють важкі кольорові метали – густиною 7,14 – 21,4 г/см3 (цинк, олово, мідь, свинець, хром, кадмій, кобальт й ін.) і легкі кольорові метали - густиною 0,53 – 3,5 г/см3 (літій, берилій й ін.).
Відповідно до однієї класифікації (16), до групи важких металів належить більше 40 елементів з високою відносною атомною масою й густиною більшою 6 г/см3. По іншій класифікації, у цю групу включають кольорові метали із густиною більшою, ніж у заліза (свинець, мідь, цинк, нікель, кадмій, кобальт, олово, сурма, вісмут, ртуть).
Відповідно до відомостей, представлених в довіднику (22) до важких металів віднесені елементи, густина яких більша за 5 г/см3. Якщо виходити їх цього показника, важкими можна вважати 43 з 84 металів Періодичної системи хімічних елементів. Таким чином, до важких металів відносять більше 40 хімічних елементів з відносною густиною більше 6. Число ж небезпечних забруднювачів, якщо враховувати токсичність, стійкість і здатність накопичуватися в зовнішньому середовищі, значно менше.
1.2. Токсикологічна характеристика деяких важких металів
Розглянемо властивості, шляхи попадання, гранично допустимі концентрації деяких важких металів. Насамперед становлять інтерес ті метали, які найбільше широко й у значних об'ємах використаються у виробничій діяльності й у результаті нагромадження в зовнішньому середовищі становлять серйозну небезпеку з огляду їх високої біологічної активності й токсичних властивостей. До них відносять залізо, свинець, ртуть, кадмій, цинк, нікель, мідь.
1.2.1. Залізо
Значні кількості заліза надходять зі стічними водами підприємств металургійної, металообробної, текстильної, лакофарбової промисловості й із сільськогосподарськими стоками.
Фазові рівноваги між формами сполук заліза у розчинах залежать від хімічного складу води, РН, Eh і від температури. Розчинене залізо у стічних та природних водах представлене сполуками, що перебувають в іонній формі, у вигляді гідроксокомплексів й комплексів з розчиненими неорганічними й органічними речовинами природних вод. В іонній формі мігрує головним чином Fe (II), а Fe (III) під час відсутності комплексоутворювачів може в значних кількостях перебувати в розчиненому стані.
У результаті хімічного й біохімічного (при участі залізобактерій) окиснення Fe (II) переходить в Fe (III), іони якого, гідролізуючись, випадають в осад у вигляді Fe(OH)3. Як для іонів Fе2+, так і для Fe3+ характерна здатність до утворення гідроксокомплексів типу (Fe(OH)2)+, (Fe2(OH)2)4+, (Fe(OH)3)+, (Fe2(OH)3)3+, (Fe(OH)3)– і інших, співіснуючих у розчині в різних концентраціях залежно від РН. Основною формою знаходження Fe3+ у поверхневих водах є комплексні сполуки його з розчиненими неорганічними й органічними комплексоутворювачами, головним чином гумусовими речовинами. При РН = 8,0 основною формою знаходження іонів тривалентного заліза в розчинах є Fe(OH)3.
Вміст заліза у воді вище 1 – 2 мг/л значно погіршує органолептичні властивості води, надаючи їй неприємний в'язкий смак, і робить воду малопридатною для використання в технічних цілях. ГДК заліза становить 0,3 мг/дм3 (лімітуючий показник шкідливості – органолептичний).
1.2.2. Кадмій
Сполуки кадмію виносяться в поверхневі води зі стічними водами свинцево-цинкових заводів, гірничо-збагачувальних комбінатів, ряду хімічних підприємств (виробництво сірчаної кислоти), гальванічного виробництва, а також із шахтними водами. Зниження концентрації розчинених сполук кадмію відбувається за рахунок процесів сорбції, випадання в осад гідроксида й карбонатів кадмію.
Розчинені форми кадмію в стічних водах являють собою головним чином мінеральні комплекси. У річкових незабруднених й слабко забруднених водах кадмій утримується в субмікрограммових концентраціях, у забруднених і стічних водах концентрація кадмію може досягати десятків мікрограмів в 1 дм3.
Сполуки кадмію відіграють важливу роль у процесі життєдіяльності тварин і людини. У підвищених концентраціях токсичний, особливо в сполученні з іншими токсичними речовинами (8), (19).
ГДК становить 0.001 мг/дм3 (лімітуюча ознака шкідливості – токсикологічна).
1.2.3. Кобальт
У природні води сполуки кобальту попадають зі стічними водами металургійних, металообробних і хімічних заводів.
Сполуки кобальту в природних водах перебувають у розчиненому й звішеному стані, кількісне співвідношення між якими визначається хімічним складом води, температурою й значеннями РН. Розчинені форми представлені в основному комплексними сполуками. Сполуки двовалентного кобальту найбільш характерні для поверхневих вод. У присутності окислювачів можливе існування в помітних концентраціях тривалентного кобальту (19).
Кобальт відноситься до числа біологічно активних елементів. Входячи до складу вітаміну В12, кобальт досить активно впливає на надходження азотистих речовин, збільшення змісту хлорофілу й аскорбінової кислоти, активізує біосинтез і підвищує зміст білкового азоту в рослинах. Разом з тим підвищені концентрації сполук кобальту є токсичними (8).
ГДК становить 0.1 мг/дм3.
1.2.4. Мідь
Мідь – один з найважливіших мікроелементів. Фізіологічна активність міді зв'язана головним чином із включенням її до складу активних центрів окислювально-відновних ферментів. Недостатній зміст міді в ґрунтах негативно впливає на синтез білків, жирів і вітамінів і сприяє безплідності рослинних організмів. Мідь бере участь у процесі фотосинтезу й впливає на засвоєння азоту рослинами. Разом з тим, надлишкові концентрації міді впливають на рослинні й тваринні організми.
У природних водах найбільше часто зустрічаються сполуки Cu(II). Зі сполук Cu(I) найпоширеніші важкорозчинні у воді Cu2O, Cu2S, CuCl. При наявності у водному середовищі лігандів, поряд з рівновагою дисоціації гідроксида, необхідно враховувати утворення різних комплексних сполук, що перебувають у рівновазі з акваіонами міді.
Основним джерелом надходження міді в природні води є стічні води підприємств хімічної, металургійної промисловості, шахтні води, альдегідні реагенти, використовувані для знищення водоростей. Мідь може з'являтися в результаті корозії мідних трубопроводів й інших споруд. Гранично припустима концентрація міді у воді водойм санітарно-побутового водокористування становить 0,1 мг/дм3 (лімітуюча ознака шкідливості – загальносанітарна) (8).
1.2.5. Нікель
Сполуки нікелю у водні об'єкти надходять також із стічними водами цехів нікелювання, заводів синтетичного каучуку, нікелевих збагачувальних фабрик. Величезні викиди нікелю супроводжують спалювання викопного палива.
Концентрація його може знижуватися в результаті випадання в осад таких сполук, як ціаніди, сульфіди, карбонати або гідроксиди (при підвищенні значень РН) й процесів адсорбції.
У поверхневих водах сполуки нікелю перебувають у розчиненому, звішеному й колоїдному стані, кількісне співвідношення між якими залежить від властивостей води, температури й значень РН. Сорбентами сполук нікелю можуть бути гідроксид заліза, органічні речовини, високодисперсний карбонат кальцію, глини. Розчинені форми являють комплексні іони, найбільше часто з амінокислотами, гуміновими кислотами, а також у вигляді міцного ціанідного комплексу. Найпоширеніші в природних водах сполуки нікелю, у яких він перебуває в ступені окислювання +2.
Сполуки нікелю відіграють важливу роль у кровотворних процесах. Підвищений його вміст впливає на серцево-судинну систему. Нікель належить до числа канцерогенних елементів. Вважається, що вільні іони нікелю (Ni2+) приблизно в 2 рази більш токсичні, чим його комплексні сполуки (8). ГДК становить 0,1 мг/дм3.
1.2.6. Ртуть
Значні кількості ртуті надходять у водні об'єкти зі стічними водами підприємств, що виготовляють барвники, пестициди, фармацевтичні препарати, деякі вибухові речовини.
У поверхневих водах сполуки ртуті перебувають у розчиненому й звішеному станах. Співвідношення між ними залежить від хімічного складу води й значення РН. Звішена ртуть являє собою сорбовані сполуки ртуті. Розчиненими формами є недисоційовані молекули, комплексні органічні й мінеральні сполуки.
Сполуки ртуті високо токсичні, вони вражають нервову систему людини, викликають зміни з боку слизової оболонки, порушення рухової функції й секреції шлунково-кишкового тракту, зміни в крові й ін. ГДК ртуті становить 0,0005 мг/дм3.
1.2.7. Свинець
Викиди свинцю пов’язані із стічними водами гірничо-збагчувальних комбінатів, деяких металургійних заводів, хімічних виробництв, шахт і т.д. Свинець перебуває в воді у розчиненому й звішеному (сорбованому) стані. У розчиненій формі зустрічається у вигляді мінеральних й органо-мінеральних комплексів, а також простих іонів, у нерозчинній – у вигляді сульфідів, сульфатів і карбонатів.
У річкових водах концентрація свинцю коливається від десятих часток до одиниць мікрограмів в 1 дм3.
Свинець – промислова отрута, здатний при несприятливих умовах виявитися причиною отруєння. В організм людини проникає через органи травлення. Виводиться з організму дуже повільно, внаслідок чого накопичується в костях, печінці й нирках (8). ГДК свинцю становить 0,03 мг/дм3.
Попадає в природні води з стічними водами гірничо-збагачувальних комбінатів та гальванічних цехів, виробництв пергаментного паперу, мінеральних фарб, віскозного волокна й ін.
У воді знаходиться в іонній формі або у формі мінеральних й органічних комплексів. Іноді зустрічається в нерозчинній формі: у вигляді гідроксида, карбонату, сульфіду й ін.
Цинк ставиться до числа активних мікроелементів, що впливають на ріст і нормальний розвиток організмів. У той же час багато сполук цинку токсичні, насамперед його сульфат і хлорид. ГДК Zn2+ становить 1 мг/дм3 .
1.3. Забруднення важкими металами стічних вод
Джерелами забруднення вод важкими металами служать стічні води гальванічних цехів, підприємств гірничодобувної, чорної й кольорової металургії, машинобудівних заводів. Важкі метали входять до складу добрив і пестицидів і можуть попадати у водойми разом зі стоками із сільськогосподарських угідь.
У водних середовищах метали можуть бути присутні в трьох формах: у формі звішених часток, колоїдів й розчинених сполук. Останні представлені вільними іонами й розчинними комплексними сполуками з органічними і неорганічними лігандами. Великий вплив на вміст цих елементів у воді має гідроліз, який визначає форму знаходження елемента у водних середовищах. Значна частина важких металів переноситься поверхневими водами у звішеному стані.
Багато металів утворять досить міцні комплекси з органікою; ці комплекси є однієї з найважливіших форм міграції елементів у природних водах. Більшість органічних комплексів утворюються по хелатному принципу і є достатньо стійкими. Комплекси, утворені ґрунтовими кислотами із солями заліза, алюмінію, титану, урану, ванадію, міді, молібдену й інших важких металів, відносно добре розчинні в умовах нейтрального, слабко кислого і слабко лужного середовищ. Тому металоорганічні комплекси здатні мігрувати в природних водах на досить значні відстані. Так, хелатні форми Cu, Cd, Hg менш токсичні, ніж вільні іони. Для розуміння факторів, які регулюють концентрацію металу в стічних водах, їх хімічну реакційну здатність, біологічну доступність і токсичність, необхідно знати не тільки вміст, але й частку зв'язаних і вільних форм металів.
Підвищення концентрації важких металів у природних водах часто пов'язане з іншими видами забруднення, наприклад, із закисленням. Випадання кислотних опадів сприяє зниженню значення РН і переходу металів із сорбованого на мінеральних й органічних речовинах стану у вільний.
1.4. Вплив важких металів на біологічні об’єкти
Відомо, що такі метали як ванадій, залізо, кадмій, калій, кальцій, кобальт, магній, марганець, мідь, молібден, натрій, нікель, олово, хром, цинк є життєво необхідними.
Токсичність у відповідних концентраціях для людини проявляють алюміній, барій, берилій, кадмій, мідь, миш'як, нікель, селен, свинець, срібло, стронцій, ртуть, хром. Концентрація елемента має суттєве значення, оскільки кадмій, мідь, миш'як, нікель, селен, хром відносяться до життєво необхідних для організму людини елементів. Для нормального функціонування організму людини необхідне досягнення збалансованого обміну мікроелементів, порушення якого призводить до важких захворювань та отруєнь. В таблиці 1 приведені дані для деяких металів в порядку зростання їх летальної дози, вказані також й необхідні дози цих елементів.
Таблиця 1. Добова потреба людини в мікроелементах та їх токсичні концентрації (в розрахунку на масу 70кг, в мг/доба)
| Елемент | Доза, мг/кг | ||
| Нормальна | Токсична | Летальна | |
| Миш'як | 0,04-1,4 | 5-50 | 50-340 |
| Ртуть | 0,004-0,02 | 0,4 | 150-300 |
| Мідь | 0,5-6 | – | 175-250 |
| Алюміній | 0,0014-0,08 | 60 | 1300-6200 |
| Кадмій | 0,07-0,3 | 3-330 | 1500-9000 |
| Фтор | 0,3-5 | 20 | 2000 |
| Хром | 0,01-1,2 | 200 | 3000-8000 |
| Цинк | 5-40 | 150-600 | 6000 |
| Свинець | 0,06-0,5 | – | 10000 |
| Залізо | 6-40 | 200 | 7000-35000 |
Розглянемо вплив деяких металів на метаболічні процеси в організмі людини та тварин. У складі стічних вод металургійних комбінатів можна виявити алюміній. В організм людини алюміній потрапляє у складі питної води. Видалення алюмінію з організму ускладнене, близько половини його початкової кількості затримується в організмі до 300 днів. Накопичуючись в тканинах мозку, печінки, нирок, кісток, викликає їх функціональні порушення. Алюміній викликає порушення в синтезі ряду ферментів, сприяючи видаленню таких біоелементів як P, Mg, Ca, Na, Fe . Постійне вживання питної води з вмістом алюмінію понад 0,2 мг/л призводить до підвищення вірогідності появи таких захворювань як енцефалопатія, хвороби Альцгеймера і Паркінсона, анемії, зниження імунної реактивності та інші.
ГДК залишкового алюмінію в питній воді встановлена на рівні 0,5 мг/л за санітарно-токсикологічною ознакою шкідливості, в той час як в більшості країн Європи рекомендовано вміст алюмінію не більше 0,2 мг/л. Така ж норма встановлена ВОЗ. Новий ДержСанПіН “Вода питна”, встановивши норму 0,2 мг/л, дозволяє концентрацію алюмінію в питній воді на рівні 0,5 мг/л, якщо при водопідготовці використовуються реагенти, що містять алюміній.
Кадмій має токсичні і кумулятивні властивості. При надходженні в організм він накопичується в печінці, нирках і селезінці, а також викликає анемію, знижує вміст кисню в крові. Нирки є основною мішенню токсичної дії кадмію. Метал викликає хворобу ітай-ітай, що проявляється в розм’якшенні кісток, кальцифікації і пієлонефриті нирок. Оскільки кадмій накопичується в органах і має тривалий період напіввиведення (10-30 років), вживання заражених продуктів на протязі тривалого часу може призвести до тих чи інших форм кадмієвої інтоксикації.
Мідь є одним з незамінних елементів для організму людини. В деяких випадках дефіцит міді за симптомами подібний до хронічної її інтоксикації. Споживання міді з їжею звичайно складає 2-3 мг на добу, що підтримує необхідну рівновагу. Звичайно швидкість поглинання, утримання і виведення міді не призводять до підвищеного її вмісту в організмі. Однак, при хворобах, що викликають порушення цього механізму, тривала абсорбція міді може викликати цироз печінки. Є відомості про вплив міді на метаболізм штучно вигодовуваних новонароджених. Зафіксовані гострі отруєння людей при вживанні з питною водою міді при дозі 0,14 мг/кг і вище. Мідь токсична для більшості прісних безхребетних.
Ртуть і її сполуки надзвичайно токсичні для людини, вони акумулюються в нирках, печінці, головному мозку. Основний орган – мішень для неорганічної ртуті – нирки. Летальна доза ртуті при споживанні з питною водою складає 75 – 300 мг на добу. Симптоми ртутної інтоксикації – атаксія, пригнічення периферійного сприйняття і рефлексу кінцівок.
В неорганічній формі ртуть в поверхневих і підземних водах присутня зазвичай в концентрації менше 0,5 мкг/л. Середньодобове споживання ртуті варіюється від 2 до 20 мкг на добу на людину.
Свинець вражає нервову систему, кістковий мозок і кров, судини, генетичний апарат клітки, впливає на синтез білка і проявляє гонадотоксичну і ембріотоксичну дію. За результатами досліджень на тваринах було встановлено, що свинець, що надходить в високій концентрації з кормом, викликає рак нирок. На цій основі МАВР віднесла свинець і його неорганічні сполуки до класу можливих канцерогенів для людини.
Цинк життєво необхідний для ссавців, бо він грає важливу роль в біосинтезі нуклеїнових кислот, РНК- і ДНК-полімераз. Встановлено, що цинк - обов'язковий складник ферменту крові, карбоангідрази. Цей фермент міститься в еритроцитах. Карбоангідраза прискорює виділення вуглекислого газу в легенях. Крім того, вона допомагає перетворити частину СО2 в іон ![]() , що грає важливу роль в обміні речовин. Токсичність цинку для людини залежить багато в чому від його синергізму або антагонізму з іншими важкими металами, особливо з кадмієм. Підвищена акумуляція важких металів може призводити до дефіциту цинку в організмі людини, що виявляється в пригніченні ферментної активності, а також в більш уповільненому заживанні ран.
, що грає важливу роль в обміні речовин. Токсичність цинку для людини залежить багато в чому від його синергізму або антагонізму з іншими важкими металами, особливо з кадмієм. Підвищена акумуляція важких металів може призводити до дефіциту цинку в організмі людини, що виявляється в пригніченні ферментної активності, а також в більш уповільненому заживанні ран.
Розділ 2. Сучасні методи аналізу
Розглянемо основні сучасні методи визначення важких металів у розчинах, які найбільш широко використовують при визначенні концентрацій важких металів у стічних та природних водах.
Аналіз стічних вод промислових підприємств має істотну перевагу – доступний об’єм аналізованої проби стічної води достатньо великий, тому можна його попередньо концентрувати різними методами, які ми розглянемо нижче.
2.1 Хімічні методи
Під час аналізу відносно концентрованих стічних вод (а іноді й розведених) використають титрометричні методи аналізу із застосуванням як кольорових індикаторів для фіксації кінця титрування, так і спеціальних приладів - електрохімічних (потенціометричне титрування, амперметричне, кондуктометричне) і оптичних (нефелометричне, колориметричне титрування). Титрометричні методи часто застосовують для визначення аніонів, особливо тоді, коли одночасно присутні різні аніони, що перешкоджають визначенню один одного. У хімічному аналізі стічних та природних вод до сьогодні використовують комплексонометричне титрування із допомогою ЕДТА, таким чином можна швидко та доволі точно визначити загальний вміст важких металів у воді, а при дотриманні певних умов можна проводити також і селективне титрування та визначення концентрації окремих іонів у розчині.
Гравіметричні методи в аналізі стічних вод застосовують рідко. Недоліки їх загальновідомі. Але основною їх перевагою є те, що не потрібна побудова каліброваних графіків. Гравіметричні методи застосовують у якості арбітражних при визначенні магнію, сульфатів-іонів.
Пряма потенціометрія знаходить застосування при визначенні багатьох іонів з використанням іоноселективних електродів. В аналізі природних вод і питної води іоноселективні електроди застосовують для визначення кадмію, міді, свинцю, срібла, лужних металів, бромід-, хлорид-, . ціанід-, фторид-, йодид- і сульфідів-іонів.
Полярографичні методи аналізу широко використають у хіміко-аналітичних лабораторіях підприємств кольоровий металургії для визначення міді, нікелю, кобальту, цинку, вісмуту, кадмію, сурми, олова й інших металів у рудах, сплавах та відходах виробництв. У тих же лабораторіях ці методи використають і для аналізу промислових стічних вод.
2.2 Фізико – хімічні методи
Основні методи визначення неорганічних компонентів стічних вод – фотометрія, атомно-абсорбційна спектрометрія, рентгено-спектральний аналіз й емісійна спектрометрія.
У фотометричних методах аналізу вимірюють поглинання світла аналізованим розчином після введення в нього реактиву, що реагує з певним компонентом стічних вод з утворенням інтенсивно поглинаючої світло сполуки.
Застосовувані у фотометрії прилади складаються із чотирьох частин, послідовно розташованих одна за іншою: джерело світла, світлофільтр або монохроматор, кювета з розчином, детектор (фотоелемент, що перетворює енергію випромінювання в електричну) .
Конструкції приладів залежать від того, у який області спектра (ультрафіолетовій, видимій або інфрачервоній) проводять виміри. Джерелом видимого випромінювання служить звичайна електрична лампа, для одержання УФ-випромінювання застосовують водневу лампу.
Звичайно для проведення аналізу вибирають випромінювання в тій області довжин хвиль, у якій отримана забарвлена сполука має максимальне світлопоглинання, а домішки – мінімальне.
У спектрофотометрах за допомогою монохроматора виділяють дуже вузький пучок світла із певною довжиною хвилі (1-2 нм.) і за допомогою самописців записується крива світло поглинання під час повільної зміни довжини хвилі випромінювання від малих довжин хвиль до більших. У фотоколориметрах для тієї ж мети (виділення випромінювання потрібної довжини) застосовують світлофільтри, що пропускають потік світла значно більшої ширини (20-50 нм). Спектрофотометри, звичайно, більше придатні для проведення точних досліджень, але вони значно дорожчі й менш доступні, чим фотоколориметри. Фото колориметричні методи також більш прості та не потребують довгої підготовки до своєї роботи. Під час аналізу стічних вод виміри проводять найчастіше у видимій області спектра.
Фотометричні методи аналізу обов'язково включають холостий дослід для усунення впливу сторонніх речовин. Існують два типи холостих дослідів:
1) Холостий дослід із дистильованою водою замість аналізованого розчину при додаванні всіх необхідних реактивів; так виключається вплив світлопоглинання реактивами;
2) Холостий дослід із аналізованим розчином без додавання реактивів; так виключається вплив сторонніх речовин, що є присутніми у самій аналізованій пробі.
Розглянемо особливості атомно-абсорбційного аналізу.
Метод заснований на поглинанні ультрафіолетового або видимого випромінювання атомами газу. Щоб перевести пробу (хоча б
частково) у газоподібний стан, її вводять у полум'я. Як джерело випромінювання застосовують лампу з полим катодом з аналізованого металу. Інтервал довжин хвиль спектральної лінії, що випромінюється джерелом випромінювання, і лінії поглинання того ж самого елемента в полум'ї дуже вузький, тому поглинання інших елементів практично не
позначається на результатах аналізу.
Суттєвою відмінністю атомної абсорбції від емісійної спектрометрії є те, що в останньому методі виміряється випромінювання, що випускається атомами в збудженому стані, а атомна абсорбція заснована на вимірі випромінювання, поглиненого нейтральними, не збудженими атомами, що перебувають у полум'ї, яких у полум'ї набагато більше, ніж збуджених. Цим пояснюється висока чутливість методу при визначенні елементів, що мають високу енергію збудження. Найбільшу чутливість атомно-абсорбційна спектроскопія проявляє при визначенні As, Be, Bi, Cd, Hg, Mg, Pb, Ті, Zn, Cs, In. Значно більшу чутливість емісійний метод проявляє при визначенні Li, К, Na, Ba, Sr, Tl. Чутливість визначення інших елементів приблизно однакова при визначенні їх обома методами,
В принципі атомно-абсорбційна спектрометрія подібна до звичайної спектрофотометрії, аналогічна й використовувана в обох методах апаратура. В обох методах випромінювання пропускають через аналізовану пробу, що частково його поглинає, а пропущене світло проходить через монохроматор і попадає на фотодетектор – пристрій, що реєструє кількість пропущеного або поглинутого випромінювання. Розходження цих методів - у джерелі світла й у кюветі для проби.
Джерелом світла в атомно-абсорбційній спектроскопії є лампа з полим катодом, яка випромінює вузький інтервал довжин хвиль, порядку 0,001 нм. Лінія поглинання аналізованого елемента дещо ширша випромінюваної полоси, що дозволяє вимірювати поглинання в її максимумі. Прилад містить необхідний набір ламп, кожна лампа призначається для визначення тільки одного елемента. Існують лампи, призначені для визначення декількох елементів (наприклад, Mg, Са, AI), але застосування їх не рекомендується із-за можливості помилок.
Кюветою в атомно-абсорбційній спектроскопії служить саме полум'я..
Застосовують полум'я, для одержання якого як пальне використають ацетилен, пропан або водень, а як окислювач – повітря, кисень або оксид азоту(I). Обрана газова суміш визначає температуру полум'я. Повітряно-ацетиленове й повітряно-пропанове полум'я мають низьку температуру (2200 – 2400°С). Таке полум'я, використають для визначення елементів, сполуки яких, легко розкладаються при цих температурах. Таких елементів більшість. При визначенні елементів, що утворять важкодисоціюючі сполуки, використають високотемпературне полум'я (3000 – 3200°С), створюване сумішшю оксид азоту (I) та ацетилену. Таке полум'я необхідне при визначенні алюмінію, берилію, кремнію, ванадію й молібдену.
Одним із методів фізико-хімічного аналізу речовин отриманих із стічних вод є рентгеноспектральній аналіз. Рентгеноспектральний аналіз використовують для кількісного визначення металів, які містяться у пробах. При цьому аналізовані зразки можуть мати складну хімічну та фазову будову. Як правило, зразки для аналізу повинні мати масу порядку одного грама, хоча на сьогодні створені прилади, які розраховані на мікро кількості речовин. Точність аналізу складає 2 -5 відносних %, а тривалість від 1 – 2 хвилин до 1 – 2 годин.
Для одержання спектра рентгенівських променів у рентгеноспектральному аналізі використають їхню дифракцію на кристалах (або на штрихових дифракційних решітках) при таких малих кутах ![]() (1 – 12°), що рентгенівські промені відбиваються, ніби ковзаючи по поверхні кристала.
(1 – 12°), що рентгенівські промені відбиваються, ніби ковзаючи по поверхні кристала.
Досліджуваний зразок при рентгеноспектральному аналізі опромінюється первинними рентгенівськими променями. Атоми елементів, що входять до складу зразка, під дією випромінювання збуджуються й самі стають джерелами вторинного рентгенівського випромінювання. Такий спосіб аналізу одержав назву флуоресцентного.
Специфічний для даної речовини спектр вторинного випромінювання описується як корінь квадратний із частот коливань променів, випущених атомами, що входять до складу зразка, і лінійно залежить від їхніх атомних номерів:
![]() (1)
(1)
Де ![]() - частота коливань, пов'язана з довжиною хвилі співвідношенням
- частота коливань, пов'язана з довжиною хвилі співвідношенням ![]() R – постійна Рідберга; а - постійна для кожної лінії спектра величина; Z – атомний номер елемента;
R – постійна Рідберга; а - постійна для кожної лінії спектра величина; Z – атомний номер елемента; ![]() - середня константа екранування.
- середня константа екранування.
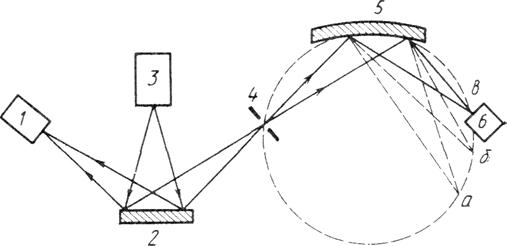
Рис. 2.1. Принципова схема рентгенівського спектрометра з вигнутим кристалом.
1 – додатковий електронний детектор; 2 – досліджуваний зразок; 3 – рентгенівська трубка; 4 – діафрагма; 5 – вигнутий кристал; 6 – електронний детектор флуоресцентного спектра.
З рівняння (1) видно, що кожному виду атомів властива певна частота коливань вторинних рентгенівських променів, збуджених первинним випромінюванням. Очевидно, що енергія кванта збудження повинна бути більше енергії, необхідної для вибивання глибинних електронів атомів досліджуваної речовини, тобто флуоресцентне випромінювання досліджуваного зразка виходить у тисячі разів слабкіше первинного випромінювання, що утрудняє реєстрацію спектрів.
На малюнку 1 наведена принципова схема рентгенівського спектрометра з вигнутим кристалом. Як видно з малюнка, первинні рентгенівські промені із джерела падають на досліджуваний зразок, викликаючи вторинне флуоресцентне випромінювання. Частина випромінювання через діафрагму подається під малим кутом на поверхню вигнутого кристала й під кутом ковзання відбивається від нього. Відбиті від вигнутого кристала промені, будучи сфокусованими на кільцевий екран, утворять на ньому спектр. Цей спектр фіксують фотографічними методами або ж за допомогою електронного детектора. Іноді можливе використання лічильників Гейзера для реєстрації енергії випромінювання.
Розділ 3. Практична частина. Отримання та аналіз важких металів із стічних вод підприємств методом сорбції
Розглянемо основні методи сорбції важких металів із стічних вод підприємств. Аналіз стічних вод має одну особливість, а саме – достатньо великі об’єми аналізованих розчинів, що дозволяє використовувати методи концентрування. Для концентрування стічних вод використовують методи екстракції, випарювання, сорбції. Кожен із приведених методів має як свої позитивні так і негативні сторони. Процеси екстракції потребують використання органічних розчинників: хлороформу, бензолу, толуолу, чотири хлористого вуглецю. Але використання органічних розчинників, випарювання їх досить вогненебезпечне. Методи випарювання не потребують ніяких розчинників, проводяться у водному середовищі, але по часу вони доволі тривалі і їх не можна використати для експрес-аналізу. Метод сорбції потребує використання спеціальних органічних чи неорганічних сорбентів. Метод сорбції в останній час активно розвивається, у його розвитку використовують методи та методики сорбції, які були розроблені раніше для виділення урану, плутонію. Наприклад, в Україні такі роботи велися на Придніпровському гірничо-збагачувальному комбінаті, де на основі методик первинного збагачення уранової руди розробили установки для промислової сорбції рідкоземельних та благородних металів. В останній час викликають інтерес природні сорбенти – цеоліти, які проявляють активну сорбційну дію.
3.1 Виділення важких металів із стічних вод методом сорбції
При аналізі стічних вод широкими можливостями володіє метод сорбції. При його використанні можна досягти коефіцієнтів концентрування до ![]() . Сорбцію проводять як у статичних так і у динамічних умовах, використовують сорбційні фільтри. У якості сорбентів використовують активне вугілля, сульфовугілля, синтетичні іоніти, комплексоутворюючі сорбенти.
. Сорбцію проводять як у статичних так і у динамічних умовах, використовують сорбційні фільтри. У якості сорбентів використовують активне вугілля, сульфовугілля, синтетичні іоніти, комплексоутворюючі сорбенти.
Розроблені методи поглинання хелатів (8, 10), а саме Cd, Co, Cr, Cu, Dy, Eu, Hf, Hg, Mn, Ni, Pb, Re, Sm, Tb, Zn переводили в 8-оксихінолінати при РН = 8 та поглинали утворені хелатні сполуки активованим вугіллям. Мікроелементи поглиналися кількісно, коефіцієнт поглинання досягав значення ![]() . Для подальшого аналізу використовували методи атомно-абсорбційної спектрометрії.
. Для подальшого аналізу використовували методи атомно-абсорбційної спектрометрії.
Ще більш зручні для проведення експрес-аналізів сорбційні фільтри. Фільтр із привитими групами ![]() кількісно поглинає близько 12 мікроелементів (в основному важкі метали та благородні), які містяться у стічних водах та промислових водах підприємств у звішеному та іонному вигляді. Після висушування фільтр аналізують методом ренггено-фазового аналізу, границя виявлення мікроелементів складає
кількісно поглинає близько 12 мікроелементів (в основному важкі метали та благородні), які містяться у стічних водах та промислових водах підприємств у звішеному та іонному вигляді. Після висушування фільтр аналізують методом ренггено-фазового аналізу, границя виявлення мікроелементів складає ![]() .
.
Високі значення коефіцієнтів концентрування досягаються при використанні статичних умов сорбції. Наприклад в (8) у якості сорбента запропоновано використати метатитанову кислоту. По методиці
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Вермикультура и биогумус
- Взаимодействие человека и окружающей среды. Проблемы экологизации
Содержание1. Путь цивилизации2. Влияние человека на окружаюшую среду3. Влияние окружающей среды на человека4. Взаимоотношения цивилизаци
- Взаимодействие человека и природной среды
- Влияние атмосферных загрязнений автомототранспортом на растения березы бородавчатой
Глава 1. ВЛИЯНИЕ АТМОСФЕРНЫХ ЗАГРЯЗНЕНИЙ АВТОМОТОТРАНСПОРТОМ НА РАСТЕНИЯ БЕРЕЗЫ БОРОДАВЧАТОЙВЫВОДЫЛИТЕРАТУРААННОТАЦИЯИсследование в
- Влияние городской среды на здоровье населения
- Влияние загрязнения атмосферного воздуха на состояние рябины обыкновенной
- Влияние крупного промышленного центра на окружающую среду
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

