Блистающий мир белков и пептидов
А.А. Замятнин, докт. биол. наук,
Институт биохимии им. А.Н. Баха РАН
Среди множества веществ, содержащихся в живом организме, особое место занимают белки. Их доля от сухой массы клеток млекопитающих составляет 60% – больше, чем для всех остальных вместе взятых химических соединений, и почти пятую часть от общей массы этих клеток. Каждый из сотен тысяч разных белков обладает уникальной химической и пространственной структурой, которые определяют его специфические функции.
Систематическое исследование структуры и функций многочисленных белков и их природных фрагментов – олигопептидов – началось во второй половине XX в. и продолжает стремительно развиваться. Каждый год публикуется несколько десятков тысяч научных работ, посвященных белковым веществам, многие тысячи ученых из более чем 50 стран ежедневно работают над этой проблемой. В последние годы сформировалась даже специальная наука протеомика, посвященная именно белкам. Не перестаешь восхищаться многообразию все новых и новых химических, структурных и функциональных форм белков, их взаимосвязи в осуществлении жизненно важных процессов, сложности и одновременно простоте всего этого, а также красоте как отдельных молекул, так и процессов с их участием. Белки и пептиды представляют собой удивительный и уникальный мир, для изучения которого необходимо привлечение знаний всех естественных, и не только естественных, наук. Именно с позиций разных наук и профессий мы и попытаемся заглянуть в этот блистающий мир человеческого знания.
Философия
На белки философы обратили внимание сразу же после того, как была выяснена их распространенность в живой природе и многообразие функций. И это неудивительно, поскольку по одному из определений философия – это наука о всеобщих законах развития природы, общества и мышления.
Широкое распространение получило определение жизни, данное Ф.Энгельсом в его труде «Анти-Дюринг», впервые полностью опубликованном в 1878 г. Обычно цитируют только первую часть этого определения. Приведем его полностью: «Жизнь есть способ существования белковых тел, и этот способ существования состоит по своему существу в постоянном самообновлении химических составных частей этих тел». В наши дни, когда о жизненно важных веществах и процессах известно неизмеримо больше, такое определение не может не вызывать ощущение неполноты и ограниченности. Однако и сам автор определения осознавал его уязвимость, написав в той же книге двумя страницами ниже: «Наше определение жизни, разумеется, весьма недостаточно, поскольку оно далеко от того, чтобы охватить все явления жизни, а, напротив, ограничивается самыми общими и самыми простыми среди них...»
По-видимому, Ф.Энгельс был первым из крупных философов, отметивших важность белков в жизнедеятельности организмов. По мере накопления новых биологических знаний эта тема постоянно остается предметом обсуждения и острых споров. Например, в 1969 г. автору этих строк довелось быть свидетелем дискуссии между двумя почтенными академиками – В.А. Энгельгардтом (1894–1984) и М.Н. Ливановым (1907–1986) о том, какие вещества – белки или нуклеиновые кислоты – являются определяющими в процессах памяти. Биохимик и физиолог затронули не только биологическую, но и философскую тему, поскольку память является неотъемлемой частью человеческого мышления, а мышление, как отмечено выше, – одна из философских проблем, составляющих ее определение как науки.
Очевидно, что все более глубокое философское осознание сущности живого и роли белков в жизнедеятельности будет происходить и в дальнейшем, но для этого необходимо исчерпывающе представлять себе всю проблему белков и пептидов, начиная с ее основ, которые мы и намереваемся обсудить.
Химия
Часто говорят, что белки состоят (образованы) из аминокислот. Несмотря на то что смысл этого утверждения прост и многим понятен, химик может отметить, что оно некорректно. Почему?
Да, действительно, в образовании белков участвуют аминокислоты. Однако при соединении друг с другом они перестают быть таковыми с химической точки зрения. Рассмотрим этот процесс более детально.
В живых организмах открыто несколько сотен различных аминокислотных структур, и все они могут быть охарактеризованы одной общей химической формулой в двух вариантах:
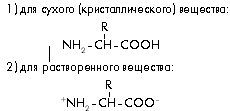
Во всех аминокислотах имеются аминная –NH3+ (N-конец) и карбоксильная –COO– (С-конец) группы, которые определяют соответственно основные и кислотные проявления этих веществ, в результате чего они обладают амфотерными (как щелочными, так и кислотными) свойствами.
Из приведенных формул также видно, что все эти вещества различаются лишь радикалами R. В образовании белков участвует 20 так называемых стандартных аминокислот, т.е. 20 различных радикалов R (табл. 1). Не обсуждая подробно химические особенности каждого радикала, отметив их лишь разными числовыми индексами i (R i), посмотрим, что произойдет с аминокислотами после соединения друг с другом.
Следующая формула характеризует вещество (трипептид) – результат соединения трех аминокислот (в растворе):
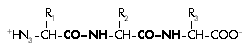
Присоединение 1-й аминокислоты ко 2-й и 2-й к 3-й сопровождается суммарным отщеплением двух молекул воды с образованием связей CO–NH, выделенных в формуле жирным шрифтом. Эта связь является ковалентной (сильной), называется пептидной, и ее название послужило основой для того, чтобы все вещества, устроенные подобным образом, называть пептидами (белки тоже являются пептидами) вне зависимости от того, сколько аминокислот участвовало в их образовании.
Таким образом, от второй аминокислоты, характеризующейся радикалом R2, остался лишь фрагмент:
![]()
Он называется аминокислотным остатком. Все аминокислотные остатки, расположенные не на концах большой пептидной цепи, характеризуются данной формулой, а концевые, очевидно, тоже не совсем аминокислоты, а остатки, хотя и несколько иные. С точки зрения химика корректно говорить, что белки состоят не из аминокислот, а из аминокислотных остатков. Поэтому общая химическая формула любого белка (пептида), состоящего из n аминокислотных остатков, должна быть записана как:
![]()
Приведенная формула свидетельствует о том, что в простейшей записи любой белок представляет собой линейную последовательность аминокислотных остатков, в которой есть остов (как бы скелет) с регулярно повторяющейся последовательностью радикалов –NH–CH–CO– и выступающие из этого остова боковые радикалы. Такая запись характеризует первичную структуру белка.
Последовательность аминокислотных остатков принято рассматривать в одном определенном направлении – от N- к С-концу. В связи с расшифровкой огромного количества природных аминокислотных последовательностей, а также в целях экономии места и ресурсов вычислительной техники в настоящее время принято пользоваться однобуквенной (латинской) записью аминокислотных остатков (однобуквенный аминокислотный код). В табл. 1 приведены не только общепринятые обозначения аминокислотных остатков, но также показано, какие существенные физико-химические особенности их отличают. Многообразие этих свойств лежит в основе способности каждой индивидуальной аминокислотной последовательности принимать свою, уникальную пространственную конфигурацию, и так же, как и аминокислоты, практически всегда быть амфотерным веществом.
Рассмотрение белков и пептидов с позиций химии будет неполным, если не отметить то, что иногда после синтеза белка на рибосоме (трансляции) происходит химическая модификация некоторых аминокислотных остатков (посттрансляционная модификация). В результате, например, остатки пролина и лизина могут превращаться в остатки оксипролина и оксилизина, к тирозильному остатку порой присоединяется сульфатная группа и т.д. Этот процесс приводит к тому, что в организме одновременно сосуществуют белки или пептиды с модифицированными и немодифицированными остатками. Так, пептид гастрин может быть сульфатирован и несульфатирован по одному из остатков тирозина, и, что очень важно в проявлении физиологических функций, сульфатированный гастрин существенно более активен.
Русский, English, Deutsch…
Слово белок появилось в русском языке задолго до того, как была выяснена химическая природа этого вещества. Этот термин представляет собой производное от прилагательного «белый» и служит характеристикой различий двух разных по цвету основных компонентов куриного яйца (белка и желтка). Синонимом белка является слово «протеин» (англ. protein), которое используется во всей научной (и не только научной) литературе и происходит от греческого слова prwto – прото (первый, главный, важнейший), чем с давних времен подчеркивалась его исключительная роль. А латинское слово белок – albumen (или albuminis), альбумин используется для целой группы уже давно известных белков.
Другое ключевое слово – пептид – происходит от греческого пепто (варить, переваривать) и отражает процесс расщепления длинных белковых молекул, в результате чего образуются короткие фрагменты. Однако, как уже было отмечено, с позиций химии, пептидами являются все белки. Поэтому для разделения коротких и длинных пептидных цепей в качестве приставок используются два других греческих слова: Хligoj –олигос (немногий, малый) и приставка polЪ – поли- (много, многое). В результате олигопептидами (или часто для краткости – пептидами) называют сравнительно короткие аминокислотные последовательности, а полипептидами (белками) – длинные. В дальнейшем мы часто будем пользоваться терминами белок и пептид, учитывая указанное различие.
Названия белков и пептидов очень разнообразны. Первоначально они давались в то время, когда их химическая (первичная) структура была еще неизвестна. Целым группам белков присваивались названия на основании того, как они растворяются в воде, в растворах нейтральных солей, щелочах, кислотах и органических растворителях (например, протамины). Однако затем наибольшее число названий конкретных веществ пептидной природы стало даваться по названию органа, ткани или целого животного, из которого они были выделены, и по функциям, которые они осуществляют.

Первый олигопептид был получен из мясного фарша и поэтому назван карнозином (от лат. carnis – мясо), название одного из основных белков мяса – миозин – произошло от соответствующего греческого слова мышца (mаj – миос), а целая группа белков гистонов получила название от греческого слова (istТ – хистос), характеризующего понятие ткань. Примером использования названия животного служит ксенопсин, выделенный из африканской гладкой шпорцевой лягушки Xenopus laevis. Функциональные свойства олигопептидов отражены, например, в названиях брадикининов и тахикининов, вызывающих, в частности, ослабление (брадикардию) и усиление (тахикардия) сердечной деятельности. Некоторые названия хранят в себе название места, где они были открыты: ригин – в г. Рига (Латвия), а тафтцин – в Тафтском университете (США). Можно долго рассказывать об этой стороне предмета, поскольку число подобных примеров исчисляется тысячами. Однако предоставим это занятие профессиональным историкам науки для всестороннего и полного исследования, тем более что такие работы уже ведутся. Приведем только один пример.
В 30-е гг. прошлого века в Германии из сыворотки крови лошади было выделено вещество, которому присвоили название субстанция P (P – латинское). В то время еще не умели определять химическую структуру достаточно больших пептидов, однако было ясно, что соединение относится к этому классу веществ. Через многие годы, когда автора работы уже не было в живых, встал вопрос: а почему вещество названо именно так? В результате появилось три гипотезы, ни одна из которых до сих пор однозначно не обоснована. Первая из них очевидна – получен белок, и в названии использована первая буква от английского слова protein. Вторая основана на том, что вещество было получено в виде порошка, а это английское слово (pouder) также начинается с буквы «P». И, наконец, третья обращена к родному языку автора, на этом языке (немецком) животное, из которого выделено вещество (лошадь), пишется как das Pferd.
Белки и пептиды изучают чуть ли не во всех странах, а в научных публикациях на эту тему используются языки многих народов мира. Если в начале истории изучения этих веществ большинство научных работ считалось престижным писать на французском или немецком, то примерно с середины прошлого века стало традицией публиковать работу с новыми принципиальными результатами наряду с родным языком также и на английском.
Элементарная математика и информатика
Удивительная простота изначальной (первичной) структуры белков и олигопептидов позволяет провести простой математический анализ всей совокупности этих веществ. Сначала зададимся вопросом: сколько существует разных линейных последовательностей, в написании которых может быть использовано 20 стандартных аминокислотных остатков? Если через N обозначить число возможных последовательностей, а через n – количество аминокислотных остатков в молекуле, то ответ на поставленный вопрос даст простейшая алгебраическая формула, учитывающая все возможные повторы аминокислотных остатков в одной структуре:
N = 20n.
Из этой формулы следует, что максимальное число разных дипептидов (n = 2) равно 400, трипептидов (n = 3) – 8000, тетрапептидов (n = 4) – 160 000 и т.д. Как видим (см. табл. 2), число N очень быстро растет с увеличением n.
Тогда возникает другой вопрос: а каковы возможности живого организма вмещать в себя подобную информацию? Первичная информация содержится в нуклеотидной последовательности, и хотя она и очень велика, но все же не беспредельна. В табл. 3 представлены числа азотистых оснований суммарной ДНК у представителей разных царств живой природы. Первое, на что обращаешь внимание, это то, что общее их число варьирует в очень широких пределах и может составлять от 107 (некоторые бактерии и грибы) до 1011 (представители растений и рыб). При этом заметим, что царь природы человек отнюдь не является чемпионом среди других представителей живой природы, довольствуясь лишь примерно одним миллиардом азотистых оснований. Но для нас главное не это. Оказывается, самый большой геном не может вместить информацию даже о всех возможных декапептидах (n = 10) при их последовательном расположении.
Действительно, при n = 10:
N = 6,7х1011.
Eсли учесть то, что для записи одного аминокислотного остатка требуется 3 азотистых основания и что часть генома, шифрующая аминокислотные последовательности, составляет только несколько процентов от его общей величины, то получается, что самый большой геном способен вместить информацию о последовательности, состоящей лишь из 109 аминокислотных остатков. Таким образом, в нем может содержаться информация менее чем об 1% всех возможных декапептидов. А ведь известны белки, содержащие более 5 тыс. аминокислотных остатков!

Отсюда следует вывод о том, что в природе встречаются далеко не все линейные комбинации аминокислотных остатков. Это подтверждается компьютерным анализом встречаемости различных линейных комбинаций аминокислотных остатков во всех расшифрованных белках и пептидах (более 100 тыс.). Полученные результаты приведены в табл. 2, данные которой свидетельствуют о том, что в случае уже октапептидов (N = 8) встречается всего лишь около 0,001% возможных линейных комбинаций аминокислотных остатков.
А способна ли математика ответить на вопрос, решенный лингвистикой: можно ли дать строгое определение разницы между малыми и большими пептидами (олигопептидами и полипептидами)?
Попробуем на него ответить, пользуясь рассуждениями нашего великого соотечественника математика Андрея Николаевича Колмогорова (1903–1987), о малых (S) и больших (G) числах, свидетелем которых автор был на семинаре в МГУ в 1958 г. Колмогоров рассуждал примерно так. Числа существуют в определенной системе счисления. Система счисления, которой пользуется подавляющая часть человечества, определяется величиной m = 10. Тогда в рамках этой десятичной системы малыми числами будут такие, которые удовлетворяют условию m > S > m, а большие – G >> m. Иными словами, малые числа по порядку величины сравнимы с величиной основания системы счисления, а большие – во много раз ее больше.
К олигопептидам и белкам эти рассуждения можно применить таким образом. Еще раз отметим то, что эти вещества формируются из 20 различных аминокислотных остатков, а обычно используемые числа образуются из 10 разных цифр. Следовательно, аналогом числовой системы счисления в нашем случае является аминокислотная система счисления, характеризующаяся величиной 20, и тогда малыми (олигопептидами) можно считать такие, в которых содержится меньше или больше 20 аминокислотных остатков (20 > n > 20), а большие – у которых их много больше 20, (n >> 20). Этот критерий является чисто математическим, но, однако, его можно увидеть и в физических, и в биологических свойствах олигопептидов и белков. Но об этом будет рассказано в последующих разделах.
Физика
Ключевыми в физике являются понятия: взаимодействия, энергия и энтропия (энтропия – мера неупорядоченности, соответственно, отрицательная энтропия – мера упорядоченности). При физическом взгляде на мир белков и олигопептидов такие понятия также весьма полезны. Молекулы этих веществ осуществляют взаимодействия как внутри себя, так и с внешними молекулами. Эти взаимодействия направлены на приобретение отдельными молекулами или молекулярными комплексами определенной пространственной формы (конфигурации или конформации), что в конкретных условиях приводит к достижению минимально возможной энергии при данной степени неупорядоченности. А многообразие возможных аминокислотных последовательностей лежит в основе неизмеримо большего многообразия их возможных пространственных (уже не линейных) конфигураций.
Как сравнительно просто устроена ДНК! Для выявления общей конфигурации ее двойной спирали в начале 1950-х гг. прошлого века Уотсону и Крику, любившим обсуждать научные проблемы за чашечкой кофе, потребовалось выпить не очень много литров этого тонизирующего напитка, чтобы разобраться в принципах ее организации. Так же немного времени (всего несколько лет) потребовалось на то, чтобы в 1960-х гг. описать, как последовательность азотистых оснований ДНК и РНК транслируется (переводится) на язык аминокислотных остатков. Казалось бы, еще немного (допустим, не более 10 лет), и общие принципы формирования пространственной структуры белков будут найдены! Эта проблема получила название проблемы фолдинга (от англ. fold – складывать). Однако нет. Прошло уже почти 40 лет после начала экспериментального получения пространственных структур белков, а тайна пока не раскрыта. Тысячи ученых разных специальностей в течение этого времени (некоторые – всю свою творческую жизнь) пытались создать универсальный метод построения пространственной структуры белков по аминокислотной последовательности (как это делается в природе), но никому данную проблему не удалось решить даже для одной не слишком протяженной структуры. Почему?
В отличие от ДНК или РНК, составленных всего из 4 стандартных азотистых оснований, белки включают 20 стандартных аминокислотных остатков. Это приводит к тому, что число возможных взаимодействий пар остатков (как соседствующих, так и удаленных) оказывается более чем на порядок больше, чем для пар азотистых оснований. А в пространстве могут взаимодействовать одновременно не 2, а более остатков, в результате чего число возможных взаимодействующих единиц на много порядков больше. Важным является то, что весь остов транслированной пептидной цепи является прочным, поскольку все его элементы, включая и пептидную связь, объединены сильными химическими (ковалентными) связями. Химическая связь между удаленными аминокислотными остатками бывает, как правило, только одного типа в случае, когда два остатка цистеина образуют дисульфидную связь (S-S связь, или S-S мостик). Это существенно уменьшает число возможных конфигураций. Однако и при наличии S-S связей у протяженных полипептидов остается еще много степеней свободы для образования разных конфигураций, и, кроме того, существует немало белков, в которых остатки цистеина отсутствуют.
Следует учитывать и то, что характер взаимодействий этих сближенных аминокислотных остатков разный, поскольку одни из них являются заряженными, что приводит к электростатическому взаимодействию, другие (полярные) способны участвовать в дипольных и еще более сложные взаимодействиях. Сблизившимся плоским циклическим группам для достижения минимальной энергии выгодно занять плоско-параллельное положение, и это приводит к стэкинг(стопочному)-взаимодействию, а неполярным (гидрофобным) группам из тех же соображений выгодно выйти из полярного окружения (водной среды), сблизиться и объединиться друг с другом (гидрофобные взаимодействия).
Все эти взаимодействия намного слабее ковалентных связей. А еще существуют водородные связи, энергия которых также мала, но при большом их числе они могут кардинально изменить общую конфигурацию молекулы и придать ей пространственно регулярную форму вторичной структуры (спирали, слоя, шпильки). В результате осуществления всех типов слабых взаимодействий в белках могут формироваться сложнейшие пространственные образования (третичная структура). На рис. 1 приведен пример такой третичной структуры сывороточного альбумина быка, состоящего из 607 аминокислотных остатков (без цистеинов, т.е. без S–S-связей), и полученной в результате применения сложнейшего экспериментального физического метода, называемого рентгеноструктурным анализом. У этой молекулы можно увидеть и спирали, и сближение этих спиралей, и группы различных субмолекулярных образований (доменов), и просто связующие участки. Такая компактная молекула имеет форму глобулы (от лат. globules – шарик) и поэтому называется глобулярной структурой.
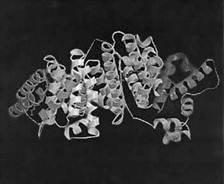
Рис. 1. Третичная (пространственная) структура сывороточного альбумина, состоящего из 607 аминокислотных остатков
Существуют также фибриллярные белки (от лат. fibra – волокно), которые сильно вытянуты (например, мышечный белок миозин).
Но как ни сложна показанная на рисунке пространственная структура, она еще не самая сложная. Можно представить себе, сколько дополнительных проблем для теоретического (и экспериментального) анализа возникает при рассмотрении не одной, а двух или более взаимодействующих белковых молекул (четвертичная структура).
Казалось бы, в случае олигопептидов все должно быть проще и доступнее для анализа (и теоретического, и экспериментального). Однако это не так. И тут мы подошли к обещанному физическому определению различия между поли- и олигопептидами.
Связи между аминокислотными остатками (за исключением ковалентных) по энергии много меньше химических, отражают сущность физических процессов и поэтому называются физическими (в общем смысле они уже являются не связями, а взаимодействиями).
Каждое отдельное из этих взаимодействий является непрочным, может образовываться и распадаться, т.е. характеризоваться каким-то временем существования. Однако при увеличении длины пептидной цепи число таких одновременных взаимодействий возрастает, и с достижением некоторой длины их суммарное действие приводит к тому, что молекула принимает все более стабильную конфигурацию.
Из термодинамических исследований следует, что эта длина составляет около 50 аминокислотных остатков и может быть меньше или больше в зависимости от конкретной аминокислотной последовательности, т.е. от присутствия и расположения разных взаимодействующих элементов.
Таким образом, физические данные согласуются с теми, которые были нами получены из математических рассуждений, поскольку число 50 является величиной того же порядка, что и 20, характеризующее «аминокислотную систему счисления». Поэтому олигопептиды – вещества с числом аминокислотных остатков порядка 50, а у полипептидов (белков) это число много больше 50.
Итак, поскольку число аминокислотных остатков у олигопептидов мало, а следовательно, и внутримолекулярных взаимодействий у них недостаточно для образования стабильной пространственной структуры, то их конфигурация постоянно изменяется в масштабах времени микромира (в нашем временном масштабе их можно сравнить с извивающимся червяком, выползшим на поверхность во время сильного дождя).
Одним из следствий таких постоянных и быстрых изменений является то, что из этих молекул трудно (или невозможно) получить кристаллы и вследствие этого исследовать с помощью рентгеноструктурного анализа. Правда, существует еще один мощный метод (ядерный магнитный резонанс, ЯМР), с помощью которого удается получить целые наборы конфигураций. Однако и в этом методе требуется использование сильно концентрированных растворов пептидов, в такой системе уже может осуществляться межмолекулярное взаимодействие одинаковых молекул пептидов друг с другом, что влияет на получающийся результат и фиксирует конфигурацию (конформацию) не только отдельной, но и взаимодействующей с другими пептидной молекулы.
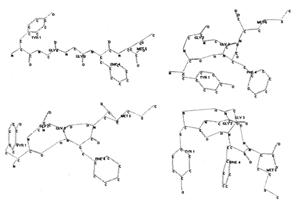
Рис. 2. Возможные пространственные структруры мет-энкефалина с аминокислотной последовательностью YGGFM. Пунктиром отмечены водородные связи
На рис. 2 показаны 4 возможные структуры природного пептидного опиоида энкефалина, состоящего из 5 аминокислотных остатков. Насколько они разные! Первая (развернутая) с большим трудом была получена с помощью рентгеноструктурного анализа. Три другие рассчитаны с применением специальных методов компьютерного моделирования, в результате чего получены структуры, содержащие от одной до трех внутримолекулярных водородных связей и очень сильно отличающиеся по конфигурации. Малость молекулы олигопептида позволяет ей в живом организме перемещаться на довольно большие расстояния, а высокая внутримолекулярная подвижность – принимать форму, необходимую для успешного взаимодействия со многими веществами, в том числе и с крупными белками (например, с рецепторами).
Биология
Многообразие структурных форм белков и олигопептидов лежит в основе многообразия и их биологических функций. Это многообразие обусловливает то, что единой и строгой классификации веществ пептидной природы не существует, и пока есть сомнения в том, что такую классификацию в ближайшее время можно будет создать. Поэтому представляется возможным лишь грубо и далеко неполно охарактеризовать лишь часть структурно-функциональных групп белков, что и представлено в табл. 4.
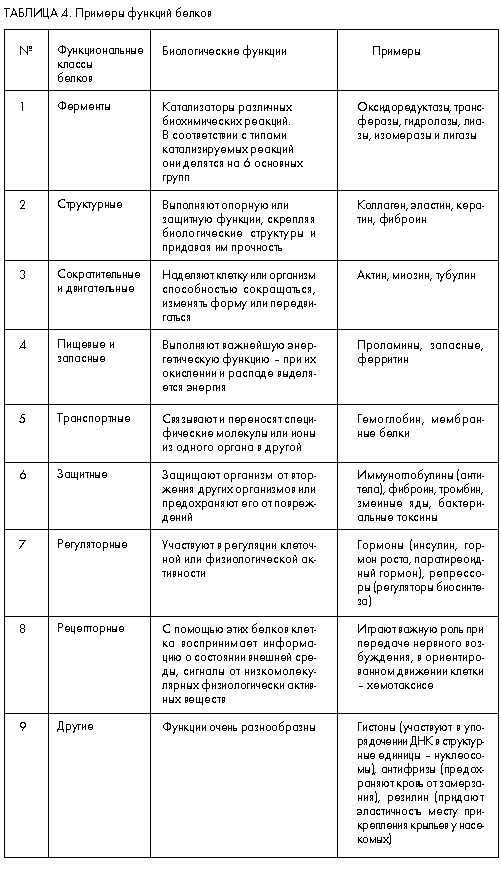
Функциональные свойства белков изучаются уже довольно давно, еще даже до тех времен, когда научились определять их аминокислотную последовательность. Многие из этих свойств широко известны, в том числе вошли и в школьные учебники. Поэтому нам кажется целесообразным более подробно охарактеризовать биологические свойства олигопептидов, которые начали изучать сравнительно недавно. А в отношении белков отметим лишь одну, но принципиальную особенность.
В табл. 4 среди прочих приведены примеры белков, которые называются сложными и представляют собой комплексы белка с молекулами непептидного типа (например, гемоглобин содержит железо, а казеин – фосфорную кислоту). Однако белки могут объединяться и с более сложными веществами, образуя гликопротеины, являющиеся обязательным компонентом клеточных поверхностей и внеклеточных опорных систем, или липопротеины, осуществляющие обмен липидами между печенью и другими органами.
Для олигопептидов (табл. 5) также не существует строгой структурно-функциональной классификации. К настоящему времени расшифровано более 4 тыс. разных аминокислотных последовательностей этих веществ, выделенных из животных, растений, грибов, бактерий и вирусов. Большинство из них по своим физиологическим функциям относят к регуляторным веществам, участвующим в регуляции всех основных регуляторных систем организма – нервной, эндокринной и иммунной. В соответствии с этим они и называются нейропептидами, олигопептидными гормонами и иммуномодуляторами. Кроме того, ряд олигопептидов рассматривается как медиаторы, прямо участвующие в синаптической передаче (нейропептиды), и модуляторы, осуществляющие регуляцию опосредованно (в том числе гормоны). Значительное число олигопептидов выполняет также защитные функции, представляя собой олигопептидные токсины.
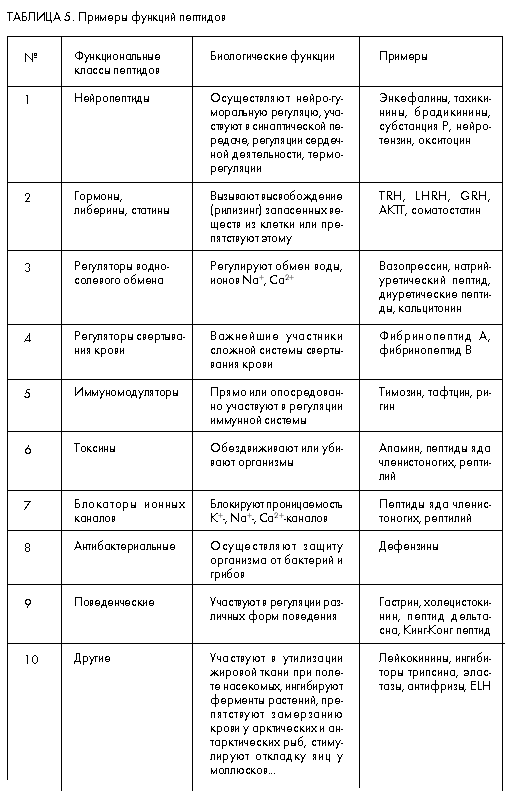
Нетрудно заметить, что часть функциональных свойств олигопептидов перекрывается с функциями белков (например, гормональные). Однако, как было уже отмечено выше, в силу разной подвижности целой молекулы и ее частей (конформационной подвижности) механизмы действия олигопептидных и белковых молекул разные.
Известны также примеры совершенно удивительных явлений и процессов, осуществляемых с участием природных олигопептидов. Приведем лишь некоторые из них.
Все знают об антибиотиках как об особом классе специфических веществ, способных подавлять деятельность микроорганизмов (или грибов) и использующихся в качестве лекарственных средств. Раньше эти вещества рассматривались как чужеродные человеку и большинству животных. Однако за последние два десятилетия выяснилось, что у млекопитающих (в том числе и в нейтрофилах крови человека), в коже амфибий (например, лягушек) в гемолимфе многих насекомых, в яде ряда рептилий (например, змей) образуются собственные антибиотики олигопептидной природы, обладающие антибактериальной активностью. Таким образом, эти вещества могут рассматриваться как еще один компонент иммунной регуляции.
Также всем хорошо известен функциональный класс наркотических веществ. Среди них – опий, представляющий собой высохший млечный сок из надрезов на незрелых коробочках опийного мака. В нем содержится около 20 различных алкалоидов, из которых морфин является основным в наркотическом действии на человеческий организм. А в 1975 г. группой английских ученых было обнаружено, что в мозге быка (и человека) присутствуют свои собственные вещества (энкефалины), обладающие морфиноподобным действием. Более того, природные фрагменты белков молока и мяса (казеина и гемоглобина) также обладают этим свойством, в результате чего они получили названия казоморфинов и геморфинов. Интересно, какова их физиологическая роль? Всем известно, что грудные младенцы, питающиеся в основном молоком матери, большую часть своей начальной жизни проводят во сне. Не эти ли вещества являются причиной такого поведения?
Коснувшись проблемы сна, нельзя не отметить и обнаружение олигопептида с весьма сложным названием – пептид, вызывающий дельта-сон. В этом названии, собственно, и описана функция, которая ему приписывается.
Какая только регуляция не осуществляется с участием природных олигопептидов! Например, в 1981 г. немецкие ученые Г.Шаллер и Г.Боденмюллер обнаружили, что у кишечнополостных (гидры и медузы) образуется специальный олигопептид, состоящий из 11 аминокислотных остатков и участвующий в морфогенезе. Потребовалось 10 лет для культивирования гидр, чтобы получить 3 кг необходимого материала для экстракции и выделить всего 0,5 мкг чистого олигопептида для определения аминокислотной последовательности. Однако эти гигантские усилия были вознаграждены. Впервые было показано, что полученный олигопептид способен вызывать стимуляцию роста головы животного. Но самое удивительное то, что через 3 года этими же учеными точно такой же олигопептид был обнаружен и в крови человека!
По-видимому, олигопептиды участвуют чуть ли не во всех физиологических процессах. В пищеварительной системе многих организмов сосуществуют олигопептиды противоположного действия – вызывающие чувство голода (гастрины) и сытости (холецистокинины). У насекомых при полете используются олигопептиды, участвующие в утилизации жировой ткани для выделения энергии, затрачиваемой на движение крыльев.
Многие животные продуцируют олигопептидные феромоны, привлекающие особей противоположного пола. Наконец, многие олигопептиды участвуют во вкусовом восприятии. Одни из них на вкус горькие, а другие – сладкие. Есть и такие, сладость которых в тысячи раз больше, чем у обычного сахара. А один из олигопептидов, выделенный из жареной говядины, получил название деликатесного за свой вкус.
Перечисление функциональных (биологических) свойств природных олигопептидов можно было бы продолжать довольно долго. Но в общем уже должно быть понятно, что олигопептиды в биологии существуют везде и их физиологическое действие практически безгранично.
Здоровье
Очевидно, что набор белков и олигопептидов у здорового организма должен быть вполне определенным. Отклонения от нормы могут приводить к заболеваниям, порою тяжким.
Одним из таких заболеваний является серповидноклеточная анемия, распространенная в ряде областей Африки, Индии, в некоторых средиземноморских странах и среди негритянского населения Северной Америки. У больных этой болезнью периодически (чаще под влиянием физической нагрузки) возникают приступы резкой слабости, тошноты и одышки. Внешняя причина – в необычно большом количестве незрелых эритроцитов и эритроцитов, имеющих форму тонкого серпа, что послужило основанием для такого названия этой болезни. Однако есть и более глубокое объяснение. Оказалось, что нормальные эритроциты содержат нормальный гемоглобин А, а серповидноклеточные – аномальный гемоглобин S. Выяснилось, что эти два белка отличаются всего одним аминокислотным остатком – в результате мутации в аномальном гемоглобине вместо остатка глутаминовой кислоты (E, табл. 1) на положенном месте стоит остаток валина (V). Замена лишь одного остатка и приводит к этому тяжкому заболеванию.
Обратившись к табл. 1, можно увидеть, что эти остатки несут принципиально разные боковые радикалы, и в мутантном гемоглобине осуществляется замена заряженного (отрицательно) радикала на гидрофобный.
В результате такой гемоглобин складывается в другую пространственную конфигурацию, и происходят последующие изменения как на клеточном уровне, так и на уровне целого организма.
Другой пример относится к онкологии. У человека, заболевшего одним из видов легочной карциномы, обнаруживают олигопептиды, которых у здорового организма нет. Эти олигопептиды – бомбезин и физалаэмин – в норме встречаются у европейской (Bombina bombina) и южноамериканской (Physalaemus fuseumaculatus) лягушек. В данном случае мутаций не было. В процессе начавшегося канцерогенеза у человека стали экспрессироваться (попросту говоря, работать) ранее «молчавшие» гены, в результате чего и образовались олигопептиды, информация о которых хранилась и в здоровом организме.
К проблеме здоровья относится также и то, насколько свежую (неиспорченную) пищу мы потребляем. При хранении открытых продуктов питания на воздухе в них поселяются различные патогенные микроорганизмы, и при достижении некоторого уровня их содержания пища может стать опасной для здоровья. Так почему же не добавлять к этим продуктам природные (человеческие) антибактериальные олигопептиды? Это безопасно для человека и позволяет дольше сохранять пищу при том, что сами эти вещества будут хотя и небольшим, но также пищевым компонентом.
Пошатнувшееся здоровье чаще всего лечат с помощью лекарств. Среди них – множество веществ абиогенного происхождения. Однако в ряде случае
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Хромосомы и пол
С.Ю. АфонькинОбщая схема полового цикла и его регуляцияГены сексаСразу надо оговориться – речь пойдет не о наследственных задатках, оп
- Холестериновая угроза. Миф или реальность?
С.Ю. АфонькинИшемия и атеросклерозВ подавляющем большинстве случаев недостаток кровоснабжения различных органов является следствием
- Суккуленты
А.П. Хохряков, И.Е. СиневСуккуленты знакомы всем, даже тем, кто об этом не подозревает. Эти причудливой формы растения с сочными (от лат. suc
- Грибковые заболевания кактусов и суккулентов
Грибковые заболевания наиболее распространены при неправильном уходе. Самое любимое время их возникновения — холодное время года при
- Вредители комнатных растений и меры борьбы с ними
Левданская П. И., Мерло А. С. Наиболее опасны для комнатных растений паутинный клещик, трипс, тли, щитовки, червецы, нематоды и др.Паутинны
- Общие положения по защите растений от насекомых вредителей
Осенний загородный участок необыкновенно красив. Лучи солнца, пронизывая холодный воздух, золотят стволы и кроны деревьев. Легкий вете
- Зеленые удобрения на садовом участке
Н.М.Жирмунская Зеленое удобрение обычно широко применяется в полеводстве и значительно реже на садовых участках. Тем не менее известно
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

