Структура и состав биологических мембран
Структура и состав биологических мембран
Содержание
1. Роль мембран и их разнообразие
2. Исторический очерк
3. Морфология мембран
3.1 Дифракция рентгеновских лучей
3.2 Электронная микроскопия
4. Выделение мембран
4.1 Разрушение клеток
4.2 Разделение мембран
4.3 Критерии чистоты мембранных фракций
1. Роль мембран и их разнообразие
Мембраны играют ключевую роль как в структурной организации, так и в функционировании всех клеток - прокариотических и эукариотических, растительных и животных. Мембраны формируют внутриклеточные компартменты, с их помощью происходит разделение содержимого компартментов и окружающей их среды. Но если бы это была единственная функция мембран, они не были бы для нас столь интересны. Мембраны не только разделяют клетку на отдельные компартменты, но и участвуют в регуляции всех связей и взаимодействий, которые осуществляются между наружной и внутренней сторонами этих компартментов. Это может проявляться в виде физического переноса ионов или молекул через мембрану или в форме передачи информации при помощи конформационных изменений, индуцируемых в мембранных компонентах. Кроме того, с мембранами связаны многие клеточные ферменты. Некоторые из них катализируют трансмембранные реакции, когда реагенты находятся по разные стороны мембраны или когда каталитический акт сопровождается транспортом молекул. Другие ферменты образуют своеобразные комплексы, которые осуществляют цепь последовательных превращений, причем благодаря тому, что эти ферменты располагаются в плоскости мембраны, повышается эффективность всего процесса. Имеются ферменты, которые, действуя на мембраносвязанные субстраты, участвуют тем самым в биосинтезе мембран. С участием мембран в той или иной степени осуществляется большинство жизненно важных клеточных функций, например протекают такие разные процессы, как репликация прокариотической ДНК, биосинтез белков и их секреция, биоэнергетические процессы и функционирование систем гормонального ответа.
Данные, полученные при изучении клеток млекопитающих методом электронной микроскопии, свидетельствуют о наличии широко развитой сети внутриклеточных мембранных образований, которая занимает значительную часть внутреннего объема клетки. Сейчас уже не вызывает сомнений, что основные принципы структурной организации всех этих мембран по сути одинаковы. Более того, эти принципы соблюдаются также и в случае мембран растительных и бактериальных клеток. Основные закономерности, установленные Робертсоном в конце 1950-х гг., позволяют нам переносить результаты, полученные при исследовании одной мембранной системы, на другие системы. Естественно, учет специфики здесь необходим, поскольку, как это ни парадоксально звучит, одной из самых характерных особенностей мембран является их чрезвычайное разнообразие. Такое разнообразие обусловлено прежде всего разнообразием белков, присутствующих в каждой мембране, и способов их взаимодействия друг с другом и с компонентами цитоплазмы. Эти взаимодействия в конечном счете проявляются в специфической морфологии мембранных образований и могут быть связаны с латеральной гетерогенностью той или иной мембраны. Таким образом, основная задача заключается в том, чтобы, опираясь на общие представления о структуре и функциях мембран, выявить молекулярно-биологические основы их структурного и функционального разнообразия.
Успехов в исследовании мембран удалось достичь благодаря сравнительному изучению мембран из множества разнообразных организмов. Бактериальные клетки имеют довольно простую наружную оболочку, содержащую одну или две мембраны, которые можно модифицировать генетически или путем изменения условий роста клеток. Вирусы с оболочкой внедряются в клетки животных благодаря слиянию с плазматической мембраной последних и высвобождаются из клетки-хозяина, отпочковываясь от нее. Изучение созревания вирусных белков позволяет узнать много нового о процессах биосинтеза мембранных белков.
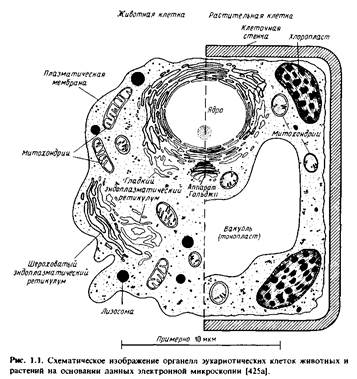
Эукариотические клетки содержат различные мембранные орга-неллы, причем каждая мембрана уникальна по своему составу, особенностям структурной организации и по характеру выполняемых функций. Для того чтобы понять мотивы исследований, описанных в последующих главах, необходимо получить некоторые общие представления о биологических функциях различных мембранных систем. На рис.1.1 схематически изображены мембраны, обычно представленные в животной и растительной клетках. Заметим, что внешний вид органелл неодинаков в клетках разного типа. Кроме того, некоторые клетки, например палочки сетчатки, а также клетки скелетных мышц, имеют высокоспециализированные мембраны, выполняющие уникальные функции.
Плазматическая мембрана. Плазматическая мембрана образует границу, на которой осуществляется контакт клетки с ее окружением.
Она содержит специализированные компоненты, участвующие в межклеточных контактах и взаимодействиях, в системах гормонального ответа и транспорта как малых, так и больших молекул из клетки и внутрь ее. Однако и сама плазматическая мембрана состоит из специализированных участков, которые имеют различное окружение. На рис.1.2 изображены апикальный и базолатеральный участки плазматической мембраны гепатоцитов и поляризованных эпителиальных клеток. Апикальная мембрана контактирует с какой-либо внутриклеточной средой. Так, у гепатоцитов она обращена в просвет желчных канальцев, а у эпителиальных клеток кишечника - в просвет желудочно-кишечного тракта.
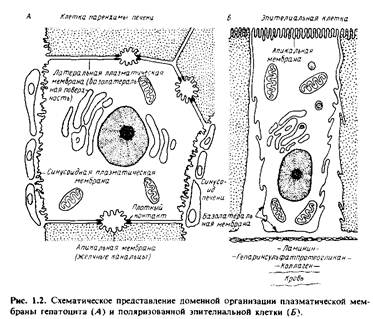
Она может иметь специализированные структуры, например микроворсинки; последние в некоторых всасывающих клетках образуют щеточную каемку. Микроворсинки значительно увеличивают площадь поверхности мембраны, в результате чего повышается эффективность мембранного транспорта. Базолатеральная мембрана находится в контакте с другими клетками или обращена в просвет кровеносных сосудов. Латеральная и синусоидная мембраны гепатоцитов различаются как по своей морфологии, так и биохимически.
Базолатеральная мембрана гепатоцитов имеет также специализированные структуры, ответственные за межклеточную адгезию и транспорт. Плотные контакты герметизируют область соприкосновения клеток и предотвращают перемешивание содержимого желчных канальцев и кровеносных сосудов.
Щелевые контакты содержат множество регулярно расположенных пор, которые позволяют небольшим молекулам проходить через плазматические мембраны двух соприкасающихся клеток. Электронно-микроскопические и биохимические исследования выявили характерные детали молекулярной организации этих пор, показав, что каждая из них содержит гексагонально упакованные белковые субъединицы.
Десмосомы также обеспечивают клеточную адгезию и участвуют во взаимодействии плазматической мембраны с элементами цитоскелета.
Апикальный, латеральный и синусоидный участки плазматической мембраны различаются морфологически и имеют уникальный состав и функции. Если клетки разрушить в мягких условиях, то можно выделить и очистить фракции, отвечающие этим участкам плазматической мембраны. Как на молекулярном уровне обеспечивается в клетке существование таких специализированных доменов, пока неясно, хотя известно, что не все их компоненты способны свободно диффундировать между доменами.
Ядерная мембрана. Ядерная оболочка клетки, находящейся в интерфазе, на электронных микрофотографиях имеет вид двух элементарных мембран с узким просветом между ними, называемым перинуклеарным пространством. Эта мембрана происходит из эндоплазматического ретикулума и, по-видимому, неразрывно связана с ним. Наиболее характерными морфологическими признаками являются порообразные структуры. Они имеют диаметр около 600 А и состоят из морфологически четко выявляемых компонентов, образующих октагональную решетку. В том месте, где расположены эти структуры, внутренняя и наружная ядерные мембраны выглядят слившимися. Полагают, что поры позволяют комплексам мРНК-белок переходить из ядра в цитоплазму, а регуляторным белкам перемещаться в обратном направлении, из цитоплазмы в ядро. Биохимические данные о ядерной оболочке весьма немногочисленны.
Эндоплазматический ретикулум. Это сложная сеть цистернообразных или трубчатых структур, которая занимает значительную часть внутреннего объема обычной животной клетки. Основная роль ЭР состоит в том, что он служит местом биосинтеза белков, которые затем секретируются, включаются в лизосомы или в плазматическую мембрану. Потенциально опасные для клетки гидролитические ферменты, которые должны секретироваться или накапливаться в лизосомах, подвергаются в ЭР процессингу до зрелой формы. С ЭР часто бывают связаны рибосомы, в результате чего на электронных микрофотографиях он выглядит шероховатым. Сложные процессы, в ходе которых осуществляется синтез белков, их превращение в зрелую форму и направленная доставка к месту назначения, описаны в гл.10.
Области ЭР, не содержащие рибосом, называются гладким ЭР. Здесь осуществляется биосинтез стеролов, протекают реакции детоксикации и происходит десатурация жирных кислот. Все эти процессы входят в сложную, согласованную систему транспорта электронов, осуществляемого при участии цитохромов bs и Р450.
Аппарат Гольджи. Эта органелла состоит из сети уплощенных мешков, собранных в стопки. Основная его функция заключается в посттрансляционной модификации гликопротеинов, синтезированных в эндоплазматическом ретикулуме и предназначенных для секреции, включения в плазматическую мембрану или доставки в лизосомы. Эти органеллы содержат гликозидазы и гликозилтрансферазы, которые вступают в действие последовательно, по мере того как белок, подвергаемый процессингу, перемещается от начала аппарата Гольджи до его конца. Фактически аппарат Гольджи состоит из совокупности отдельных мембран, образующих цистерны. Эти мембраны, которые можно выделить, характеризуются определенным набором ферментов. Механизмы транспорта мембран и секретируемых белков через аппарат Гольджи рассмотрены в гл.10.
Лизосомы. Эти органеллы ответственны за деградацию макромолекул и содержат ряд гидролитических ферментов, таких, как протеазы и липазы. Вещества, захваченные клеткой путем эндо- или фагоцитоза, которые необходимо расщепить, доставляются в лизосомы с помощью везикул. В лизосомах происходит также расщепление клеточных компонентов в ходе их обычного круговорота. Как осуществляются синтез лизосомных ферментов, их маркировка для доставки в лизосомы и последующий транспорт - изучено достаточно хорошо. Эти процессы рассматриваются в гл.10.
Пероксисомы. Эти органеллы содержат окислительные ферменты, участвующие в деградации малых молекул, таких, как аминокислоты, ксантин и, в особенности, жирные кислоты. Их название связано с присутствием в них каталазы, которая разлагает перекиси, образующиеся как побочные продукты при реакциях окисления.
Митохондрии. В этих органеллах осуществляется окислительное фосфорилирование, в результате чего в ходе окисления субстратов, таких, как NADH или сукцинат, образуется АТР. Митохондрии образованы двумя мембранами, разделенными некоторым промежутком. Внутренняя область митохондрий называется матриксом. Внутренняя мембрана образует складки в виде перегородок, называемых кристами, и содержит ферменты, участвующие в транспорте электронов и синтезе АТР. В гл.6 обсуждаются роль диффузии в плоскости мембраны компонентов цепи электронного транспорта и ее функциональное значение. Вопросы, связанные с синтезом белков митохондрий, который происходит в цитоплазме, и с их доставкой в один из митохондриальных компартментов или в одну из мембран, рассматриваются в гл.10.
Хлоропласты. Это органеллы, содержащие фотосинтетический аппарат. Они имеют наружную оболочку, образуемую двумя мембранами, и внутреннюю область - строму. В строме находятся тилакоидные мембраны, где локализованы компоненты системы фотосинтеза. На отдельных участках тилакоидные мембраны плотно упакованы в стопки, а на других обращены непосредственно к строме. Состав плотноупакованных и обращенных в строму доменов тилакоидной мембраны различен, что указывает на латеральную гетерогенность этой мембраны. Энзимология фотосинтезирующей цепи электронного транспорта обсуждается в разд.6.6.
Следует подчеркнуть, что при изучении каждой из мембран, упомянутых выше, а также и других специализированных мембран из клеток животных, растений или бактерий возникает целый комплекс важных и интересных вопросов, требующих своего решения, и открываются широкие возможности для биохимических исследований. Другие мембранные системы, представляющие интерес в этом отношении, будут описаны в последующих главах книги.
2. Исторический очерк
Тот факт, что плазматическая мембрана, окружающая клетки, представляет собой вполне определенную структуру, был осознан в середине XIX столетия.
На исходе этого столетия Овертон обратил внимание на корреляцию между скоростью, с которой небольшие молекулы проникают в растительные клетки, и их коэффициентом распределения между маслом и водой; это привело его к мысли о липидной природе мембран. В 1925 г. Гортер и Грендел предположили, что липиды в мембране эритроцитов образуют биомолекулярный слой. Эта идея возникла на основе результатов элегантного и простого эксперимента.
Липиды эритроцитов экстрагировали ацетоном и затем в кювете Лэнгмюра получали из них тонкую пленку на поверхности воды.
С помощью поплавка сжимали слой липидных молекул на границе раздела вода-воздух до тех пор, пока этот слой не начинал оказывать сопротивление дальнейшему сжатию; это явление было объяснено образованием плотноупакованной мономолекулярной липидной пленки. Измерение площади, занимаемой липидами, и сравнение ее с площадью поверхности эритроцитов, из которых эти липиды были экстрагированы, дали соотношение 2:
1. Отсюда был сделан вывод, что мембрана эритроцитов состоит из липидных молекул, расположенных в два слоя.
По-видимому, этот вывод Гортера и Грендела оказался правильным только благодаря взаимной компенсации ошибок, однако в историческом плане эта работа имела большое значение, поскольку с тех пор концепция липидного бислоя как структурной основы биологических мембран стала доминирующей и на самом деле оказалась верной.
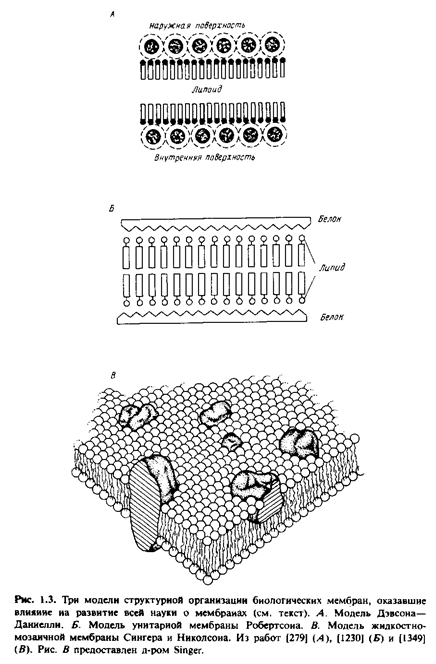
Концепция бимолекулярной липидной мембраны получила дальнейшее развитие в предложенной в 1935 г. модели Дэвсона-Даниелли, или модели "сэндвича", в которой предполагалось, что белки покрывают поверхность липидного бислоя. Это была необыкновенно удачная модель, и в течение последующих 30 лет многочисленные экспериментальные данные, особенно полученные с помощью дифракции рентгеновских лучей и электронной микроскопии, полностью подтвердили ее адекватность. Однако тогда же обнаружилось, что мембраны выполняют огромное множество функций, и чтобы объяснить этот феномен, исходная модель Дэвсона-Даниелли неоднократно подвергалась модификациям.
Быстрый прогресс в мембранологии, в результате которого сформировались современные представления, был достигнут в значительной мере благодаря успехам в изучении свойств мембранных белков. Электронно-микроскопические исследования с применением метода замораживания-скалывания показали, что в мембраны встроены глобулярные частицы. Тем временем биохимикам с помощью детергентов удалось диссоциировать мембраны до состояния функционально активных "частиц". Данные спектральных исследований указывали, что для мембранных белков характерно высокое содержание а-спиралей и что они, вероятно, образуют глобулы, а не распределены в виде монослоя на поверхности липидного бислоя. Неполярные свойства мембранных белков наводили на мысль о наличии гидрофобных контактов между белками и внутренней неполярной областью липидного бислоя. Тогда же были разработаны методы, позволившие выявить текучесть липидного бислоя. Сингер и Николсон свели воедино все эти идеи, создав жидкостно-мозаичную модель. В рамках этой модели мембрана представляется как текучий фосфолипидный бислой, в который погружены свободно диффундирующие белки. Прежняя модель Дэвсона-Даниелли была статичной и успешно объясняла имевшиеся в то время структурные данные, полученные с довольно низким разрешением. В то же время начиная с 1970 г. большое внимание стало уделяться изучению динамических свойств и их взаимосвязи с мембранными функциями. В последние годы жидкостно-мозаичная модель тоже подверглась модификации, и этот процесс будет продолжаться. В частности, теперь стало ясно, что не все мембранные белки свободно диффундируют в жидком липидном бислое. Имеются данные о существовании латеральных до-j менов в самой мембране. Тщательно изучается также роль цитоскелета. Становится все очевиднее, что некоторые участки мембран, по-видимому, отличаются по своей структуре от классического липидного бислоя. Тем не менее в обозримом будущем жидкостно-мозаичная модель в ее разных модификациях будет служить в качестве концептуальной основы для многих мембранных исследований.
3. Морфология мембран
Важную роль в выяснении морфологии мембран сыграли два метода: дифракция рентгеновских лучей и электронная микроскопия. Именно с их помощью была подтверждена правильность бислойной модели. Однако следует иметь в виду, что при выяснении детальной картины молекулярной организации мембран оба этих метода сталкиваются с рядом ограничений.
3.1 Дифракция рентгеновских лучей
При исследовании высокоупорядоченных кристаллических образцов с помощью метода дифракции рентгеновских лучей удается получить информацию о структуре с высоким разрешением. В случае же малоупорядоченных препаратов возможности этого метода ограничены. Некоторые специализированные мембранные системы уже имеют регулярную структуру, и потому их можно изучать рентгено-структурными методами. Примером такого рода служит миелиновая оболочка периферических нервных волокон; она представляет собой мембрану, которая, многократно оборачиваясь вокруг аксона, формирует регулярную систему из концентрических мембранных структур. Исследования дифракции рентгеновских лучей на миелине, проведенные еще в 30-х гг., подтверждают адекватность бислойной модели мембран. К такому же выводу приводит и изучение наружного сегмента палочек сетчатки позвоночных, которые представляют собой природные упорядоченные мембранные системы, а также искусственно упорядоченных систем, которые образуются при коллапсировании в условиях центрифугирования мембранных везикул, полученных из митохондрий и эритроцитов. Во всех этих случаях наблюдалось сходное распределение электронной плотности в мембране, показанное на рис.1.4
Для интерпретации рентгеноструктурных данных необходимо определить не только интенсивности рефлексов, но и их фазы. В случае регулярно упакованных мембранных систем задача значительно упрощается, поскольку эти системы состоят из повторяющихся элементов с центральной симметрией.
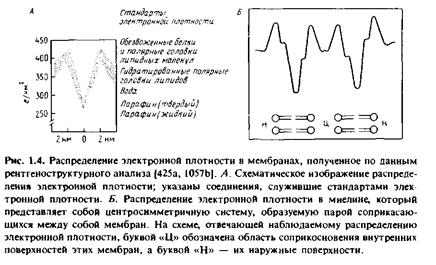
Полученные данные показывают, что структура всех мембран сходна: они имеют гидрофобную внутреннюю область с низкой электронной плотностью и два слоя полярных группировок с высокой электронной плотностью. Рентгеноструктурные данные, полученные для разных мембран, различаются лишь незначительно, несмотря на большие различия в содержании в них белка. Хотя рентгеноструктурные данные позволяют получить некоторую информацию о том, как расположена в мембране основная масса мембранных белков, в целом метод рентгеноструктурного анализа не дает детальной молекулярной картины.
Уилкинс и др. отметили в 1971 г., что метод дифракции рентгеновских лучей можно использовать и для изучения водных дисперсий мембран и фосфолипидов. При этом рефлексы, порождаемые полярными областями на обеих сторонах бислоя, позволяют найти его толщину, равную расстоянию между полярными головками, а по рефлексам, порождаемым упорядоченными углеводородными цепями, можно определить расстояние между этими цепями. И в этом случае мембранные препараты, полученные из разных источников, дали сходную дифракционную картину, что подтверждает универсальность бислойной модели.
Невозможность получения с помощью метода дифракции детальной молекулярной картины ограничивает применение этого метода для изучения биологических мембран. Однако он может быть весьма полезен при исследовании упорядоченных липидно-водных систем.
3.2 Электронная микроскопия
Просвечивающая электронная микроскопия тонких срезов миелина, а фактически и всех остальных мембран, выявляет характерную трехслойную структуру, состоящую из двух электроноплотных полос, разделенных промежутком около 80 А. Такая картина получается в значительной мере в результате обработки препаратов четырехокисью осмия, обычно применяемой в этом методе. Робертсон назвал наблюдаемую структуру "унитарной", чтобы подчеркнуть ее универсальность, и хотя молекулярные механизмы прокрашивания мембран осмием неизвестны, эта структура рассматривалась как подтверждение справедливости бислойной модели мембраны. Ясно, однако, что при подготовке препаратов для просвечивающей электронной микроскопии мембраны могут подвергаться неблагоприятным воздействиям. В частности, известно, что обработка четырехокисью осмия приводит к значительной потере белка из эритроцитарной мембраны. И хотя наблюдаемая при этом трехслойная структура в некоторой степени отражает организацию бислойных мембран, более детальные сведения относительно локализации белков этим методом получить не удается.
Некоторую информацию о расположении мембранных белков дали новые методы, ставшие теперь уже "классическими", - методы замораживания-скалывания и замораживания-травления. В этих случаях препараты быстро замораживают, не подвергая их при этом каким-либо повреждающим воздействиям, как при получении тонких срезов. Процесс подготовки препарата включает следующие операции.
После замораживания образец, представляющий собой суспензию клеток или мембран, скалывают с помощью ножа при низкой температуре в глубоком вакууме. Возникающие при скалывании усилия приводят к образованию среза, проходящего через образец. Оказалось, что, когда плоскость среза проходит через мембрану, последняя раскалывается преимущественно по своей срединной области и расщепляется на две половинки. В результате на образовавшихся плоскостях скола обнажается внутренняя область мембраны.
При необходимости образец подвергают травлению - проводят обычную возгонку льда в вакууме. Это позволяет лучше визуализировать поверхностные структуры клеточных мембран.
После этого получают так называемую реплику с обнаженной поверхности. Именно эту реплику и изучают под электронным микроскопом. Для получения реплики сначала напыляют на образец платину под углом около 45°, чтобы выявить топологические характеристики препарата. Затем платиновой реплике придают механическую прочность, нанеся на нее слой углерода. После этого препарат оттаивают, реплика всплывает, и ее вылавливают с помощью специальной сеточки.
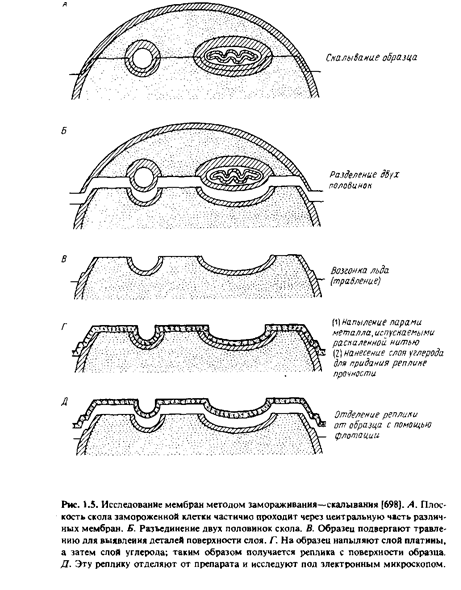
Наиболее характерные структуры, наблюдаемые при изучении мембран методом замораживания-скалывания, - это многочисленные внутримембранные частицы диаметром от 80 до 100 А, лежащие в плоскости мембранных сколов. Обычно они расположены хаотично, но иногда образуют группы. Многочисленные исследования показали, что эти частицы, возможно, являются мембранными белками. Любопытно, что при электронной микроскопии тонких срезов подобные структуры не обнаруживаются. Реплики, полученные от двух половинок расщепленной мембраны, не всегда бывают топологически комплементарными. Это означает, что некоторые частицы связаны только с одной из половин мембраны. Данные, полученные методом замораживания-скалывания, широко использовались Сингером и Николсоном при создании жидкостно-мозаичной модели мембран, поскольку они убедительно показывали, что глобулярные белки находятся не только на поверхности мембраны, но и внутри бислоя.
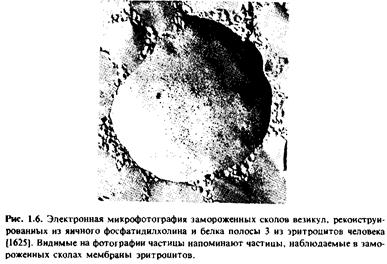
На рис.1.6 приведена электронная микрофотография препарата протеолипосом, реконструированных из яичного фосфатидилхолина и нефракционированного препарата белка полосы 3 из мембраны эритроцитов человека; препарат получен методом замораживания - скалывания.
Белок полосы 3 является основным белковым компонентом мембраны эритроцитов и, как известно, осуществляет перенос анионов. Если фосфолипидные везикулы не содержат этого белка, то полученные препараты замороженных сколов имеют гладкую поверхность.
При встраивании белка полосы 3 в фосфолипидные везикулы на сколах появляются внутримембранные частицы, практически неотличимые от частиц, наблюдаемых в мембранах эритроцитов. Более того, при рН 5,5 частицы, наблюдаемые в мембране эритроцитов, агрегируют, причем эта агрегация осуществляется в результате взаимодействия белка полосы 3 с двумя другими белками, спектрином и актином.
Последние являются компонентами цитоскелета, находящимися на внутренней поверхности эритроцитарной мембраны. Аналогичным образом ведет себя и реконструированная система, состоящая из белка полосы 3 и фосфатидилхолина, при этом агрегация частиц наблюдается в присутствии спектрина и актина при рН 5,5, но не при рН 7,6.
Эти данные еще более упрочили представление о мембранных белках как о глобулярных частицах, свободно перемещающихся в плоскости мембраны. Интересно, что статичные микрофотографии препаратов, полученных методом замораживания-скалывания, помогли исследователям в изучении динамических свойств мембран. Как мы увидим, в мембранах есть много белков, которые не могут свободно плавать в "липидном море".
4. Выделение мембран
В течение последних трех десятилетий становилось все более очевидно, что огромное большинство клеточных функций осуществляется при непосредственном участии мембран.
И растительные, и животные клетки разделены на отсеки, причем многие цитоплазматические органеллы, как было показано в разд.1.1, имеют мембранную природу.
Кроме органелл, характерных для большинства клеток, имеются и специализированные мембранные системы, такие, как саркоплазматический ретикулум мышечных клеток, миелиновая оболочка периферических нервных волокон, тилакоидные мембраны хлоропластов и мембраны дисков в палочках сетчатки. У прокариотических организмов также имеются мембраны, хотя и не настолько развитые, как у эукариотических.
Грамположительные бактерии, например Bacillus subtilis, имеют лишь цитоплазматическую мембрану, а грамотрицательные, такие, как Escherichia coli, - еще и наружную, расположенную поверх тонкой пептидогликановой клеточной стенки.
В клетках прокариот обнаружены также некоторые специализированные органеллы. Некоторые вирусы, патогенные для животных, например вирусы с оболочкой, имеют самую настоящую мембрану, причем такие мембраны оказались чрезвычайно интересными для изучения.
Исследование мембран, как правило, сопряжено с их очисткой, при этом для каждого типа мембран характерны свои условия препаративного выделения.
Так, если предстоит исследовать плазматическую мембрану каких-либо клеток, то сначала необходимо выделить эти клетки из ткани. Затем нужно подобрать оптимальные условия разрушения клеток и отделения мембран, представляющих интерес, от других клеточных компонентов. Особого внимания заслуживают критерии чистоты выделенных мембран.
4.1 Разрушение клеток
Желательно выбирать такую методику, которая позволяет эффективно разрушить сами клетки при сохранении структуры мембран, подлежащих выделению. Для многих животных клеток можно использовать такую относительно мягкую процедуру, как гомогенизация в гомогенизаторах Даунса или Поттера-Элвехейма со стеклянными стенками и тефлоновым пестиком. При этом клетки разрушаются за счет сдвиговых усилий, возникающих при продавливании суспензии через узкий зазор между тефлоновым пестиком и стеклянной стенкой гомогенизатора. При такой обработке "срывается" плазматическая мембрана и разрушаются связи между различными органеллами при сохранении целостности самих органелл. С помощью такой процедуры можно также отделить друг от друга специализированные участки плазматической мембраны, например ба-золатеральную или апикальную области мембраны эпителиальных клеток. Желательно работать в условиях, когда целостность органелл сохраняется, чтобы свести к минимуму возможность высвобождения гидролитических ферментов и облегчить последующие операции по разделению мембран.
Для разрушения клеток, имеющих стенку, требуются более жесткие методы. Иногда перед разрушением клеток их сначала обрабатывают ферментами, расщепляющими компоненты клеточной стенки, чтобы облегчить ее последующее разрушение. Так, например, для разрушения клеток Е. coli используют обработку буфером трис-ЭДТА и лизоцимом. Более жесткие приемы предусматривают растирание клеток, обработку их ультразвуком и экструзию. Растирание обычно проводят в присутствии различных абразивных материалов - песка, окиси алюминия или стеклянных шариков. Малые объемы материала можно растирать в ступке с помощью пестика, но для больших объемов следует использовать специальные механические приспособления. Бактериальные клетки часто разрушают с помощью ультразвука. Полагают, что в этом случае разрушение происходит под действием сдвиговых усилий, возникающих в результате кавитации. Такие же усилия возникают при продавливании суспензии клеток через небольшое отверстие, например при разрушении клеток с помощью пресса Френча. Существует много разновидностей перечисленных методов, и их выбор зависит от особенностей той мембранной системы, которая подлежит изучению.
Следует отметить, что получаемые при разрушении клеток мембранные фрагменты обычно спонтанно образуют везикулы. В качестве примера можно привести:
1) микросомы, получаемые из плазматической мембраны, эндоплазматического ретикулума или специализированных систем, таких, как саркоплазматическая мембрана;
2) субмитохондриальные частицы из внутренней митохондриальной мембраны;
3) синаптосомы, образующиеся при отрыве нервных окончаний в области синаптических контактов;
4) бактериальные мембранные везикулы, образующиеся из плазматической мембраны Е. coli. Везикулы образуются и из других мембранных систем, например из мембран аппарата Гольджи. Их размер в большинстве случаев сильно зависит от метода разрушения клеток. Это особенно важно, поскольку размеры везикул в значительной степени определяют скорость их седиментации при центрифугировании и их поведение на следующих стадиях очистки мембран. Некоторые мембраны не образуют везикул, в частности мембраны боковых поверхностей соприкасающихся друг с другом животных клеток. При разрушении таких клеток происходит отрыв пары смежных мембранных фрагментов, удерживаемых вместе областью контакта. Наличие таких контактов предотвращает замыкание фрагментов в везикулы, поэтому мембраны выделяются в виде пластин или лентообразных структур.
Большое значение при разрушении клеток имеет также правильный выбор среды. Например, чтобы сохранить замкнутость мембранных органелл, следует использовать такую среду, которая изоосмотична их внутреннему содержимому. Чаще всего для этого используют раствор сахарозы в концентрации 0,25-0,30 М. В ряде случаев лучше использовать сорбитол и маннитол. Следует отметить, что сохранение изотоничности играет важную роль и на последующих стадиях препаративного выделения интактных органелл.
4.2 Разделение мембран
В настоящее время для разделения мембран чаще всего применяют центрифугирование. Мембранные частицы можно разделить по скорости их седиментации или по плавучей плотности. Первый метод называется зональным центрифугированием, и разделение происходит в соответствии со значениями S, а второй - изопикническим центрифугированием, и разделение происходит в условиях равновесной плотности. На практике обычно применяют некий гибрид этих двух методов. На рис.1.7 показано положение некоторых субклеточных единиц на координантной плоскости "S-g".
По оси абсцисс отложены коэффициенты седиментации частиц, а по оси ординат - плотность.
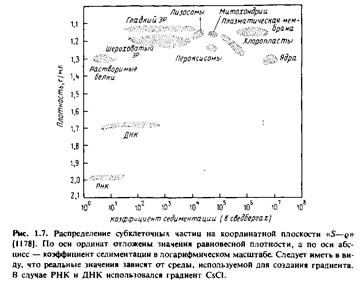
Принцип разделения по скорости седиментации можно легко уяснить, сравнив значения S для разных фракций. Например, ядра имеют относительно высокие значения S, т.е. скорость их седиментации значительно выше, чем у большинства других субклеточных органелл. Ядра можно избирательно осадить центрифугированием клеточного гомогената, при этом все другие органеллы останутся в надосадочной жидкости. В то же время гладкий и шероховатый эндоплазматический ретикулум не удается разделить с помощью зонального центрифугирования.
Для выделения различных мембранных фракций из клеточного гомогената часто используют различия в их плотности. С этой целью проводят центрифугирование в градиенте плотности. Чаще всего для создания градиента плотности используют сахарозу, однако этот метод имеет серьезные недостатки. Чтобы получить плотность, требуемую для разделения различных мембранных фракций, необходимо готовить растворы с высокой концентрацией сахарозы, которые обладают высокой вязкостью и к тому же являются гипертоничными. Внесение субклеточных органелл в гипертоничный раствор сахарозы приводит к их дегидратации, а последующее доведение раствора до изотонических условий часто сопровождается лизисом и повреждением органелл. Другая проблема состоит в том, что многие мембранные органеллы проницаемы для сахарозы. Это также может привести к осмотическому разрушению органелл. Проникновение сахарозы в разделяемые мембранные органеллы может изменить их эффективную плотность.
Таблица 1.1. Физические время все чаще используют другие среды для создания градиента плотности. Некоторые из этих сред перечислены в табл.1.1
| Концентрация, | Плотность, | Вязкость, | Осмоляльность, | |
| % (в/о) | г/мл | сП | мОсм/кг НгО | |
| Сахароза | 20 | 1,06 | 30 | 700 |
| Метризамид | 30 | 1,16 | 2 | 260 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Структура и строение нейрона
ПланОсновные черты нейронаСтруктура нейронаНейрофибрилыСекторные нейроны Значения нервной тканиНейролгияНервные волокнаРегенираци
- Структурно-функциональная организация генетического материала
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛАСодержание1. Наследственность и изменчивость - фундаментальные свойст
- Сущность биосферы
Сущность биосферыПланВведение. Понятие биосферы1. Характеристика и структура биосферы2. Основные биохимические циклы круговороты био
- Теоретические основы и технологии начального образования по естествознанию
ГОУ ВПО "Красноярский государственныйпедагогический университет им. В.П. Астафьева"Институт дистанционного образования(ИДисО)Контро
- Теории происхождения человека на Земле
Государственное образовательное учреждениесреднего профессионального образованияНовокуйбышевский государственный гуманитарно-те
- Теории эволюции
ЕстествознаниеТеории эволюцииСОДЕРЖАНИЕВведение. 31. Проблема происхождения жизни. 5 2. Процесс развития живого. Общие тенденции эволюц
- Теория относительности. Эволюция и структурная организация Вселенной
Вопрос №1 Теория относительностиПредпосылкой к созданию теории относительности явилось развитие в XIX веке электродинамики. Результат
Copyright © https://referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

