Разделение смеси бензол – циклогексан – этилбензол – н-пропилбензол экстрактивной ректификацией
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ ИМЕНИ М.В. ЛОМОНОСОВА
Кафедра Химии и Технологии
Основного Органического Синтеза
Аттестационная работа по теме:
«Разделение смеси бензол – циклогексан – этилбензол – н-пропилбензол экстрактивной ректификацией»
на соискание степени бакалавра по направлению 550800
«Химическая Технология и Биотехнология»
Зам. заведующего кафедройА.В. Тимошенко
д.т.н., проф.
Руководители:
д.т.н., проф.А.В. Тимошенко
асп. Л.В. Иванова
СоискательА.В. Макашова
Москва 2004
МБ – материальный баланс
ТБ – тепловой баланс
Т – температура, оС
ЭА – экстрактивный агент
РА – разделяющий агент
ЭР – экстрактивная ректификация
Б – бензол
ЦГ – циклогексан
ЭБ – этилбензол
ПБ – н-пропилбензол
NЭА –уровень подачи экстрактивного агента
NF – уровень подачи питания
ПЖР – парожидкостное равновесие
Введение
Процесс ректификации играет ведущую роль среди процессов разделения промышленных смесей. Большая энергоемкость процесса делает поиск оптимальных схем разделения актуальной задачей химической технологии. В промышленности разделению подвергаются многокомпонентные смеси как простых зеотропных, так и сложных азеотропных смесей. В последнем случае в связи с термодинамико-топологическими ограничениями получение чистых продуктов обычной ректификацией невозможно. Для решения этой проблемы предложен ряд методов, одним из которых является экстрактивная ректификация с использованием разделяющего агента. Данный метод достаточно прост в аппаратурном оформлении и не требует значительных энергозатрат по сравнению с другими методами разделения азеотропных смесей.
На сегодняшний день сложилась классификация схем экстрактивной ректификации, согласно которой разделяющий агент применяется на разных этапах разделения. Таким образом, возникает поливариантность организации процесса и необходимость исследования каждого варианта с целью выявить наименее энергоемкий.
В данной работе рассматриваются традиционные схемы разделения азеотропных смесей, состоящих из простых двухсекционных колонн. Цель работы заключается в разработке энергосберегающего процесса экстрактивной ректификации азеотропной смеси.
Литературный обзор
Методы разделения азеотропных смесей
В различных отраслях промышленности используют разнообразные жидкие и газовые смеси, подлежащие разделению на чистые компоненты или фракции различного состава. Разделение таких смесей проводят в комплексах, основанных на процессе ректификации.
Если смесь образует азеотроп, то ее разделение на практически чистые компоненты методом обычной ректификации становится очень трудно. В данном случае необходимо использовать специальные методы ректификации:
1) разделение в комплексе колонн, работающих под разными давлениями;
2) экстрактивную ректификацию;
3)азеотропную и гетероазеотропную ректификацию.
Азеотропным смесям присущи термодинамико-топологические ограничения на выделение конечных фракций заданного состава. Основой для преодоления ограничений служит принцип перераспределения полей концентраций между областями разделения (1–3). Этот принцип может быть реализован с использованием однородных и неоднородных (с включением экстракции, адсорбции, абсорбции, химических и др. методов разделения) разделительных комплексов. В первом случае процесс ректификации может быть организован так, что на одном из этапов осуществляется выделение азеотропной фракции, которая затем подвергается разделению с использованием специальных методов. Если это фракция двух и более компонентов, то можно использовать экстрактивную ректификацию или разделение азеотропного состава под разными давлениями. Если фракция содержит более двух компонентов, появляется возможность применить для разделения методы, использующие кривизну разделяющего многообразия (3, 4). В работах (2, 5) предложен общий подход к синтезу схем ректификации многокомпонентных неидеальных (включая азеотропные) смесей, основанный на понятии области ректификации. Авторами (6–8) предложены некоторые подходы к синтезу технологических схем ректификации многокомпонентных смесей, содержащих один бинарный азеотроп. При этом используется метод разделения азеотропной смеси под разными давлениями.
Разделение азеотропных смесей в комплексах, работающих под разным давлением
Применение данного метода рассматриваются авторами (6-9). Для разделения азеотропных смесей используются комплексы (рис.1), работающие под разным давлением, которые позволяют преодолеть ограничения физико-химического характера и получать продукты требуемой чистоты.
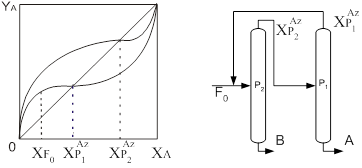
Рис.1. Разделение азеотропных смесей в комплексах, работающих под разным давлением
В таких случаях используется изменение состава азеотропной смеси с изменением температуры (при изменении давления) (11). Изменение состава азеотропа, приходящееся на один градус температуры, согласно правилу Вревского, зависит от разности молярных теплот испарения компонентов. Следовательно, рассматриваемый метод разделения тем эффективнее, чем больше отличаются теплоты испарения компонентов разделяемой смеси. Обычно теплоты испарения значительно различаются у веществ различной химической природы. Но практическое применение метода ограничено, т.к. интервал изменения давления, в свою очередь, ограничен температурами хладагентов, используемых для конденсации паров в дефлегматорах, и теплоносителей, применяемых в кубах ректификационных установок.
Азеотропная ректификация
Метод азеотропной ректификации применим как для смесей с малым коэффициентом относительной летучести, так и для азеотропообразующих смесей (в том числе при составах, близких к азеотропу). При азеотропной ректификации разделяющий агент образует с каким-либо компонентом разделяемой смеси азеотроп с иным соотношением компонентов, нежели в исходной смеси, если последняя является азеотропообразующей. В качестве разделяющих агентов могут применяться вещества, образующие гомоазеотропы с компонентами исходной смеси (это могут быть азеотропы с максимумом или минимумом температур кипения), либо гетероазеотропы, представляющие собой тройные смеси разделяемых компонентов А и В с разделяющим агентом РА. Во всех случаях один из компонентов разделяемой смеси в колонне азеотропной ректификации может быть получен в практически чистом виде (10).
Наиболее сложным и энергоемким в схемах азеотропной ректификации является узел разделения азеотропной смеси.
Несколько проще разделение смеси с помощью разделяющего агента, образующего гетероазеотроп (рис.2). Последний после конденсации образует два жидких слоя с разными соотношениями разделяемых компонентов в них. Это различие в составах двух слоев позволяет использовать колонну меньшей эффективности (высоты) по сравнению с образованием гомоазеотропа. Температура кипения гетероазеотропа всегда ниже, чем у компонентов разделяемой смеси.Расслаивание и декантацию гетероазеотропной смеси осуществляют во флорентийском сосуде, позволяющем раздельно выводить слои легкой и тяжелой жидкости.
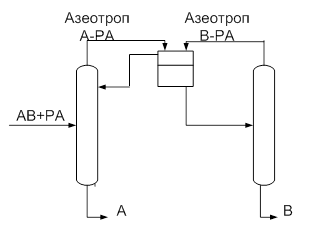
Рис.2. Принципиальная схема разделения гетероазеотропной смеси
Разделение азеотропных смесей методом экстрактивной ректификации
Наиболее часто на практике для преодоления теродинамико-топологических ограничений на выделение конечных фракций заданного состава используют метод экстрактивной ректификации.
Этот метод основан на увеличении движущей силы процесса разделения за счет изменения условий равновесия между жидкостью и паром, достигаемого путем добавления к заданной смеси специально подобранных веществ – разделяющих агентов. Если необходимо разделить на достаточно чистые компоненты трудноразделимую бинарную смесь, к такой смеси добавляют специально подобранный компонент (обычно труднолетучий), избирательно растворяющий один из компонентов исходной смеси и мало растворяющий другой. Иными словами, введение в систему третьего компонента заметно снижает упругость паров растворяемого компонента бинарной смеси, увеличивая тем самым коэффициент относительной летучести разделяемой смеси.
Выбор разделяющего агента
При выборе разделяющих агентов для процессов азеотропной и экстрактивной ректификации должны учитываться свойства системы, подлежащей разделению. Прежде всего, в исходной системе должны быть определены требования, предъявляемые к разделяющему агенту. В основном, разделяющие агенты, используемые в процессах азеотропной и экстрактивной ректификации должны удовлетворять следующим требованиям:
1) избирательность, т.е. изменение относительной летучести компонентов заданной смеси в желательном направлении;
2) легкость регенерации из смесей с компонентами системы, подвергаемой разделению;
3) легкое отделение от продукта;
4) безопасность в обращении, доступность и дешевизна;
5) инертность по отношению к компонентам заданной смеси, термостабильность, неспособность вызывать коррозию аппаратуры.
Наиболее сложной задачей является выбор разделяющих агентов, удовлетворяющих первому требованию, тогда как последующие требования относятся к числу обычных технологических вопросов.(11,12)
Количественный эффект от использования разделяющего агента, при прочих равных условиях, определяется его концентрацией в колонне. Поэтому в случае непрерывной ректификации на линии равновесия наблюдается скачок концентраций в паровой фазе, обусловленный изменением концентрации экстрактивного агента в жидкости при подаче в колонну исходной смеси.
Помимо избирательного растворения одного из компонентов разделяемой смеси, экстрактивный агент должен удовлетворять ряду требований; основные из этих требований следующие (11,12):
— он не должен образовывать азеотропов с компонентами исходной смеси (чтобы его можно было без затруднений в последствии отделить от них с целью его регенерации и получения чистых компонентов);
— он должен существенно отличаться от компонентов исходной смеси по температуре кипения, т.е. быть значительно более труднолетучим, чем ВКК исходной смеси, или (это бывает реже) значительно более легколетучим, чем низкокипящий компонент исходной смеси (что позволяет его выделить без больших энергетических и капитальных затрат).
Метод экстрактивной ректификации заключается в проведении процесса ректификации с практически нелетучими разделяющими агентами, или имеющими значительно меньшую относительную летучесть, чем компоненты заданной смеси. В процессах экстрактивной ректификации практически весь разделяющий агент отводится с кубовой жидкостью, а в дистиллат обычно попадает в очень небольших количествах. Разделяющий агент подается в ректификационную колонну на некотором расстоянии от ее верха и стекает вместе с флегмой. Образование азеотропных смесей разделяющим агентом с компонентами исходной смеси нежелательно во избежание загрязнения дистиллата разделяющим агентом.
Однако в некоторых случаях для экстрактивной ректификации применяются разделяющие агенты, образующие азеотропную смесь с компонентом, отбираемым в виде дистиллата. Такой процесс называется азеотропно-экстрактивной ректификацией.
Классификация схем экстрактивной ректификации
К настоящему времени сложилась классификация схем экстрактивной ректификации. Условно все технологические схемы можно разделить на две основные группы (13). К первой группе схем относятся схемы с применением ЭА в первой колонне и выделением азеотропобразующего компонента на первом этапе (рис.3а, в).
Ко второй группе схем относятся структуры, в которых первоначально происходит фракционирование исходной смеси и отделение зеотропной и азеотропной составляющих друг от друга (рис. 3б). Далее каждая из них разделяется в последовательности простых двухсекционных колонн и в комплексе экстрактивной ректификации соответственно. В этом случае ЭА может применяться на любой стадии разделения, кроме первой.
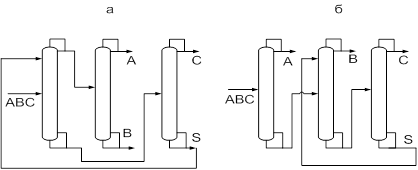
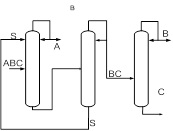
Рис.3. Разделение смеси АВС методом экстрактивной ректификации (а),(в) – с применением ЭА в первой колонне, (б) – с фракционированием исходной смеси
В целом, эти два класса схем охватывают все возможные варианты разделения. Схемы из первого класса для ректификации смесей с низкой размерностью концентрационного пространства можно использовать как элементы разделения смесей во второй группе схем для смесей более высокой размерности.
Экстрактивный агент должен направляться только в ту колонну (колонны), где его применение необходимо для разделения смеси. Поэтому иногда целесообразно применение последовательно соединенных комплексов экстрактивной ректификации (рис.4 а).
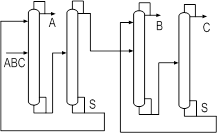
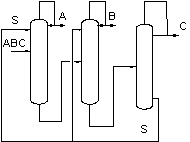
А б
Рис. 4. Схемы экстрактивной ректификации трехкомпонентной смеси при выделении в первой колонне индивидуального азеотропообразующего компонента
В случае сложного портрета ПЖР с несколькими азеотропами появляется необходимость подачи ЭА одновременно в две колонны комплекса (рис. 4 б). Такую организацию процесса следует всегда сопоставлять с двумя последовательно связанными комплексами ЭР для выявления наиболее эффективного решения.
Применение экстрактивной ректификации для разделения промышленных смесей
Методы экстрактивной ректификации в настоящее время применяются для решения разнообразных задач по разделению жидких смесей, а также для интенсификации процессов разделения. Нефть и природный газ широко применяются в химической промышленности и этим вызвана необходимость разделения смесей близкокипящих углеводородов. Последнее время находят все большее применение комбинированные РА, что позволяет понизить температуру кипения кубовой жидкости (это имеет существенное значение, если температуры кипения компонентов заданной смеси и РА сильно различаются).
Процесс экстрактивной ректификации почти никогда не используются самостоятельно, а являются стадиями технологических процессов разделения смесей. Широко применяется для выделения ароматических углеводородов из природных смесей и смесей с неорганическими компонентами, выделения и очистки 1.3-диоксолана, разделения углеводородов С4-С5 и т.д.
Выделение бутадиена из смесей углеводородов С4 (12)
Методом ЭР решается одна из крупных промышленных проблем – выделение бутадиена из смесей углеводородов С4. Процессы экстрактивной ректификации играют важнейшую роль в общем комплексе производства бутадиена. Существует два пути получения бутадиена на основе метода ЭР. Первый путь – непосредственное выделение бутадиена из газов крекинга; второй – выделение бутадиена из смесей, получающихся при последовательном каталитическом дегидрировании бутана и бутиленов.
По условиям разделения оба эти способа в принципе равноценны. Различаются эти методы лишь относительным содержанием компонентов в исходных смесях.
Рассмотрим метод выделения бутадиена из смесей, получающихся при двухстадийном каталитическом дегидрировании бутана.
Смеси, из которых выделяется бутадиен, содержат (после отделения низкокипящих компонентов — например, водорода, метана, этана) вещества, приведенные в табл.1 в порядке возрастания температуры кипения.
Бутадиен с бутаном образует азеотроп, который при давлении 8 ат содержит 21 мол.% бутана. Это обстоятельство заставило обратиться к методу экстрактивной ректификации. Наилучшими разделяющими агентами были признаны фурфурол, ацетон и фенол в смеси с водой. Бутилены получаются со степенью чистоты 95—98%.
Принципиальная схема установки разделения бутан-бутиленовых смесей представлена на рис.5.
Таблица 1. Температуры кипения разделяемых веществ
| Углеводороды | Температура кипения, С | Углеводороды | Температура кипения, С |
| Пропилен | -47,70 | Бутан | -0,50 |
| Пропан | -42,07 | Транс-бутилен 2 | 0,88 |
| Метилацетилен | -23,20 | Цис-бутилен-2 | 3,72 |
| Изобутан | -11,73 | Винилацетилен | 5,1 |
| Изобутилен | -6,9 | Этилацетилен | 8,7 |
| Бутилен – 1 | -6,26 | Диацетилен | 9,8 |
| Бутадиен-1,3 | -4,41 | Диметилацетилен | 26,99 |
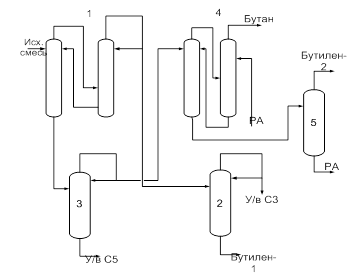
Рис.5. Схема процесса разделения бутан-бутиленовых смесей:
1-ректификационная система; 2, 3, 5- колонны; 4-система экстрактивной ректификации
Первая стадия процесса — выделение и очистка бутиленов, а также получение практически чистого бутана. В смеси присутствуют небольшие количества соединений с температурами кипения ниже и выше, чем температуры кипения углеводородов С4. Эту смесь подают в ректификационную систему 1, состоящую из двух последовательных колонн. В этой системе производится выделение бутилена-1 путем четкой ректификации. Вместе с бутиленом-1 в виде азеотропа с бутаном отгоняется бутадиен. В дистиллате содержатся также в небольших количествах углеводороды Сз и наиболее легкие углеводороды С4 изобутан и изобутилен. Этот дистиллат подается в колонну 2 для отгонки углеводородов С3. Полученная в этой колонне в виде кубовой жидкости смесь направляется в систему выделения бутадиена, в которой бутилен-1 отгоняется в смеси бутиленов, направляемой на вторую стадию дегидрирования.
Кубовая жидкость ректификационной системы 1 поступает в колонну 3, для выделения пентана и других высококипящих примесей, которые в процессе ректификации концентрируются в кубовой жидкости. Полученную в качестве дистиллата смесь бутиленов и бутана подают в систему экстрактивной ректификации 4, состоящую из двух последовательных колонн. В качестве разделяющего агента применяют фурфурол, содержащий ~6 вес. % воды. В виде дистиллата в процессе экстрактивной ректификации получается бутан, возвращаемый на дегидрирование. Бутилены отводятся в смеси с разделяющим агентом из куба. Эту смесь подают в отгонную колонну 5, в которой отгоняются бутилены, а разделяющий агент отбирают из куба в промежуточную емкость, из которой он возвращается в систему экстрактивной ректификации.
При использовании в качестве исходного сырья для выделения бутадиена газов крекинга бутилен-сырец содержит значительные количества изобутана и изобутилена, которые отгоняются вместе с бутиленом-1. Из этой смеси изобутилен удаляется путем поглощения 65% серной кислоты на холоду с последующей полимеризацией при нагревании. Оставшиеся же изобутан и бутилен-1 разделяются путем экстрактивной ректификации.
Вторая стадия процесса заключается в выделении и очистке бутадиена, а также регенерации непревращенных бутиленов для возвращения их в стадию дегидрирования.
Регулирование процесса осуществляется за счет того, что устанавливаются постоянные расходы исходной смеси, флегмы и разделяющего агента и температура последнего, а регулируемым параметром является нагрев куба. Соотношение расходов разделяющего агента и подаваемой смеси углеводородов составляет около 12 : 1 по объему.
Следует остановиться на вопросах, связанных с длительным использованием разделяющего агента. Хотя фурфурол является термостойким веществом, но в присутствии воды, бутадиена и других углеводородов при повышенных температуре и давлении может происходить его полимеризация и взаимодействие с непредельными углеводородами, в частности с бутадиеном. Это вызывает потери фурфурола и необходимость удаления образующихся продуктов реакции.
Другими источниками потерь являются утечки через неплотности в вентилях и насосах, а также попадание фурфурола в продукты разделения. Общие потери, зависящие от температуры, объема системы и концентрации углеводородов, весьма невелики и составляют 0,01—0,02% от расхода циркулирующего фурфурола. По данным заводских балансов, из этого количества ~60% приходится на полимеризацию, а 40% —на механические потери. (12)
Процесс удаления примесей из олефинов (14)
В данной работе предлагается способ очистки олефинов от примесей, особенно таких как этилен и пропилен, которые традиционно получаются в процессах нефтепереработки. Для удаления примесей предлагается использовать экстрактивную ректификацию. Предпочтительно экстрактивный агент – это полярная жидкость, при 1 атм. имеющая температуру кипения около 38оС, содержащая 75 %вес. воды, спирта или нечто подобное. Авторы предлагают использование данного метода в широком интервале давлений (6,8-340,2атм.).
Рассмотрим применение данного метода более подробно.
Газовый поток после реактора, в котором происходит каталитическое получение олефинов, частично конденсируется в емкости при температуре 38оС и давлении 2,7 атм. Это паровой поток, содержащий различные углеводородные продукты содержит эитлен и пропилен, а также различные примеси (1,28% воды, 1,85% окисленных углеводородов, 0,995% из которых – диметиловый эфир, 0,32% – ацетальдегид). Паровой поток из емкости при давлении 2,7 атм. и 38оС поступает в нижнюю часть отпарной колонны, состоящей из 10 тарелок. На верх колонны подают жидкий поток воды при 4оС и 2,7 атм. Верхний продукт колонны содержит 0,95% воды и 0,81% окисленных углеводородов. Диметиловый эфир присутствует в паровом потоке в количестве 0,71%, ацетальдегид – 0,1%. Далее паровой продукт колонны сжимается до давления 20,4 атм. и с температурой 135,33оС направляется в колонну экстрактивной ректификации, состоящую из 39 тарелок и кипятильника. В качестве экстрактивного агента используется вода, которая поступает на первую тарелку колонны с температурой 32оС. Верхний паровой продукт колонны содержит углеводороды и удаляется с температурой 32,5оС и давлением 20,4 атм. Этот поток содержит 0,14% воды и менее 1 ppm окисленных углеводородов, включая диметиловый эфир и ацетальдегид.
О критериях оптимизации технологических схем
Под оптимизацией понимают деятельность научных, проектных и производственных коллективов, направленную на создание производства, дающего наилучшие результаты в принятых условиях.
При выборе метода оптимизации необходимо учитывать критерий оптимизации, который является количественной мерой, позволяющей сравнивать все технологически осуществимые процессы и определять оптимальный вариант работы объекта.
Критерии оптимизации выбираются для всего производства, т.е. для всей системы. Однако чаще всего приходится сталкиваться с оптимизацией части технологического процесса (аппарат, комплекс аппаратов, цех или завод, входящий в комбинат). Следовательно, решаются частные задачи оптимизации.
В частных задачах оптимизации, когда требуется получить экстремальное значение какого-либо параметра работы отдельного аппарата, речь идет о некоторых экстремальных свойствах самого объекта оптимизации, которые обусловлены химическими или физико-химическими свойствами проходящего в данном объекте процесса.
Следовательно, в таких случаях критерием оптимальности служат технологические характеристики, которые косвенно оценивают экономичность работы агрегата (время пребывания реакционной смеси, выход продукта, конечная концентрация, температура и т.д.). В качестве критериев оптимизации могут быть использованы различные экономические (себестоимость продукции, приведенные затраты, средняя прибыль и т.п.) и технологические (качество продуктов, разделительный потенциал и т.п.) критерии. Тот или иной критерий выбирают исходя из поставленной задачи. Выбранный критерий должен соответствовать некоторым требованиям (11):
1. он должен характеризовать эффективность процесса с точки зрения конечной схемы производства;
2. должен быть количественным и однозначным;
3. должен иметь физический смысл, чтобы можно было найти его значение для модельного процесса;
4. должен обладать простой и лёгкостью вычисления.
Ни один из существующих критериев не может отвечать всем требованиям. Наибольшему числу соответствует экономический критерий, но его расчет весьма трудоемок. Поэтому, для предварительных оценок часто используют другие критерии. В данной работе представлен один из таких критериев – энергозатраты, которые, для большого числа смесей изменяются пропорционально приведённым затратам. Для процесса ректификации энергозатраты определяются количеством тепла, подведенного в куб колонны, и могут быть определены по формуле:
Qi = riDi (Ri+1)
для i- ой колонны
![]()
для j - ой схемы
![]()
где: F– функция для определения оптимальной схемы
ri – мольная теплота испарения жидкости, кипящей в кубе;
Di – поток дистиллята;
R – флегмовое число для i - ой колонны;
z – число возможных схем разделения;
n – число ректификационных колонн.
Таким образом, расчет критерия энергозатрат сводится к расчету флегмового числа.
Таким образом, сама постановка задачи оптимизации предполагает наличие:
- объекта и выявление цели оптимизации. При этом устанавливается экстремальное значение только одной величины;
-возможности выбора значений некоторых параметров оптимизируемого объекта. При этом объект должен обладать определенными степенями свободы, т.е. при воздействии внешних факторов на систему изменять ее первоначальное состояние в соответствии с заданными требованиями;
- количественной оценки оптимизируемой величины, позволяющей выявить влияние управляющих воздействий.
Модели ПЖР
Выбор модели, адекватно описывающей фазовое равновесие системы, является важным и необходимым шагом при решении массообменного процесса. На сегодняшний день разработано достаточно большое число методов математического моделирования различных типов парожидкостного равновесия. В настоящей работе на основании общих рекомендаций по применению были выбраны три группы математических моделей, имеющих различное представление о структуре раствора и межмолекулярных взаимодействиях:
· Модели локальных составов (Wilson, NRTL, UNIQUAC);
· Уравнения состояния (SRK, Peng Robinson);
· Групповая модель (UNIFAC).
Рассмотрим их более подробно.
Модели локальных составов
Концепция локальных составов позволяет учитывать структуру раствора, свойства чистых веществ и межмолекулярные взаимодействия разных типов (слабые неспецифические и сильные специфические). Согласно этой теории раствор рассматривается как упорядоченная структура. Для бинарной смеси можно выделить молекулы двух сортов, при этом молекула одного вида находится в окружении молекул другого вида. Зависимость между концентрациями компонентов внутри такого образования с общей молярной концентрацией компонентов в растворе описывается соотношением, учитывающим вероятность возникновения связей между разноименными молекулами.
Модель Вильсона(15,16,17,)
Уравнение Вильсона было первым уравнением, в котором была применена концепция локального состава. Основная идея ее состоит в том, что из-за разницы в межмолекулярных взаимодействиях локальный состав вблизи конкретной молекулы в растворе будет отличаться от состава жидкости. Для бинарной пары два параметра связаны со степенью, в которой каждая молекула влияет на состав своего локального окружения. Выражение для коэффициента активности представлено ниже:
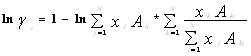
где :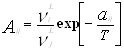 , (aij, °K);
, (aij, °K);
![]() – мольный объем жидкости компонента i.
– мольный объем жидкости компонента i.
Параметры aij представляет энергию взаимодействия между молекулами i и j.
Уравнение Вильсона может быть использовано в довольно широком интервале температур, несмотря на то, что его параметры в явном виде не включают температурную зависимость. Эта модель также дает хорошие результаты для смесей, содержащих полярные компоненты.
К недостаткам модели можно отнести то, что уравнение Вильсона не может описывать локальные максимумы или минимумы коэффициента активности, а также не подходит для описания равновесия с частично смешивающимися жидкими фазами.
Модель NRTL (18,19)
Уравнение NRTL (non-random two-liquid – неслучайное двужидкостное) было разработано Реноном и Праузницем с целью использовать концепцию локального состава в тех случаях, когда уравнение Вильсона неспособно к предсказанию разделения фаз жидкость – жидкость. Модель NRTL дает хорошие результаты для широкого круга систем, в частности для смесей в высокой степени неидеальных и для частично несмешивающихся систем.
Выражение для коэффициента активности имеет вид:
![]()
![]() , (когда единицей измерения является °K)
, (когда единицей измерения является °K)
![]()
Для каждой бинарной пары требуется три параметра (![]() ,
, ![]() ,
, ![]() ), которые могут быть расширены включением в них температурной зависимости.
), которые могут быть расширены включением в них температурной зависимости.
Модель UNIQUAC (20,21,22,)
Уравнение UNIQUAC (universal quasi-chemical – универсальное квазихимическое) было развито Абрамсом и Праусницем на основании статистически-механических положений и решеточной квазихимической модели Гуггенхайма. Каждую молекулу характеризует два параметра: объем ![]() и площадь (поверхность)
и площадь (поверхность) ![]() .
.
Избыточная энергия Гиббса (и соответственно логарифм коэффициента активности) делится на комбинаторную и остаточную части. Комбинаторная часть зависит только от размеров и форм отдельных молекул, она не содержит бинарных параметров. Остаточная часть, которая учитывает энергетические взаимодействия, имеет два регулируемых бинарных параметра. Выражение для коэффициента активности имеет следующий вид:
![]()
![]()

![]()
![]()
![]()
![]()
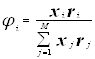
![]()
![]()
![]()
где ![]() ,
, ![]() – объем и площадь Ван-дер-Ваальса молекулы i
– объем и площадь Ван-дер-Ваальса молекулы i
С и R – комбинаторный и остаточный вклады в коэффициент активности жидкости.
Для каждой бинарной пары необходимы два параметра: Uij и Uji, которые используются в вычислениях остаточной части коэффициента активности. По желанию параметры могут быть расширены включением температурной зависимости.
Уравнение UNIQUAC адекватно описывает широкий ряд систем, оно применяется для неэлектролитических смесей, содержащих полярные или неполярные компоненты, также подходит для частично смешивающихся систем.
Уравнения состояния (23,24)
Уравнения состояния применимы для широкого диапазона температур и давлений. Они могут быть использованы для расчетов всех термодинамических свойств, таких как К-значения, энтальпия, энтропия и плотность. Стандартным состоянием как для жидкости, так и для пара является идеальный газ, а отклонения от идеального поведения определяются расчетом коэффициентов фугитивности для обеих фаз.
Модель SRK
В 1972 г. для улучшения предсказания парового давления чистых компонентов и парожидкостного равновесия многокомпонентных смесей Соав предложил следующую температурную зависимость:
![]()
![]()
где ![]() – приведенная температура, Т/Тс
– приведенная температура, Т/Тс
![]() – ацентрический фактор
– ацентрический фактор
Константы в уравненииях были получены из преобразования данных по паровому давлению для ограниченного числа обычных углеводородов. Эти пределы использования уравнения состояния СРК ограничены неполярными компонентами.
Уравнение состояния Соав-Редлих-Квонга – это модификация уравнения состояния Редлиха-Квонга (которое основано на уравнении Ван-дер-Ваальса). Соав заменил член ![]() более общей температурной зависимостью а(Т). Выражение получило следующий вид:
более общей температурной зависимостью а(Т). Выражение получило следующий вид:
![]()
где ![]()
![]()
![]() ,
, ![]() – критические температура и давление для i-го компонента
– критические температура и давление для i-го компонента
![]()
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Характеристика белков
СодержаниеВведение1 Общая характеристика белков2 Классификация белков3 Строение белков4 Синтез белков5 Приготовление пищиТестыЗаключ
- характеристика кобальта
Кобальт (лат. Cobaltum), Со, Название металла произошло от немецкого Kobold - домовой, гном. Соединения кобальта были известны и применялись в г
- Разделение урана и тория с помощью тонкослойных неорганических сорбентов
Уральский Государственный Технический Университет - УПИКафедра РадиохимииЛабораторная работа № 1:“Разделение урана и тория с помощью
- Характеристика химического элемента № 6 Углерод
Южно-Уральский государственный университетКафедра ЕНХарактеристика химического элемента№ 6 УглеродВыполнил:студент группы ММВ-335Ко
- Разложение клетчатки микроорганизмами
Еще в древности при построении деревянных судов для защиты дерева использовали асфальт. Во времена Римской империи суда обивали метал
- Химико-технологические системы производств кремния высокой чистоты
ВведениеПо распространенности в земной коре (27,6%) кремний занимает второе место после кислорода. Металлический кремний и его соединени
- Разработка методики определения ультрамикрограммовых количеств тяжелых металлов методом инверсионной вольтамперометрии
Глава 1. Анализ следовых количеств веществ и электрохимические инверсионные методы1.1 Анализ следовых количеств веществ и проблемы,
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

