Пестициды группы хлорфеноксикарбоновых кислот
Анализ в водных объектах методом капиллярного электрофореза.
Н.В. Комарова , А.А. Карцова
Применение пестицидов было и остается одним из основных путей интенсификации сельскохозяйственного производства. Однако, будучи чужеродными химическими веществами, вносимыми в окружающую среду, пестициды могут представлять собой известную опасность для природы и человека. Многие пестициды способны длительно сохраняться в среде обитания людей, попадая из одного объекта среды в другой и превращаясь в более токсичные соединения. Согласно мировой экологической статистике пестициды входят в группу экотоксикантов, составляющих так называемую "грязную дюжину" (1).
В качестве гербицидов наибольшее распространение получили хлорфеноксикарбоновые кислоты (ФКК) и их производные. Ввиду отсутствия приемлемых альтернативных способов борьбы с сорняками производство и потребление пестицидов этой группы продолжает возрастать. Общая формула для соединений группы хлорфеноксикарбоновых кислот
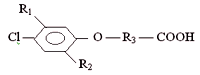
Известно влияние заместителей R1 и R2 на гербицидную активность этих соединений. В общем случае возрастание активности происходит при R=Hal, причем максимум гербицидной активности наблюдается при наличии в бензольном кольце двух атомов хлора, при дальнейшем росте числа атомов Hal гербицидная активность снижается. Таким образом, соединения группы 2,4-дихлорфеноксикарбоновых кислот являются самыми активными гербицидами и, следовательно, наиболее широко используются. Активному распространению соединений группы 2,4-Д способствует также наличие у отдельных ее представителей (2,4-Д, 2,4-ДМ, 2М-4ХП) гормональных свойств: применение препаратов, содержащих указанные гербициды, ведет к интенсификации биосинтеза белка, стимулированию корнеобразования и ускорению дозревания плодов (2).
Наиболее распространенные пестициды группы ФКК и их ПДК в водных объектах представлены в табл.1.
Таблица 1. Перечень наиболее распространенных пестицидов группы ФКК и их ПДК в объектах окружающей среды.
| Название | Синоним или краткое обозначение | ПДК, мг/л |
| Кислота феноксиуксусная | ФУК | 1 (питьевая вода) |
| Кислота 2,4-дихлорфеноксиуксусная | 2,4-Д | 0,03 (питьевая вода) 1 (природная) |
| Кислота 2-метил-4 хлорфеноксиуксусная | 2М-4Х, МСРА | 0,02 (воды рыбохоз. водоемов) 0,04 (сан-быт.) |
| Кислота 2,4,5-трихлорфеноксиуксусная | 2,4,5-Т | Запрещена к применению! |
| Кислота 2,4-дихлорфенокси--пропионовая | Дихлорпроп, 2,4-ДР | 0,5 (питьевая) 0,62 (природная) |
| Кислота 2-метил-4-хлорфенокси--пропионовая | Мекопроп, 2М-4ХП, МСРР | ---- |
| Кислота 2,4,5-трихлорфенокси--пропионовая | 2,4,5-ТР, Silvex | ---- |
| Кислота 2,4-дихлорфенокси--масляная | 2,4-ДВ | 0,01 (питьевая) |
В народном хозяйстве представители ФКК применяются в качестве гербицидов (для борьбы с сорняками), арборицидов (для уничтожения малоценных пород кустарников), альгицидов (для уничтожения водных растений при зарастании водоемов). Попадая в различные объекты окружающей среды, пестициды накапливаются в них либо включаются в различные миграционные цепи (рис. 1). При этом в каждом из объектов окружающей среды пестициды подвергаются всевозможным процессам разложения. ФКК характеризуются сравнительно низкой персистентностью- способностью сохраняться какое-либо время в окружающей среде, не теряя своей биологической активности, и, например, в почве подвержены каталитическим процессам разложения с участием микроорганизмов и ферментов: деалкилированию, дегалогенированию, гидролизу, разрыву кольца и т.д. с образованием в конечном итоге 2,4-Д и 2,4-ДХФ (2,4-дихлорфенола), более стабильных, чем исходные соединения. Обладая хорошей растворимостью в воде, продукты разложения вымываются из почвы и поступают в грунтовые воды, а затем в открытые водные объекты.
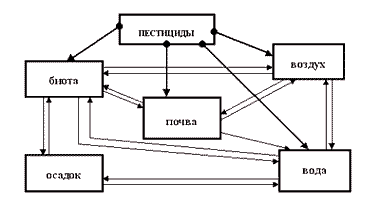
Рис.1 Накопление и миграция остаточных количеств пестицидов в окружающей среде.
Кроме того, в водные объекты ФКК могут поступать как при непосредственном внесении ядохимикатов в водоемы (в качестве альгицидов), так и со стоками химических и родственных производств. В водных объектах ФКК также претерпевают разложение до 2,4-Д и 2,4-ДХФ (3).
Стабильность 2,4-Д в различных объектах отражена в табл.2 и зависит как от физико-химических свойств вещества, так и биологической природы среды, температуры, влажности, УФ-радиации и т.д.
Таблица 2. Стабильность 2,4-дихлорфеноксиуксусной кислоты в объектах окружающей среды.
| Объект среды | Максимальная стабильность препарата, сутки |
| Почва | 300-500 |
| Растительные материалы | 120-180 |
| Водные организмы | 100-150 |
| Водная среда | 120 |
О распределении 2,4-Д в водных объектах имеются противоречивые данные. Учитывая коэффициенты распределения пестицида между отдельными компонентами биосферы, в (4) было показано, что наибольшая доля 2,4-Д накапливается в воде (93,8 %), а в (3) продемонстрировано распределение 2,4-Д при поступлении в воду: основная доля (60%) метаболизируется в растительном материале в виде конъюгатов, незначительная часть (5-10%) адсорбируется донными осадками, песком и 30% остается в воде.
Экологическая безопасность пестицидов связана с их избирательностью, а также большей или меньшей персистентностью. Класс ФКК относится к среднетоксичным соединениям, значительно уступая по токсичности, например, группе хлорорганических пестицидов. Тем не менее ряд представителей ФКК обладают отдаленным токсическим действием: так у 2,4,5-Т выражено эмбриотропное действие и этот препарат запрещен к применению в России.
Будучи ксенобиотиками, вносимыми в окружающую среду, пестициды представляют собой несомненную опасность для природы и человека. Важную роль в предотвращении негативных последствий применения пестицидов играет контроль за содержанием их токсических остатков в объектах окружающей среды, растениеводческой продукции, кормах и продуктах питания. Наиболее широко для анализа пестицидов класса ФКК используют физико-химические методы и в первую очередь ГЖХ и ВЭЖХ, отличающиеся высокой селективностью и чувствительностью определения ФКК (5,6,7,8). Однако, кроме вышеуказанных достоинств методики имеют ряд недостатков. Так, например, используемые в ГЖХ-варианте дериватизирующие агенты представляют собой высокотоксичные соединения, а в ВЭЖХ-варианте известно мешающее влияние гуминовых кислот и связанные с этим дрейф базовой линии, трудности при идентификации и количественном определении. Кроме того, оба хроматографических метода анализа характеризуются сложностью аппаратурного оформления.
В гораздо меньшей степени для аналитического контроля различных объектов на содержание пестицидов используют фотометрические, электрохимические, иммуноферментные методы и методы биоиндикации (5,9). Большинство указанных методов характеризуются длительностью пробоподготовки, использованием большого количества (и объемов) реактивов, некоторые требуют наличия дорогих специфических реагентов.
Относительно новым, экспрессным и достаточно чувствительным методом анализа пестицидов является капиллярный электрофорез (10). ФКК в нейтральных и щелочных растворах диссоциируют с образованием органических анионов. Этот факт определяет самый простой вариант их анализа методом капиллярного электрофореза так называемый зонный электрофорез, при котором компоненты пробы, введеной с входного конца кварцевого капилляра, разделяются в электрическом поле за счет их различных подвижностей и детектируются в виде дискретных зон индивидуальных компонентов. Необходимо отметить важность разделения и последующего определения не только самих ФКК, но и продуктов их деструкции, многие из которых также оказывают токсическое воздействие на окружающую среду и человека. Для ФКК таким сопутствующим компонентом является 2,4-дихлорфенол (2,4-ДХФ).
В качестве разделительной системы выбрана смесь приоритетных гербицидов (кислоты: феноксиуксусная, 2,4-дихлорфеноксиуксусная (2,4-Д), 2,4,5-трихлорфеноксиуксусная, 2,4-дихлорфенокси- -пропионовая и 2,4-дихлорфенокси- -масляная) и конечного продукта их разложения (2,4-дихлорфенол). Все компоненты обладают заметным поглощением в УФ-области. Работа выполнялась на приборе "Капель-103" (НПФ АП "Люмэкс"), с кадмиевой лампой ( раб 228,8 нм); длина используемого кварцевого капилляра 65 см (эффективная длина- 55 см); внутренний диаметр капилляра 75 мкм.
Оптимизировались следующие условия разделения ФКК методом зонного электрофореза:
Выбор ведущего электролита, оптимизация концентрации и рН.
Ввод пробы (гидродинамический, электрокинетический), оптимизация времени ввода для гидродинамического способа. Оценка способа ввода с выходного конца капилляра.
Рабочее напряжение.
Полярность прибора.
Температура.
Оптимальными признаны следующие условия разделения: гидродинамический ввод-30 мбар 30 сек; ведущий электролит- тетраборат натрия с концентрацией 10 мМ, рН 9,18; рабочее напряжение +20 кВ. В оптимальных условиях проведено разделение смеси гербицидов (рис.2). Показано, что разделение происходит в течение двух минут (при общем времени анализа 9 мин).
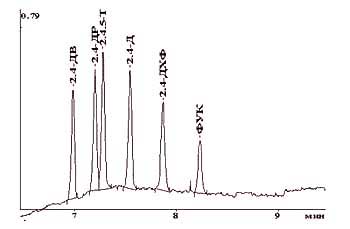
Рис.2. Электрофореграмма смеси пестицидов группы ФКК и 2,4-дихлорфенола. Система капиллярного электрофореза "КАПЕЛЬ-103" (НПФ АП "ЛЮМЭКС", г. Санкт-Петербург), ведущий электролит: 10 мМ тетраборат натрия, рН=9,18; ввод пробы: 30 мбар 30 сек; капилляр: 65 см 75 мкм; напряжение: +20 кВ; детектирование: УФ, 228,8 нм. Состав анализируемой смеси (в скобках указана концентрация компонента в анализируемом растворе, мг/л): 2,4-ДВ (2.5), 2,4-ДР (2.0), 2,4,5-Т (2.0), 2,4-Д (2.0), 2,4-ДХФ (1.6), ФУК (2.0). Сбор и обработка данных- с помощью ПО "МультиХром" (фирма "Амперсенд", г. Москва).
На рис.3 представлен градуировочный график для 2,4-Д. Диапазон измеряемых концентраций 0,2 20 мг/л. Для водных объектов пробоподготовка заключается в фильтровании образца, его разбавлении буферным раствором и центрифугировании полученной смеси.
Используя предварительное концентрирование пробы (твердофазную экстракцию или жидкостно-жидкостную экстракцию), можно существенно снизить предел обнаружения каждого компонента.
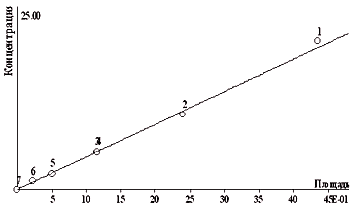
Рис 3. Градуировочный график для определения концентрации 2,4-Д.
Главными достоинствами метода капиллярного электрофореза являются его высочайшая эффективность разделения (на несколько порядков превышающая эффективность газовой и жидкостной хроматографии), экспрессность анализа и его простота, малый расход реактивов. Повышение селективности разделения ФКК возможно при переходе к мицеллярному варианту капиллярного электрофореза - так называемой мицеллярной электрокинетической хроматографии, а также при добавлении в ведущий электролит макроциклических реагентов (циклодекстрины, краун-эфиры, криптанды).
Таким образом, капиллярный электрофорез является новым инструментальным методом анализа пестицидов. Тем не менее совершенствование процедур пробоподготовки (при переходе к почвам и пищевым продуктам) и оптимизация всего анализа в целом остаются актуальной задачей.
Тинсли И. Поведение химических загрязнителей в окружающей среде./ Пер. с англ. М.: Мир, 1992. 281с.
Лунев М.И. Пестициды и охрана агрофитоценозов. М.: Колос, 1992. 269с.
Федорова Л.М., Белова Р.С. Производные хлорфеноксиуксусных кислот и охрана окружающей среды. Саратов: СГУ, 1983. 124с.
Прогнозирование поведения пестицидов в окружающей среде. Тр. Сов.-амер. симпоз. Ереван, октябрь 1981. Л.: Гидрометеоиздат, 1984. 306с.
Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. М.: Колос, 1977. 215с.
Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде. М.: Колос, 1983. 297с.
Методика выполнения измерений массовой концентрации 2,4-Д, симазина, атразина в питьевой воде, воде водоемов и водоисточников методом ВЭЖХ. Уфа, РБ.АП-31/96.
Hogendoorn E.A., Dijkman E., Bauman B. Anal.Chem. 1999, 71, 1111-1118.
Еремин С.А., Ефимова Ю.А., Лаасис Б., Арон Ж.-Ж. Агрохимия, 2, 1996, 102-106.
Penmetsa K.V., Leidy R.B., Shea D. J. Chromatogr. A, 745 (1996) 201-208.
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Соли
СОЛИ, класс химических соединений. Общепринятого определения понятия “Соли”, так же как и терминов “кислоты и основания”, продуктами
- Знакомство с экстракционной хроматографией
Принцип экстракционной хроматографии несложен и заключается в том, что в качестве неподвижной фазы используется экстрагент, нанесенн
- Редоксметрия
Несколько советов начинающему потенциометристуА.В.Каверин.Более или менее понятно, что же нужно для измерений и обсудили кое-какие тон
- Определение иона аммония методом капиллярного электрофореза
М. В. Андреева, Г.Н. Ишевская, Г. Н. Сметанин, ГУП "Центр исследования и контроля воды", Санкт-ПетербургНа сегодняшний день основной методи
- Фотосинтез
История фотосинтеза.В течение тысячелетий люди считали, что питается растение исключительно благодаря корням, поглощая с их помощью в
- Ньютонова революция в науке
Так математики и физики называют последнюю треть 17 века и первую четверть 18 века - то время, когда был создан современный математически
- Введение в капельный анализ
Капельным анализом называется качественный анализ, в котором либо индикатор, либо анализируемая проба имеет малый размер (размер капл
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

