Молокосвертывающие ферментные препараты, используемые в сыроделии
Молокосвертывающие ферменты растительного и животного происхождения известны человечеству очень давно, а в последние годы получили распространение бактериальные и грибковые препараты. Однако на заре сыроделия для получения сгустков из молока использовался преимущественно натуральный коагулянт — сычуг, полученный из желудков млекопитающих.
Следует отметить, что для приготовления сырных сгустков наряду с коровьим молоком используют молоко козы, овцы, буйвола, северного оленя, яка и ламы; востребованным оказывается также молоко нежвачных млекопитающих (верблюдицы, кобылы и ослицы). Эти виды молока для некоторых народов имеют большое питательное и экономическое значение. Несмотря на пригодность для производства не-ферментированных молочных продуктов молока верблюдицы, кобылы, ослицы, верблюжье молоко коагулирует под действием сычуга.
Тип образованного коагулята зависит от используемого фермента, баланса солей молока, рН, содержания в молоке других ингредиентов (жира, белков сыворотки) и состава самого казеина. Казеин, предварительно подвергнутый воздействию ферментов, не может формировать такой однородный сгусток, как нативный казеин. Сгусток, полученный при низком рН (4,6-5,0), характеризуется зернистой, колющейся и неэластичной структурой вследствие осаждения казеина в изоэлектрической точке растворимости или около нее. Коагулят, образующийся с помощью фермента при высоком рН (5,8-6,6), — более мягкий, гладкий, связанный и эластичный по сравнению с кислыми сгустками.
Несмотря на то что взаимодействия между отдельными компонентами молока достаточно сложны, субстратом, на который действует коагулирующий фермент (при наличии ионов кальция) с получением нерастворимого коагулята, включающего остальные компоненты молока (воду, жир, соли, белки), является казеин. Коагулят можно использовать как «сычужный сгусток молока», часто подслащенный и ароматизированный, но чтобы он стал сырной массой, из него следует удалить влагу/1/.
В настоящее время, в связи с дефицитом сычужного фермента из-за нецелесообразности забоя молодняка в молочный период жизни и снижения количества скота при резком возрастании его продуктивности, широко используются другие ферменты, близкие по действию к сычужному: пепсины, энзимы, продуцируемые некоторыми микроорганизмами.
Разработаны методы генной инженерии, позволяющие включать гены, осуществляющие синтез сычужного фермента, в геномы микроорганизмов, и тем самым осуществлять синтез сычужного энзима микроорганизмами. Сычужный фермент, полученный методами генной инженерии, уже вырабатывается и применяется в промышленных масштабах/2/.
1 НОМЕНКЛАТУРА .КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
Для сыроделия пригодны энзимы, быстро разрывающие связь между гидрофобной и гидрофильной частями х-казеина и не оказывающие отрицательного влияния на выход и органолептические показатели сыров. Энзимы, удовлетворяющие этим требованиям, называются «молокосвертывающими ферментами», хотя слово «ферменты» не совсем удобно, поскольку на французском и английском языках оно означает «закваска», «дрожжи» или глагол «бродить». Ферменты в нашем понимании за рубежом называются энзимами.
Перечень нашедших достаточно широкое применение в сыроделии молокосвертывающих энзимов приведен в таблице 1.
Таблица 1 — Номенклатура и источники молокосвертывающих ферментов
| Название | Название (МКФ)* | Другие названия | Источники |
| Пепсии | Пепсин А (ЕС 3.4.23.1) | Пепсин II | Жвачные, цыплята, свиньи |
| Гастриксин** | Пепсин С (ЕС 3.4.23.3) | Пепсин I Парапепсин II Пепсин В | Жвачные, свиньи |
| Химозин | Химозин (ЕС 3.4.23.4) | Реннин | Жвачные |
М.miehei протеиназа (ММР) | (ЕС 3.4.23.6) | Реннилаза (Nоѵd), Ха-нилаза(Сhr. Наnserі), Фромаза (Wa11еrstеm), Марзим (Міlеs) | Мисоr mіеhеі |
М рusillus протеиназа (МРР) | (ЕС 3.4.23.6) | Емпораз(Dairуlаnd), Мейто(Меіtо Sаngо), Ноури (Ѵіtех) | Мucor рusillus ѵаr. Lіndt. |
| К.раrasitica протеиназа (ЕРР) | (ЕС 3.4.23.6) | Супарен (Рfizer) Сур Курд | Еndothia раrаsitіса |
* МКФ - Международная классификация энзимов (ферментов).
* * Гастриксин отличается от других пепсинов и химозина, поэтому он помещен в отдельную группу.
Молокосвертывающий энзим, доминирующий в четвертом отеле желудка телят в возрасте до 14 дней, до недавнего времени занимал господствующее положение в сыроделии. Он получил название «химозин» от греческого слова «сhуmе», означающего «желудочный сок». На английском языке его называют «реннин» (от «реннет» - сычуг). Международная номенклатура энзимов рекомендует для него название «химозин», потому что реннин легко спутать с названием другого энзима - «ренин», образующегося в почках.
В коммерческих экстрактах из сычугов молодняка млекопитающих, именуемых «сычужным ферментом», или, что правильнее, «сычужным порошком», кроме химозина содержатся другие энзимы, главным образом пепсины. В английском языке эти препараты называют «реннет». В соответствии с техническими условиями доля молокосвертывающей активности сычужного порошка за счет пепсинов не должна превышать 30% от его общей молокосвертывающей активности. Доля химозина в экстрактах из сычуга уменыыается с возрастом: в экстрактах сычугов коровы его содержится в семь раз меныпе, чем в экстрактах сычугов телят.
В связи с недостатком сычужного порошка в сыроделии начали широко применять другие препараты, которые можно разделить на две группы: пепсины — желудочные протеазы жвачных и некоторых других животных - и кислые протеазы микробиального происхождения. Из первой группы наиболыпее распространение получили говяжий, свиной и куриный пепсины. Пепсины чаще всего используют в, виде смесей друг с другом или с сычужным порошком. Из микробиальных молокосвертывающих энзимов получили достаточно широкое применение только некоторые протеазы (ММР, МРР и ЕРР), образуемые плесневыми грибами (табл. 1).
Все более широкое применение получают препараты рекомбинантного химозина, получаемые с помощью микроорганизмов. Химический состав, степень использования белка и жира молока, органолептические показатели сыров, вырабатываемых с препаратами обычного и микробиального химозина из Кіиуѵегошусез Іасгіз, Е. соіі и Азр. пі§егѵаг. а\ѵатогі, идентичны.
Молокосвертывающие энзимы в международной классификации энзимов помещены в одну группу ЕС 3.4.23, хотя плесневые протеазы сильно отличаются от молокосвертывающих энзимов животного происхождения по специфичности и структуре/2/.
Классификации МФП по природе происхождения ферментов, то есть сырье, из которого они производятся.По природе происхождения (используемому сырью) можно выделить следующие группы:
1. Ферменты животного происхождения;
2. Ферменты микробного происхождения;
3. Ферменты растительного происхождения /3/.
Следующим признаком может являться технология получения ферментов из исходного сырья. По этому признаку можно выделить следующие группы:
1. Технология экстракции или автолиза ферментов из сырья;
2. Технология контролируемой ферментации;
3. Технология рекомбинационной (геннонаправленной) ферментации. Третьим признаком должна быть методика нормализации молоко-свертывающих препаратов до товарного продукта по:
1. Ферментному составу;
2. Молокосвертывающей активности;
3. Наполнителям;
4. Консервантам и прочим добавкам/4/.
2 СВОЙСТВА МОЛОКОСВЕРТЫВАЮЩИХ ЭНЗИМОВ
Все молокосвертывающие энзимы, достаточно широко используемые и сыроделии, принадлежат к кислым протеазам, проявляющим максимальную активность в кислой среде. Они характеризуются высоким содержанием дикарбоновых аминокислот, низким содержанием основных аминокислот . Их еще называют аспарагиновыми протеазами, потому что в их активном центре имеются два остатка аспартата .Кислые протеазы содержат 325-360 аминокислотных остатков; молекулярная масса их находится в пределах 33000-38000. Молекулярные массы говяжьего химозина и свиного пепсина равны 35600 и 34600 соответственно.
Молокосвертывающие энзимы животного происхождения выделяются в виде проферментов, которые превращаются в активные энзимы путем отщепления от N-терминального конца ингибитора, содержащего около 45 аминокислотных остатков. Плесневые кислые протеазы образуются в активной форме. Активизацию проферментов инициируют водородные ионы. Активизация - процесс автокаталитический, протекает при рН 2,0-4,6. На молочные заводы препараты молокосвертывающих энзимов поступают в активной форме и концентрированном виде.
В природе нет энзимов, катализирующих разрыв только связи Феню5-Метюб в χ -казеине, но молокосвертывающие энзимы должны расщеплять эту связь во много раз быстрее, чем другие связи в протеинах молока, так как весь χ-казеин должен быть гидролизован молокосвертывающими энзимами во время выработки сыра, иначе не произойдет коагуляция казеина или значительная часть казеина останется в сыворотке. Любая другая протеолитическая активность молокосвертывающих энзимов во время выработки сыра нежелательна, так как растворимые продукты протеолиза остаются в сыворотке, что снижает выход сыра. По-видимому, теряется для сыра и макропептид, отделяемый от х-казеина в результате гидролиза молокосвертывающими энзимами, но с этим нужно мириться, так как без гидролиза χ-казеина сычужный сыр выработать нельзя.
Способность быстро гидролизовать χ-казеин - общее свойство молокосвертывающих энзимов, применяемых в сыроделии, - называют молокосвертывающей активностью, в отличие от способности расщеплять другие связи в белках, получившей название общей протеолитической активности. Общая протеолитическая активность молокосвертывающих энзимов по отношению к молокосвертывающей должна быть как можно более низкой.
Одна часть кристаллического химозина может свернуть 72 млн. частей молока при 35° С. Химозин гидролизует в χ-казеине связь Фен105 -Метюб в 200 раз быстрее, чем другие связи. Это обусловлено составом и последовательностью расположенных рядом с ней аминокислот. χ-Казеины женского и свиного молока вообще не содержат этой связи, но оба гидролизуются говяжьим химозином, хотя и медленнее, чем χ-казеин коровьего молока. По данным Foltmfn с соавт., говяжий химозин свертывает коровье молоко в два раза быстрее, чем свиное, а свиной химозин свертывает свиное молоко в шесть раз быстрее, чем коровье.
Молокосвертывающие энзимы существенно различаются по отношению общей протеолитической активности к молокосвертывающей. При оптимальном для каждого фермента рН и равной молокосвертывающей активности соотношение общей протеолитической активности (по гемоглобину) говяжьего химозина, говяжьего и свиного пепсина составило 1:3:6. На рис.1 показан гидролиз казеина некоторыми молокосвертывающими препаратами при рН 5,5, близком к рН созревающих сыров и содержимому желудка телят в молочный период. Неспецифический протеолиз (избыточный по отношению к химозину) после 3-часовой инкубации составил для свиного пепсина 0,275 мг, для говяжьего -0,10 мг, для смеси химозин + говяжий пепсин - 0,05 мг, что соответствовало 87,9; 30 и 12% к протеолизу под действием химозина. Химозин обладает самой низкой общей протеолитической активностью по отношению к молокосвертывающей активности.
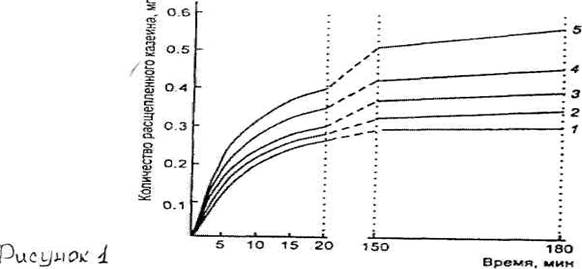
Рисунок 1. Сравнительиые данные по гидролизу казеина прирН 5,5 (/ -рентш; 2 -реннин + бычий пепсин (1:1); 3 - бычий пепсин-4 - решшн + свиной пепсин (!: 1); 5 - свиной пепсин)
Характер протеолиза в результате совместного действия молокосвертывающих энзимов и Lc. lactis svbsp. lactis зависит от вида энзима: если содержание растворимого белка, пептидов и свободных аминокислот в обезжиренном молоке с сычужным порошком после роста молочного лактококка принять за 100%, то оно будет равно соответственно: в молоке со свиным пепсином 41,1; 105,5; 22,8%; с куриным пепсином 45,2; 125 и 17,7%). При замене сычужного порошка пепсинами содержание растворимых белков и свободных аминокислот в результате кооперативного протеолиза уменьшилось, а содержание пептидов увеличилось. Появление горечи в сырах связано с накоплением в них специфических пептидов.
Следует отметить более высокую общую протеолитическую активность промышленных препаратов сычужного порошка по сравнению с кристаллическим химозином (рис. 2), что обусловлено наличием в первых не только химозина, но и пепсинов. После расщепления χ-казеина и свертывания молока кристаллическим химозином содержание продуктов протеолиза практически не увеличивается, тогда как при использовании сычужного порошка их накопление идет интенсивнее до свертывания и продолжается после свертывания.
Рисунок 2
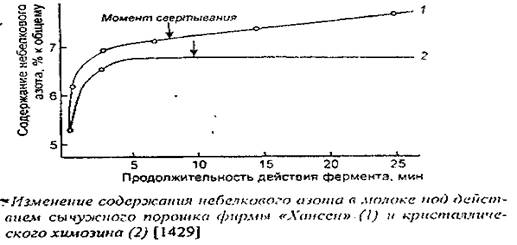
Более низкая общая протеолитическая активность химозина по сравнению с пепсинами имеет важное физиологическое значение, поскольку новорожденные в первый период жизни не имеют собственных защитных систем и нуждаются в нативных иммуноглобулинах молозива для защиты от инфекций.
Гидролиз других, чем χ -казеин, казенное молокосвертывающими энзимами протекает во время созревания сыров. Исключением являются твердые сыры с высокими температурами II нагревания и с плавлением сырной массы, во время выработки которых молокосвертывающие энзимы полностью или частично разрушаются. Участие молокосвертывающих энзимов в протеолизе во время созревания сыра необходимо для формирования органолептических показателей созревающих сыров, но количественные и/или качественные отклонения от нормального хода протеолиза вызывают пороки вкуса и консистенции. Под нормальным протеолизом в сыроделии понимают протеолиз под действием химозина при характерных для сыра условиях.
Более высокая общая протеолитическая активность молокосвертываюших энзимов по сравнению с химозином, как правило, оказывает отрицательное влияние на качество сыров, особенно с длительными сроками созревания. Например, потери молочного жира с сывороткой были выше, а плотность сгустка и качество сыра Чеддер ниже при использовании для свертывания молока пепсина вместо химозина. Однако сыры, вырабатываемые с кристаллическим химозином, имеют менее выраженный вкус и медленнее созревают, по сравнению с сырами, вырабатываемыми из этого же молока и по этой же технологии, но с сычужным порошком. Следовательно, общая протеолитическая активность молокосвертывающих энзимов в определенной степени необходима для получения сыров высокого качества.
Атака химозином χ-казеинов направлена на связи, включающие фенилаланин или лейцин. Первичная атака на χ-казеин направлена на связи Фен24-Фен25 или Фен24-Вал25 с образованием пептида άsl-І казеина. Дальнейший протеолиз может идти в растворе и сыре с последовательным образованием пептидов II, III, IV и так до XX. Под действием химозина и свиного пепсина из
άs-казеина образуется άsl пептид, но этот пептид далее расщепляется только химозином.
Гидролиз α- и β-казеинов идет с гораздо более низкой скоростью, чем χ-казеина, но благодаря длительности созревания и участия протеолитических энзимов микрофлоры закваски к концу созревания άsl -казеин и часть β-казеина бывают расщеплены. Пептиды, получающиеся в результате гидролиза казеинов молокосвертывающими энзимами, более доступны, чем исходный казеин, для протеолитических энзимов молочнокислой микрофлоры, которые играют главную роль в созревании твердых сыров. Участие в созревании, т.-е. в формировании характерных для сыров органолептических показателей, - вторая функция молокосвертывающих энзимов в сыроделии.
Из молокосвертывающих энзимов по общей протеолитинеской активности ближе всего к химозину стоит говяжий пепсин, свиной пепсин обладает более высокой общей протеолитической активностью; наименее пригоден для сыроделия куриный пепсин . Однако по другим данным, белый рассольный сыр, выработанный с цыплячьим пепсином или его смесью с реннетом, ничем не отличались от контрольных, выработанных только с реннетом, кроме более высокого содержания сухих веществ и общего азота.
Физико-химические факторы влияют как на скорость катализируемой реакции, так и на стабильность самого энзима, причем характер этого влияния на каждый процесс различается для разных энзимов. Протеолитическая активность энзимов в сырах может существенно отличаться от их активности в жидких средах. Так, сыры из молока, свернутого свиным пепсином, имеют удовлетворительные характеристики, потому что свиной энзим почти полностью инактивируется во время выработки сыров, и его высокая общая протеолитическая активность в сырах не реализуется .
Степень участия молокосвертывающих энзимов в созревании зависит от того, сколько их остается в сыре. Количество химозина, остающегося в сыре, увеличивается при снижении рН сыворотки и сырной массы.
Стабильность молокосвертывающих энзимов зависит от ионной силы среды, температуры, продолжительности выдержки и концентрации энзимов . Пепсин и химозин автолизируются при величине рН, оптимальной для их общей протеолитической активности. Плесневые протеиназы стабильны при рН до 2,5.
Общим свойством молокосвертывающих энзимов является снижение общей протеолитической активности при рН среды выше оптимального уровня. Одной из причин этого является инактивация энзимов при высоком рН. Скорость инактивации зависит от вида энзима (рис. 3). Так, говяжий пепсин начинает инактивироваться после 20-минутной выдержки только при рН выше 6,4, а при рН 7,0 сохраняет более трети исходной активности. В то же время свиной пепсин после 20-минутной выдержки при рН 6,4 теряет свыше 50% исходной активности, а при рН 7,0 почти моментально полностью инактивируется. Для свертывания молока с рН 6,6 за 5 мин, требуется одинаковая масса говяжьего и свиного пепсина, а при свертывании за 20 мин, свиного пепсина требуется в 2,5 раза болыне, чем говяжьего. Быстрая инактивация свиного пепсина в слабокислой среде, какой является молоко, является главным недостатком его как молокосвертывающего энзима.
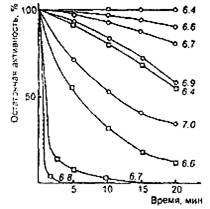
Зависимость устойчивости бычьего (о) и свиного (□) пепсина от рН при 35 ºС
Оптимальный рН для гидролиза χ-казеина химозином равен примерно 6,0, однако в интервале рН от 5,6 до 6,4 разница в скорости реакции невелика; активность снижается при рН выше 6,5 с несколько меньшей скоростью, чем для говяжьего пепсина (рис. 4). В интервале рН 6,6-6,7, характерном для молока в начале выработки сыра, скорость гидролиза χ-казеина химозином остается достаточно высокой. Куриный пепсин, гастриксин, фромаза стабильны в диапазоне рН, характерном для выработки и созревания сыра .
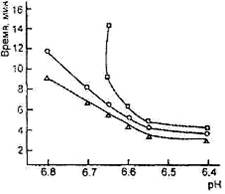
Зависимость моло-косвертывающей активности фер-ментов от рН (о- бычий пепсин, ∆'-реннин, □ - свиной пепсин)
Молокосвертывающие энзимы различаются по отношению к температуре. Изменение молокосвертывающей активности фромазы и сычужного порошка в зависимости от температуры показано на рис.4 (по материалам фирмы «Гист-Брокадес»). Отношение к температуре говяжьего пепсина почти такое же, как у сычужного порошка. В порядке возрастания устойчивости к нагреванию молокосвертывающие энзимы располагаются следующим образом: свиной пепсин, говяжий пепсин, химозин, фромаза и М. pusillus протеазы
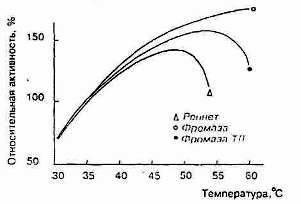
Рисунок 5 Влияние температуры на активность реписта и фромазы
Устойчивость к нагреванию понижается при повышении рН. Молокосвертывающая активность сычужного порошка максимальна при 45° С, чистого пепсина - при 35° С.(рис.5)
Желудочные протеазы млекопитающих показывают различную чувствительность к мочевине: пепсин к ней устойчив, химозин нет. Эти различия используют для их идентификации.
Обработка молока для выработки сыра 0,01-0,15% перекиси водорода повышает активность молокосвертывающих энзимов и микрофлоры закваски, увеличение дозы перекиси до 0,03-0,15% оказывает ингибирующее действие.
Исследования молокосвертывающей и общей протеолтичсскои активности показывают явное преимущество химозина перед другими молокосвертывающими энзимами. Отношение молокосвертывающей активности к общей протеолитической у химозина равно 40:9, а у говяжьего пепсина 4:3, что свидетельствует о высокой общей протеолитической активности пепсина, а следовательно, о большей опасности появления пороков в сырах, выработанных с пепсином /2/
3 МОЛОКОСВЕРТЫВАЮЩИЕ ФЕРМЕНТЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ
Одним из давно известных растительных коагулянтов является сок фигового дерева (Fісus саrіса), используемый в районах его произрастания. Многие экстракты растительного происхождения способны свертывать молоко, но некоторые из них имеют слишком высокую протеолитическую активность (например, папаин из азимины, Саrіса рарауа; бромелин из ананаса, Ananas satiѵа и рицин из масла семян кастора, Ricinus communis).
Экстракты растений, которые традиционно считались ферментными коагулянтами молока (майоран, мята, розмарин, подорожник, щавель и садовая бузина), таковыми не являются, т. е. имеют другой механизм действия. В табл.2 представлены некоторые растения, экстракты которых используются для свертывания молока; такие растения как правило содержат избыток клеточного сока.
Экстракты некоторых растений ядовиты, например, гемлок (Conium maculatum) и масло семян кастора (Ricinus communis). Некоторые растительнк экстракты применяют в удаленных районах, где другие коагулянты труднодоступны. Ряд таких экстрактов могут вызывать комбинированное свертывание с помощью кислоты и фермента, используемое в основном для выработки сыров с мягким тестом. Примером использования растительного экстракта может служить выработка португальского сыра Sеrrа dа Еstrеlа из овечьего молока с помощью водной вытяжки цветов кардона.
Таблица 2- Растения, экстракты которых используются для коагуляции молока
| Русское название | Латинское название |
| Кардон (артишок) | Cynaria cardunculus |
| Репейник | Articum minus |
| Паслен сладко-горький | Solnum dalcamara |
| Мальва | Malva sylvestris |
| Чертополох | Ciraumand Carlina spp. |
| Инжир | Ficus carica |
| Амброзия | Herculeum spondylum |
| Василек черный | Centurea spp. |
| Подмаренник | Galum verum |
| Крапива | Urtica diocia |
| Амброзия полыннолистная | Senedo jacobea |
| Лютики | Ranunculus spp. |
| Молочай | Euphorbia lathyrus |
| Ворсянка | Dipsacus sylvestris |
| Тысячелистник обыкновенный | Achillea millef olium |
Принимая во внимание многообразие коагулянтов, следует учитывать, что каждый из них имеет особые характеристики, поэтому при переходе от одного коагулянта к другому или при смешивании коагулянтов следует изучить услови их использования/1/
4 ОПИСАНИЕ МАРОК МОЛОКОСВЕРТЫВАЮЩИХ ФЕРМЕНТНЫХ ПРЕПАРАТОВ . СЫЧУЖНЫЕ ПРЕПАРАТЫ
В сычужные препараты марок СПУ «Экстра», СПУ и СП входят два фермента: химозин и пепсин. Стандартизируемые каждую марку препарата по ферментному составу. Сычужные порошки подразделяют на четыре вида по содержанию химозина - 60%, 70%, 80% и 90% от общей молокосвёртывающей активности, оставшаяся часть активности Молокосвертывающих Ферментных Препаратов(МФП) является активностью пепсина.
Марочный сычужный препарат СПУ «Экстра».
Сычужный порошок марки СПУ «Экстра» это элитный ферментный препарат, не имеющий отечественных аналогов. «Экстра» изготавливают по технологии, над разработкой которой сотрудники завода работали в течение четырёх лет. Главным элементом «ноу-хау» данной марки является управляемое конформационное преобразование молекул химозина в сычужном экстракте, что обеспечивает в дальнейшем, строгую направленность процесса воздействия препарата на казеин при свертывании молока. Препарат проходит операцию стабилизации, которая обеспечивает постоянство его молокосвёртывающей активности в течение всего срока годности.
Препарат обладает следующими отличительными особенностями:
1. Изготавливается только из телячьих сычугов высшего сорта.
2. Проходит три стадии очистки от нерастворимых примесей и жира.
3. Количество нерастворимых примесей в готовом продукте 0,5 ÷1,0% по массе.
4. Количество жира не более 0,5% по массе.
5. Общее количество бактерий в 1 г не более 1000 кое.
6. Соотношение ферментов химозин-пепсин естественное, свойственное их содержанию в желудке телёнка, питавшегося исключительно молоком. Для данной марки отбирают только те производственные партии сычужного фсрмента, в которых химозина содержится от 90% до 95 %.
7. Препарат стандартизуется по соотношению ферментов химозин-пепсин.
8. Имеет повышенную молокосвёртывающую активность 150 000 ÷ 160 000 условных единиц, что обеспечивает образование сырного сгустка даже на вялом молоке. Расход препарата при данной активности в производстве сыра составляет 1,3 ÷ 1,5 г на 100 л молока.
9. Препарат обеспечивает максимальный выход сыра. Препарат «Экстра» обозначают кодом ТРК 90.10.00.
Препарат «Экстра» рекомендуется к применению в производстве сыров любых марок без ограничений.
Препарат незаменим при производстве больших твердых сыров с высокой температурой второго нагревания и длительным сроком созревания. Например, сыров таких марок как «Швейцарский», «Советский», «Алтайский» и т.п.
Сычужный препарат марки СПУ (80.20.00).
Сычужный порошок марки СПУ имеет следующие отличительные особенности:
1. Изготавливается только из телячьих сычугов высшего и 1 -ого сортов.
2. Проходит три стадии очистки от нерастворимых примесей и жира.
3. Количество нерастворимых примесей в готовом продукте не более 2,0% по массе.
4. Количество жира не более 2% по массе.
5. Общее количество бактерий в 1 г не более 2000 кое.
6. Соотношение ферментов химозин-пепсин естественное, свойственное их содержанию в желудке телёнка, питавшегося исключительно молоком. Для данной марки отбирают только те производственные партии сычужного фермента, в которых химозина содержится от 80% до 85 %.
7. Препарат стандартизуется по соотношению ферментов химозин-пепсин.
8. Препарат имеет молокосвёртывающую активность 100 000 ÷ 120 000 условных единиц, его расход при данной активности в производстве сыра составляет 2,0 ÷ 2,5 г на 100 л молока,
9. Препарат обеспечивает максимальный выход сыра. Препарат СПУ обозначают кодом ТРК 80.20.00.
Препарат СПУ рекомендуется к применению в производстве сыров любых марок без ограничений.
Положительные свойства данной марки особенно заметны при производстве больших твердых сыров с высокой температурой второго нагревания и длительным сроком созревания. Например, таких марок как «Швейцарский», «Советский», «Алтайский» и т.п
Сычужные препараты марок СП (70.30.00), и СП (60.40.00).
Сычужные порошки марок СП имеют следующие отличительные особенности:
1. Изготавливаются из телячьих и ягнячьих сычугов высшего и 1 -ого сортов.
2. Проходят две стадии очистки от нерастворимых примесей и жира.
3. Количество нерастворимых примесей в готовом продукте не более 3,0% по массе.
4. Количество жира не более 2% по массе.
5. Общее количество бактерий в 1 г не более 2000 кое.
6. Соотношение ферментов химозин-пепсин достигается путем подбора и смешивания исходных партий различного состава. С целью достижения точного соотношения ферментов, возможно небольшое добавление говяжьего пепсина.
7. Препараты стандартизуются по соотношению ферментов химозин-пепсин.
8. Препараты имеют молокосвёртывающую активность 100 000 ÷ 120 000 условных единиц, расход при данной активности в производстве сыра составляет 2,0 ÷ 2,5 г на 100 л молока.
9. Препараты обеспечивают высокий выход сыра. Препараты СП обозначают кодом ТРК 70.30.00. и 60.40.00.
Препараты СП рекомендуется к применению в производстве сыров любых марок без ограничений.
Положительные свойства данных марок МФП позволяют широко использовать их как в производстве больших твердых сыров с высокой температурой второго нагревания, так и в сырах с низкой температурой второго нагревания. Данные марки позволяют также успешно вырабатывать сыры с повышенным уровнем молочнокислого процесса (например, «Российский») и сыры, созревающие при участии микрофлоры сырной слизи (например, «Латвийский» и «Пикантный»).
Сычужно - говяжие МФП марок СГ 50/50 и СГ 25/75 являются великолепными заменителями традиционных сычужных ферментов.
Препараты этих марок изготавливают путём смешивания исходного сычужного фермента с говяжьим пепсином. Они имеют следующие отличительные особенности:
1. Изготавливаются из телячьих и ягнячьих сычугов и слизистой оболочки сычуга взрослого КРС.
2. Проходят две стадии очистки от нерастворимых примесей и жира.
3. Количество нерастворимых примесей в готовом продукте не более 3,0% по массе.
4. Количество жира не более 2% по массе.
5. Общее количество бактерий в 1 г не более 3000 кое.
6. Соотношение ферментов химозин-пепсин достигается путем подбора и смешивания исходных партий различного ферментного состава.
7. Препараты стандартизуются по соотношению ферментов химозин-пепсин.
8. Препараты имеют молокосвёртывающую активность 100 000 ÷ 420 000 условных единиц, расход препаратов при данной активности в производстве сыра составляет 2,0 ÷ 2,5 г на 100л молока.
9. Препараты обеспечивают высокий выход сыра. Препараты СГ обозначают соответствующими кодами ТРК.
Препараты СГ рекомендуются к
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Организация снабжения предприятий общественного питания, сырьём, полуфабрикатами и материально-техническими средствами на примере ресторана на 200 мест
Пища - основа жизни человека. От того, как человек питается, зависит его здоровье, настроение, трудоспособность. Следовательно, питание ч
- Товарознавча характеристика шоколадної плитки
Міністерство освіти і науки УкраїниКиївський національний університет будівництва і архітектуриКафедра товарознавства та комерційн
- Химический состав материалов: исследование влияния на качество потребительских товаров
Научная дисциплина, изучающая потребительные стоимости товаров, называется товароведением. Перед товароведением стоит задача изучен
- Технологія приготування батону пшеничного
Вищий навчальний закладХерсонський державний морський інститутПрофесійно-морський ліцейДИПЛОМНА РОБОТАтехнологія приготуванняба
- Харчові концентрати. М’ясні напівфабрикати
Міністерство освіти та науки УкраїниЖитомирський державний технологічний університетКафедра менеджментуКонтрольна роботаз курсу
- Хлебобулочные изделия
СодержаниеВведение. 31. Общие сведения о хлебе. 51.1. История хлеба ржано-пшеничного. 51.2. Пищевая ценность хлеба. 81.3. Сырьё, применяемое в хле
- Холодильное оборудование предприятий торговли и общественного питания
План контрольной работы1. Принципы сохранения пищевых продуктов2. Охлаждение продуктов животного происхождения3. Пароэжекторные и а
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

