Металлургия цветных металлов
Курсовая работа на тему:
Металлургия цветных металлов
Содержание
1. Введение
2. Описание технологии получения катодной меди
3. Выбор технологии плавки на штейне
4. Теоретические основы процесса Ванюкова
5. Расчет материального и теплового баланса
6. Заключение
Введение
Металлургия меди, а также других тяжелых цветных металлов является ведущим звеном отечественной цветной металлургии. На долю тяжелых цветных металлов в РФ приходится значительная часть валовой продукции отрасли.
Значение меди из года в год возрастает, особенно в связи с бурным развитием энергетики, электроники, машиностроения, авиационной, космической и атомной техники. Дальнейшее развитие и технический уровень медного и никелевого производств во многом определяют технический прогресс многих отраслей народного хозяйства нашей страны, в том числе микропроцессорной техники. Для получения меди используются всевозможные способы плавок, например, плавка медных концентратов в электрических, отражательных, шахтных печах, при использовании процесса конвертирования медных штейнов, благодаря автогенным плавкам во взвешенном состоянии, на штейне и др. На сегодняшний день существует несколько основных процессов автогенных плавок : процесс «Норанда», «Уоркра», «Мицубиси» и Ванюкова. К сожалению, разработка новый конструкций печей и различных процессов требует значительных капиталовложений, а свободный средств у Российских предприятий недостаточно. В данной курсовой работе будет рассмотрена технология А.В. Ванюкова или ПЖВ.
Технология получения катодной меди
Электролитическое рафинирование меди преследует две цели:
1) получение меди высокой чистоты (99,90—99,99% Си), удовлетворяющей требованиям большинства потребителей;
2) извлечение попутно с рафинированием благородных и других ценных компонентов (Se, Те, Ni, Bi и др.).
Следует отметить, что чем выше в исходной меди содержание благородных металлов, тем ниже будет себестоимость электролитной меди. Именно поэтому при конвертировании медных штейнов стремятся использовать в качестве флюса золотосодержащие кварциты.
Для осуществления электролитического рафинирования меди аноды, отлитые после огневого рафинирования, помещают в электролизные ванны, заполненные сернокислым электролитом. Между анодами в ваннах располагаются тонкие медные листы — катодные основы.
При включении ванн в сеть постоянного тока происходит электрохимическое растворение меди на аноде, перенос катионов через электролит и осаждение ее на катоде. Примеси меди при этом в основном распределяются между шламом (твердым осадком на дне ванн) и электролитом.
В результате электролитического рафинирования получают катодную медь; шлам, содержащий благородные металлы; селен;
теллур и загрязненный электролит, часть которого иногда используют для получения медного и никелевого купоросов. Кроме того, вследствие неполного электрохимического растворения анодов получают анодные остатки (анодный скрап).
Электролитическое рафинирование меди основано на различии ее электрохимических свойств и содержащихся в ней примесей. В таблице приведены нормальные электродные потенциалы меди и наиболее часто встречающихся в ней примесей.
Медь относится к группе электроположительных металлов, ее нормальный потенциал +0,34 В, что позволяет осуществлять процесс электролиза в водных растворах (обычно в сернокислых).
На катоде протекают те же электрохимические реакции, но в обратном направлении. Соотношение между одновалентной и двухвалентной медью в растворе определяется равновесием реакции диспропорционирования.
Следовательно, в состоянии равновесия концентрация в растворе ионов Сu+ примерно в тысячу раз меньше, чем концентрация ионов Си2+. Тем не менее реакция имеет существенное значение для электролиза. Она в частности определяет переход меди в шлам. В начальный момент вблизи анода в растворе соотношение двух- и одновалентной меди соответствует константе равновесия. Однако вследствие большего заряда и меньшего ионного радиуса скорость перемещения двухвалентных ионов к катоду превышает скорость переноса ионов одновалентных. В результате этого в прианодном слое концентрация ионов Си2+ становится выше равновесной и реакция начинает идти в сторону образования тонкого порошка меди, выпадающего в шлам.
Как указывалось выше, электролитическое рафинирование осуществляют в сернокислых растворах. Электроположительный потенциал меди позволяет выделить медь на катоде из кислых растворов без опасения выделения водорода. Введение в электролит наряду с медным купоросом свободной серной кислоты существенно повышает электропроводность раствора. Объясняется это большей подвижностью ионов водорода по сравнению с подвижностью крупных катионов и сложных анионных комплексов.
Для улучшения качества катодной поверхности в электролиты для рафинирования меди на всех заводах обязательно вводят разнообразные поверхностно-активные (коллоидные) добавки:
клей (чаще столярный), желатин, сульфитный щелок. В процессе электролиза на поверхности катода могут образовываться дендриты, что уменьшает в данном месте расстояние между катодом и анодом. Уменьшение межэлектродного расстояния ведет к уменьшению электрического сопротивления, а следовательно, к местному увеличению плотности тока. Последнее в свою очередь обусловливает ускоренное осаждение меди на дендрите и ускоренный его рост. Начавшийся рост дендрита в конечном итоге может привести к короткому замыканию между катодом и анодом. При наличии дендритов сильно развитая поверхность катода удерживает большое количество электролита и плохо промывается, что не только ухудшает качество товарных катодов, но и может вызвать брак катодной меди по составу. Одно из объяснений механизма действия поверхностно-активных веществ заключается в том, что они адсорбируются на наиболее активных частях поверхности и при этом вызывают местное повышение электрического сопротивления, что и препятствует росту дендрита. В результате поверхность катодов получается более ровной, а катодный осадок более плотным. После выравнивания катодной поверхности коллоидная добавка десорбирует в электролит.
Растворы коллоидных добавок непрерывно вводят в циркулирующий электролит. Вид и расход поверхностно-активных веществ различны для каждого предприятия. Обычно применяют одновременно две добавки. На 1 т получаемой катодной меди расходуют 15—40 г клея, 15—20 г желатина, 20—60 г сульфитных щелоков или 60—100 г тиомочевины.
Основными требованиями, предъявляемыми к электролиту, являются его высокая электропроводность (низкое электрическое сопротивление) и чистота. Однако реальные электролиты, помимо сульфата меди, серной кислоты, воды и необходимых добавок, обязательно содержат растворенные примеси, содержащиеся до этого в анодной- меди. Поведение примесей анодной меди при электролитическом рафинировании определяется их положением в ряду напряжений. По электрохимическим свойствам примеси можно разделить на четыре группы:
I группа — металлы более электроотрицательные, чем медь (Ni, Fe, Zn и др.);
II группа — металлы, близко стоящие в ряду напряжений к-меди (As, Sb, Bi);
III группа — металлы более электроположительные, чем медь (Au, Ag и платиноиды);
IV группа — электрохимически нейтральные в условиях рафинирования меди химические соединения (Cu2S, Cu2Se, Cu2Te, AuTe2, Ag2Te).
Примеси первой группы, обладающие наиболее электроотрицательным потенциалом, практически полностью переходят в электролит. Исключение составляет лишь никель, около 5% которого из анода осаждается в шлам в виде твердого раствора никеля в меди. Твердые растворы по закону Нернста становятся даже более электроположительными, чем медь, что и является причиной их перехода в шлам.
Особо по сравнению с перечисленными группами примесей-ведут себя свинец и олово, которые по электрохимическим свойствам относятся к примесям I группы, но по своему поведению в процессе электролиза могут быть отнесены к примесям III и IV групп. Свинец и олово образуют нерастворимые в сернокислом растворе сульфат свинца PbS04 и метаоловянную кислоту H2SnO3. Электроотрицательные примеси на катоде в условиях электролиза меди практически не осаждаются и постепенно накапливаются в электролите. При большой концентрации в электролите металлов первой группы электролиз может существенно расстроиться.
Накопление в электролите сульфатов железа, никеля и цинка снижает концентрацию в электролите сульфата меди. Кроме того, участие электроотрицательных металлов в переносе тока через электролит усиливает концентрационную поляризацию у катода.
Электроотрицательные металлы могут попадать в катодную медь в основном в виде межкристаллических включений . раствора или основных солей, особенно при их значительной концентрации в электролите. В практике электролитического рафинирования меди не рекомендуется допускать их концентрацию в растворе свыше следующих значений, г/л: 20 Ni; 25 Zn; 5 Fe.
Примеси II группы (As, Sb, Bi), имеющие близкие к меди электродные потенциалы, являются наиболее вредными с точки зрения возможности загрязнения катода. Будучи несколько более электроотрицательными по сравнению с медью, они полностью растворяются на аноде с образованием соответствующих сульфатов, которые накапливаются в электролите. Однако сульфаты этих примесей неустойчивы и в значительной степени подвергаются гидролизу, образуя основные соли (Sb и Bi) или мышьяковистую кислоту (As). Основные соли сурьмы образуют плавающие в электролите хлопья студенистых осадков («плавучий» шлам), которые захватывают частично и мышьяк.
В катодные осадки примеси мышьяка, сурьмы и висмута могут попадать как электрохимическим, так и механическим путем в результате адсорбции тонкодисперсных частичек «плавучего» шлама. Таким образом, примеси II группы распределяются между электролитом, катодной медью и шламом. Предельно допустимые концентрации примесей II группы в электролите составляют, г/л:
9 As; 5 Sb и 1,5 Bi.
Более электроположительные по сравнению с медью примеси (III группа), к которым относятся благородные металлы (главным образом, Au и Ag), в соответствии с положением в ряду напряжений должны переходить в шлам в виде тонкодисперсного остатка. Это подтверждается практикой электролитического рафинирования меди.
Переход золота в шлам составляет более 99,5% от его содержания в анодах, а серебра — более 98%. Несколько меньший переход серебра в шлам по сравнению с золотом связан с тем, что серебро способно в небольшом количестве растворяться в электролите и затем из раствора выделяться на катоде. Для уменьшения растворимости серебра и перевода его в шлам в состав электролита вводят небольшое количество иона хлора.
Несмотря на практически полный переход золота и серебра в шлам, они все же в небольшом количестве попадают в катодные осадки. Объясняется это механическим захватом взмученного шлама и отчасти явлением катофореза. На механический перенос шлама на катод влияют применяемая плотность тока и взаимосвязанная с ней скорость циркуляции электролита. С увеличением скорости циркуляции вследствие взмучивания шлама переход золота и серебра на катод возрастает. При выборе плотности тока и способа циркуляции электролита необходимо учитывать содержание благородных металлов в анодах. В случае их повышенного содержания плотность тока должна быть меньше. Снижению переноса шлама на катод способствует также наличие в ванне зоны отстаивания (область от нижнего конца катода до дна ванны). На многих заводах электролит перед его возвращением в ванну в цикле циркуляции подвергают фильтрованию, что уменьшает потери шлама и обеспечивает получение более чистой меди.
Аналогично электроположительным примесям ведут себя при электролизе меди химические соединения (примеси IV группы). Хотя в принципе химические соединения и могут окисляться на аноде и восстанавливаться на катоде, что используют в специальных процессах, в условиях электролитического рафинирования меди анодного потенциала недостаточно для их окисления. Поэтому при электролизе меди в электродных процессах они не участвуют и по мере растворения анода осыпаются на дно ванны. В виде селенидов и теллуридов переходят в шлам более чем 99% селена и теллура.
Таким образом, в результате электролитического рафинирования анодной меди все содержащиеся в ней примеси распределяются между катодной медью, электролитом и шламом'.
Основными характеристиками, определяющими параметры и показатели электролитического рафинирования меди, являются плотность тока, выход металла по току, напряжение на ванне, удельный расход электроэнергии.
Плотность тока является важнейшим параметром процесса электролиза. Она выражается в амперах на единицу поверхности электрода (D=I/S). В металлургии меди ее принято выражать в амперах на квадратный метр площади катодов. По закону Фарадея на каждый 1 А • ч электричества осаждается 1 электрохимический эквивалент металла. Для меди он равен 1,1857 г/А • ч. Следовательно, с увеличением плотности тока интенсивность (производительность) процесса электролиза возрастает. Величина плотности тока, при которой проводят процесс электролитического рафинирования, определяет все его основные технико-экономические показатели: напряжение на ванне, выход по току, расход электроэнергии, а также капитальные и эксплуатационные затраты. С увеличением плотности тока при прочих равных условиях увеличивается производительность цеха, уменьшаются число потребных ванн, затраты на капитальное строительство и рабочую силу, но возрастают затраты на электроэнергию. Следует отметить, однако, что с увеличением плотности тока увеличиваются потери благородных металлов за счет большего взмучивания шлама и захвата его растущим катодным осадком. В настоящее время применение особых режимов электролиза (реверсивного тока, измененной системы циркуляции электролита и др.) позволяет довести плотность тока до 500 А/м2 и более.
Электрохимический эквивалент меди составляет 1,1857 г/А • ч. Однако практически при электролизе для выделения 1 г-экв металла расходуется электричества больше. Это кажущееся противоречие объясняется тем, что часть электрического тока расходуется на побочные электрохимические процессы и утечку тока. Степень использования тока на основной электрохимический процесс называется выходом металла по току.
В практике электрометаллургии цветных металлов в большинстве случаев приходится иметь дело с катодным выходом по току, так как масса катодного осадка определяет конечный выход товарной продукции. Преднамеренный повышенный перевод меди в электролит за счет химического растворения часто обусловливают конъюнктурными соображениями. Избыточная медь может быть выделена из электролита в виде медного купороса при его регенерации. В тех случаях, когда потребность в медном купоросе, используемом в основном для борьбы с болезнями и вредителями сельскохозяйственных растений, очень велика (например, в НРБ), допускается работа электролизных цехов с повышенной температурой электролита.
Выбор технологии плавки на штейне
Почти столетие в металлургии меди и около полувека в металлургии никеля (в Канаде) «господствует» отражательная плавка. Свое широкое распространение она получила благодаря освоенности плавки применительно к переработке различных видов мелких рудных материалов, главным образом флотационных концентратов, простоте организации процесса почти в любых условиях металлургического производства. Основными причинами острой необходимости замены отражательной плавки стали высокие требования к предотвращению загрязнения окружающей среды выбросами оксидов серы. В условиях отражательной плавки, характеризующейся образованием огромных количеств очень бедных по SO2 газов, их обезвреживание требует больших капитальных затрат и обходится дорого в эксплуатации. В связи с этим, а также в связи с необходимостью активного использования теплотворной способности сульфидов и ряда других рассмотренных выше факторов были разработаны и освоены новые способы плавки медного сырья. Главным образом это — автогенные процессы, совмещающие в себе обжиг, плавку и конвертирование. В этих процессах большая часть серы переходит в отходящие газы с достаточно высоким и постоянным содержанием SO2.
Ниже приведены сравнительные основные технико-экономические показатели применяемых в настоящее время в медной промышленности пирометаллургических процессов.
Уже в начальной стадии освоения процесса плавки в жидкой ванне достигнута удельная производительность, превышающая более чем в 15 раз производительность отражательной печи при плавке сырой шихты, и в 6—8 раз производительность КВП и финской технологии. Возможно широкое управление составом штейна и получение на богатых штейнах относительно бедных отвальных шлаков.
Процесс характеризуется низким пылеуносом и получением возгонов, богатых по содержанию ценных компонентов. Для осуществления процесса создана надежная и долговечная аппаратура. Процесс не требует сложной подготовки сырья и пригоден для переработки как кусковой руды, так и концентратов различного состава. По своим показателям он превосходит все известные в мировой практике процессы. Процесс следует считать в основном освоенным и заслуживающим широкого и быстрого внедрения в отечественной медной и никелевой промышленности.
Помимо основного использования для плавки сульфидных концентратов на штейн, плавка в жидкой ванне пригодна для более широкого применения. При внедрении процесса в жидкой ванне необходимо учитывать его возможности, пути и направления развития, которые будут осуществляться уже в недалеком будущем.
К перспективным направлениям относятся прежде всего прямое получение черновой меди и глубокое обеднение шлаков, прямое получение медно-никелевого файнштейна, плавка коллективных медно-цинковых концентратов, комплексная переработка отвальных шлаков. Заслуживает внимания также использование принципов плавки в жидкой ванне для переработки окисленных никелевых и железных руд.
Сравнительные технико-экономические показатели некоторых видов плавки сульфидных медных концентратов
| Показатель | ПЖВ | КФП | Финская | КИ ВЦЭТ | Норанда | Мицубиси | Отражательная плавка сырой шихты |
Удельный проплав, т/(м2 • сут) | 60—80 | 10—13 | 9—12 | 3—5 | 10—11 | До 20 | 4—5 |
Содержание меди, %: в штейне | 45—55 | 37—40 | 60 | 40—50 | 70-75 | 65 | 20—30 |
в шлаке (без обед нения) | 0,5—0,6 | До 1,2 | 1—1,5 | 0,3—0,6 | 5 | 0,5 | 0,4—0,5 |
Содержание Si02 в шлаке, % | 30—32 | 28—34 | 29—30 | 30—34 | 22 | 30—35 | 34—42 |
| Влажность шихты, % | 6—8 | <1 | <1 | <1 | 10—13 | <1 | 6—8 |
Максимальная круп ность шихты, мм | До 50 | 0,1 | 0,1 | 0,1 | 10 | 1 | 5 |
| Пылевынос, % | 1 | 9—12 | 7—10 | — | 5 | 3—5 | 1—2 |
Содержание Оа в дутье, % | 60—65 | 95 | 35—40 | 95 | 26—28 | 45 | До 25 |
Содержание SOz в газах, % | 20—40 | 70—75 | 18—20 | 35—50 | 6—7 | 35 | 1—2 |
Расход условного топ лива, % | До 2 | До 2 | До 5 | 10—12 | 9—10 | 3—5 | 18—22 |
Процесс ПЖВ обеспечивает лучшую производительность среди всех типов процессов, превосходя их на десятки процентов. Содержание меди в штейне составляет порядка 45-55%, что является средним уровнем; в шлаке меди, фактически, минимальное количество, допустимое сегодняшними технологиями. Благодаря этому процессу достигается уверенное распределение 30% SiO2 в шлак. Процесс может перерабатывать достаточно крупную шихту, что снижает затраты на ее измельчение и обработку. Низкий расход топлива также вносит свою лепту в то, что технологический процесс А.В.Ванюкова один из лучших по своим технико-экономическим показателям.
Процесс плавки в жидкой ванне (ПЖВ)
Оригинальный процесс автогенной плавки сульфидных медных и медно-цинковых концентратов, названный авторами данной книги «плавкой в жидкой ванне», начал разрабатываться в Советском Союзе в 1951 г Дальнейшие разработка и внедрение до 1986 г. велись под общим научным руководством проф. А. В. Ванюкова.
Первые испытания этого метода плавки были проведены в лабораторных и заводских условиях в 1954—1956 гг. В настоящее время по методу плавки в жидкой ванне работают промышленные установки на медном заводе Норильского ГМК и Балхашском горнометаллургическом комбинате.
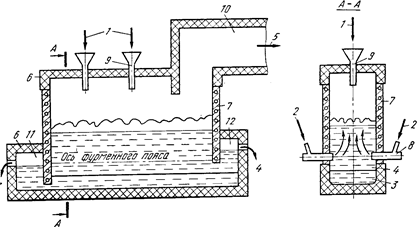
Схема печи для плавки в жидкой ванне:
1 — шихта; 2 — дутье; 3 — штейн; 4 — шлак; 5 — газы; 6 — кладка печи; 7 — медные литые кессоны; 8 — фурмы; 9 загрузочная воронка; 10 — аптейк; 11 — штейновый сифон; 12 шлаковый сифон
Процесс ПЖВ запатентован в ряде зарубежных стран. При разработке процесса плавки в жидкой ванне ставилась задача создания максимально благоприятных условий для протекания всех физико-химических процессов. Предложено несколько вариантов технологического и аппаратурного оформления процесса в зависимости от состава исходного сырья и конечных результатов его переработки. Рассмотрим работу плавильной печи для автогенной и полуавтогенной плавки сульфидных медных концентратов с получением богатого штейна. Для осуществления процесса плавки предложено использовать частично кессонированную печь шахтного типа. Оптимальная длина промышленных печей определяется потребной единичной мощностью агрегата, т. е. его абсолютной суточной производительностью, и может изменяться от 10 до 30 м и более. Ширина печей при этом с учетом возможностей дутьевого хозяйства и свойств расплавов составляет 2,5—3, высота шахты 6—6,5 м. Отличительной особенностью конструкции печи является высокое расположение дутьевых фурм над подом (1,5—2 м).
Содержание кислорода в дутье для обеспечения автогенного режима при плавке сухой шихты с влажностью менее 1—2% составляет 40—45%, влажной (6—8% влаги) 55—65%. В печи можно плавить как мелкие материалы, так и кусковую шихту. Крупную и влажную шихту загружают непосредственно на поверхность расплава. При необходимости сухие мелкие и пылевидные материалы могут вдуваться через фурмы. Таким образом, плавление шихты и окисление сульфидов в процессе ПЖВ осуществляются непосредственно в слое расплава.
Шлак и штейн выпускаются раздельно из нижней части ванны с помощью сифонов.
Характерной особенностью плавки в жидкой ванне, отличающей ее от всех рассмотренных ранее процессов, является то, что плавление и окисление сульфидов осуществляются в ванне шлака, а не штейна, и шлак движется в печи не в горизонтальном направлении, как это имеет место во всех известных процессах плавки, а в вертикальном — сверху вниз.
Горизонтальной плоскостью по осям фурм расплав в печи делится на две зоны: верхнюю надфурменную (барботируемую) и нижнюю подфурменную, где расплав находится в относительно спокойном состоянии.
В надфурменной зоне осуществляются плавление, растворение тугоплавких составляющих шихты, окисление сульфидов и укрупнение мелких сульфидных частиц. Крупные капли сульфидов быстро оседают в слое шлака, многократно промывая шлак за время его движения сверху вниз в подфурменной зоне. При непрерывном осуществлении процесса устанавливается динамическое равновесие между количеством поступающих с загрузкой мелких сульфидных частиц, скоростью их укрупнения и отделения от шлака. В результате одновременного протекания этих процессов устанавливается постоянное содержание сульфидов (капель) в шлаке, лежащее на уровне 5—10% от массы расплава. Таким образом, все процессы в надфурменной области протекают в шлако-штейновой эмульсии, в которой преобладает шлак.
Окисление сульфидов, как известно, является очень быстрым процессом и обычно не ограничивает конечную производительность агрегатов. В производственных процессах желательно не только не повышать, но даже замедлять скорость окисления сульфидов. Действительно, большие скорости окисления сульфидов, например при продувке жидких сульфидов кислородом, приводят к чрезмерному повышению температуры в области фурм.
Окисление сульфидов в шлако-штейновой эмульсии протекает менее интенсивно, чем в сульфидном расплаве, фокус горения растягивается, что позволяет избежать локального повышения температуры в области фурм даже при использовании чистого кислорода. Это в свою очередь облегчает задачу создания надежной и долговечной аппаратуры. При этом скорость окисления остается достаточно высокой и степень использования кислорода на окисление сульфидов практически равна 100% при любом необходимом его количестве, подаваемом в расплав. Таким образом, и при окислении сульфидов в шлако-штейновой эмульсии скорость их окисления не лимитирует производительности агрегата. Возможность интенсивного окисления сульфидов в шлако-штейновой эмульсии без большого локального повышения температуры в области фурм является важным достоинством плавки в жидкой ванне.
Окисление сульфидов в шлако-штейновой эмульсии представляет собой сложный многостадийный процесс, состоящий из окисления капелек штейна, окисления растворенных в шлаке сульфидов, окисления FeO шлака до магнетита и окисления сульфидов магнетитом. Таким образом, шлак также является передатчиком кислорода. По последним данным, наибольшее значение имеет стадия окисления сульфидов, растворенных в шлаке.
Характерная особенность окисления сульфидов в шлако-штейновой эмульсии состоит в том, что оно не сопровождается образованием первичных железистых шлаков и выпадением мелких сульфидных частиц. Оксиды, образующиеся на поверхности сульфидных капель, немедленно растворяются в шлаке конечного состава.
Отсутствие условий для образования значительных количеств мелкой сульфидной взвеси является важным достоинством плавки в жидкой ванне, создающим предпосылки для получения бедных отвальных шлаков.
Высокая степень использования кислорода обеспечивает простое управление составом штейна и соотношением количеств подаваемого через фурму кислорода и загружаемых за то же время концентратов. Состав штейна можно регулировать в широком диапазоне вплоть до получения белого матта или даже черновой меди. Напомним, что потери меди со шлаком начинают резко возрастать, когда ее содержание в штейне превысит 60%. Поэтому при плавке на штейн, если в технологической схеме не предусматривается специальное обеднение шлака, увеличивать содержание меди в штейне свыше 50—55% нецелесообразно. При получении белого матта или черновой меди в технологическую схему должна обязательно включаться операция обеднения шлаков.
Растворение тугоплавких составляющих шихты является одним из относительно медленных процессов. Энергичный барботаж ванны резко ускоряет процесс растворения кварца и компонентов пустой породы, что позволяет использовать даже сравнительно крупные флюсы. Промышленные испытания показали, что при крупности кварца около 50 мм скорость его растворения не влияет на производительность печи, по крайней мере, вплоть до удельного проплава, равного 80 т/(м2 • сут). Высокая скорость растворения тугоплавких составляющих является важной особенностью плавки в жидкой ванне.
Минимальное содержание магнетита в шлаках — обязательное условие совершенного плавильного процесса. Как уже говорилось, с увеличением содержания магнетита резко возрастает содержание растворенной меди в шлаках. Кроме того, повышение содержания магнетита (степени окисленности системы) приводит к снижению межфазного натяжения на границе раздела штейна и шлака.
ИСХОДНЫЕ ДАННЫЕ РАСЧЕТОВ
| 1. Производство по влажному концентрату | т/час | 80 | |
| 2. Состав концентрата | % | ||
| Cu | 17 | ||
| Fe | 28 | ||
| S | 36 | ||
| SiO2 | 5 | ||
| CaO | 3 | ||
| MgO | 0 | ||
| Al2O3 | 0 | ||
| Zn | 6 | ||
| Pb | 2 | ||
| 3. Влажность | 5 | ||
| 4. Обогащение дутья | 85 | ||
| 5. Содержание меди в штейне | 45 | ||
| 6. Извлечение меди в штейн | 97 | ||
| 7. Выход в штейн | |||
| Pb | 20 | ||
| Zn | 35 | ||
| 8. Выход в газ | |||
| Pb | 22 | ||
| Zn | 12 | ||
| 9. Состав кварцевого флюса | |||
| Si02 | 70 | ||
| Влажн. | 6 | ||
| 10. Состав шлака | |||
| Si02 | 33 | ||
| Ca0 | 6 | ||
| 11. Подача конверторного шлака | Т/час | 10 | |
| 12. Температура конверторного шлака | C | 1200 | |
| 13. Температура продуктов | C | 1250 | |
| 14. Состав топлива | % | ||
| CH4 | 0 | ||
| C | 95 | ||
| Влажн. | 6 | ||
| 15. Тепло сгорания природного газа | Ккал/м3 | 0 |
85% концентрата меди в виде халькопирита. Извлечение Cu из конверторного шлака – 80%. Состав конверторного шлака : Cu – 3%, Fe – 52%, SiO2 – 24%/
Содержание прочих в штейне – 1%.
Содержание O2 в техническом кислороде 96% (остальное N2)
Концентрация магнетита в конверторном шлаке – 30%.
![]()
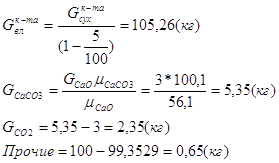
![]()
Расчет основных сульфидных минералов

Дополним систему еще одним уравнением:
![]()
![]()
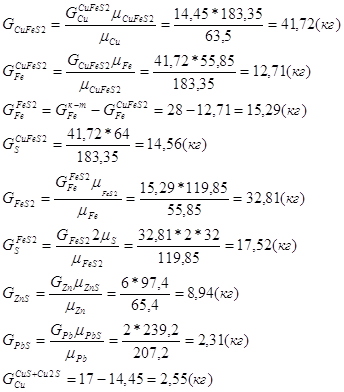
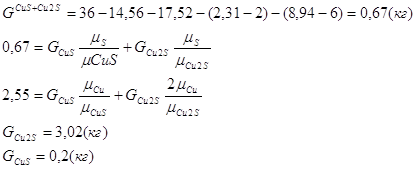
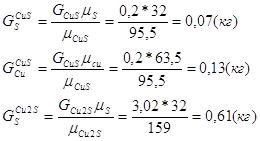
![]()
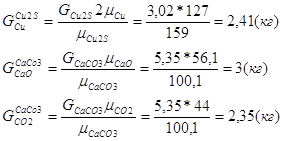
Таблица рационального состава концентрата
| CuFeS2 | CuS | Cu2S | FeS2 | ZnS | PbS | CaCO3 | MgCO3 | SiO2 | Al2O3 | Проч. | Всего | |
| Cu | 14,45 | 0,13 | 2,41 | - | - | - | - | - | - | - | - | 17 |
| Fe | 12,71 | - | - | 15,29 | - | - | - | - | - | - | - | 28 |
| S | 14,56 | 0,07 | 0,61 | 17,52 | 2,94 | 0,31 | - | - | - | - | - | 36 |
| Zn | - | - | - | - | 6 | - | - | - | - | - | - | 6 |
| Pb | - | - | - | - | - | 2 | - | - | - | - | - | 2 |
| SiO2 | - | - | - | - | - | - | - | - | 5 | - | - | 5 |
| CaO | - | - | - | - | - | - | 3 | - | - | - | - | 3 |
| CO2 | - | - | - | - | - | - | 2,35 | - | - | - | - | 2,35 |
| Проч. | - | - | - | - | - | - | - | - | - | - | 0,65 | 0,65 |
| Всего | 41,72 | 0,2 | 3,02 | 32,81 | 8,94 | 2,31 | 5,35 | - | 5 | - | 0,65 | 100 |
Расчет состава конверторного шлака
Исходные данные:
Cu – 3%
Fe – 52%
SiO2 – 24%
Fe3O4 – 30%
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Непрерывное литье заготовок
Идея непрерывного литья была выдвинута в середине XIX в. Г. Бессемером, который предлагал разливать жидкую сталь между двумя водоохлажда
- Определение и обоснование видов и режимов структурной обработки сплава Cu+2,3%Be
В данной работе производится выбор видов и режимов структурной обработки. Ее сущность заключается в том, что в результате направленного
- Производство Алюминия
Одна весьма сомнительная легенда рассказывает, что однажды к римскому императору Тиберию (42 г. до н. э. — 37 г. н. э.) пришел человек с мета
- Сау нагревом возухонагревателя доменной печи
1 Доменное производство.Чугун выплавляют в шахтных печах. Процесс доменной плавки непрерывный. Сверху в печь загружают сырые материалы (
- Специальные способы резки
Содержание:Сущность и основные условия резкиКислородно-флюсовая резкаГазо-дуговая резкаВоздушно-дуговая резкаПлазменно-дуговая резк
- Шпоры по материаловедению_2
Влияние Si: повышает s и уменьшает способность вытяжки.Влияние Mn:повышает прочность, не снижая пластичности, снижает крсноломкость и вред
- Электрометаллургия
Производство стали в электрических печах. В электоропечи можно получать легированную сталь с низким содержанием серы и фосфора, немета
Copyright © https://www.referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

