Кислотно-основное состояние черноземов выщелоченных при длительном использовании в пашне северной лесостепи южного Зауралья
Министерство сельского хозяйства РОССИЙСКОЙ Федерации
Институт агроэкологии - филиал фгоу впо
«челябинский государственный агроинженерный университет»
ФакультетАгрономический
Кафедра Растениеводства, земледелия, плодоовощеводства
Выпускная квалификационная работа
Кислотно-Основное состояние черноземов выщелоченых при длительном использовании в пашне северной лесостепи южного зауралья.
2009
РЕФЕРАТ
Дипломная работа на тему «Кислотно-основное состояние черноземов выщелоченых при длительном использовании в пашне северной лесостепи южного Зауралья» содержит 55 страницы машинописного текста, 11 таблиц, 2 рисунка. Библиографический список – 29 источников. Рассмотрены морфологические признаки, физические, водные и агрохимические свойства черноземов выщелоченных на пашне. Выявлено что действие минеральных удобрений, вносимых в течение 35 лет в рекомендованных дозах, проявилось лишь в повышении гидролитической кислотности среднесуглинистого выщелоченного чернозема южной лесостепи, причем только в самом верхнем слое (0-10 см) и нижнем (20-30 см) пахотного горизонта.
Наиболее экономически эффективным является отвальная обработка почвы на глубину 0-10см.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ4
1. Литературный обзор
2. Природно-климатические условия исследования
2.1 Агроклиматические условия
2.2 Почвенный покров
3 Программа исследования
3.1 Место и время исследования
3.2 Почва опытного поля
3.3 Погодные условия в период исследований
4 Результаты исследований
4.1 Водная и солевая кислотность почвы
4.2 Гидролитическая кислотность почвы
4.3 Почвенно-экологическая и экономическая оценка чернозема выщелоченного
5 Безопасность жизнедеятельности
5.1 Охрана труда
5.1.1 Требование безопасности в агрохимической лаборатории
5.2 Охрана природы
Выводы
Список литературы
Приложение А
Введение
Как бы не развивались наука и техника, благополучие человека, его здоровье и питание зависят от земли. Она снабжает растения питательными элементами и влагой, содействует их росту, развитию и продуктивности, т.е. обладает плодородием. Многие особенности поведения элементов в почве обуславливает их кислотно-основное состояние. С ним связаны режимы органического вещества и элементов минерального питания растений, подвижность соединений, в том числе токсичных. Реакция почвенного раствора оказывает и прямое действие на культуры.
Негативное влияние повышенной кислотности на растения проявляется через недостаток кальция, повышенную концентрацию токсичных для растений ионов Al3+, Mn2+, Н+, изменение доступности для растений элементов питания, ухудшение физических свойств почвы, снижение ее биологической активности. В кислых почвах повышается растворимость соединений Fe, Mn, Al, B, Cu, Zn, избыток которых снижает продуктивность растений. Высокая кислотность снижает доступность молибдена. Усвояемость фосфора максимальна при рН 6,5, в более кислой и более щелочной среде она снижается. Кислая среда ухудшает азотный режим почвы, угнетая процессы аммонификации, нитрификации, азотфиксации. Для этих процессов оптимум рН лежит в интервале 6,5-8,0. Особо негативную роль в кислых почвах играет алюминий. При рН 4 его содержание в растворенном виде достигает токсичных концентраций для большинства растений. Примерно то же при низких рН происходит с марганцем.
На щелочных почвах возникает дефицит некоторых микроэлементов (Zn, Fe, Mn, Cu). При высокой щелочности ухудшаются физические свойства почв. Сильнощелочная реакция неблагоприятна для большинства растений (Агроэкологическая оценка…,2005)
Мнения же о том, какое влияние на кислотно-основное состояние почвы оказывают те или иные системы земледелия, в том числе способы ее обработки довольно противоречивы.
Цель работы выявить кислотно-основное состояние среднесуглинистых выщелоченных черноземов южной лесостепи Зауралья при длительном их использовании в пашне.
Задачи, поставленные при выполнении данной работы:
1 Выявить влияние уровня интенсификации земледелия и способов обработки почвы на ее водную и солевую кислотность;
2 Установить гидролитическую кислотность почвы в связи с длительным применением различных способов ее обработки на разных фонах удобренности.
Руководитель дипломной работы зав кафедрой семеноводства, доктор сельскохозяйственных наук М.А. Глухих.
Исполнитель Сафин Д.Н.
1. Литературный обзор
Для построения технологии возделывания любой культуры, особенно применения удобрений, необходимо не только учитывать потребности растений в элементах питания, но и знать химический состав и биологические, физико-химические и химические свойства почвы, которые определяют уровень ее плодородия, условия питания растений и характер превращения в ней удобрений (1).
Всестороннее и глубокое изучение природы почвенной кислотности и механизма реакций, вызывающих подкисление, необходимо для выяснения чувствительности почв к кислотным воздействиям, для дальнейшего развития теоретических и практических основ химической мелиорации почв.
Значительная часть закономерностей уже известна из работ, обосновывающих и развивающих исследования по данному кругу вопросов, но решение многих частных вопросов и более точная оценка взаимодействий являются задачами дальнейших научных исследований (2).
Реакция почвы проявляется при ее взаимодействии с водой или растворами солей и определяется соотношением свободных ионов Н+ и ОН- в почвенном растворе. Концентрация свободных ионов Н+ выражается величиной рН, представляющей отрицательный логарифм концентрации ионов водорода; рН равная 7 характеризует нейтральную реакцию, рН менее 7 – кислую и рН более 7 – щелочную.
Реакция почвенного раствора в различных почвах колеблется от рН 3,5 до 8-9 и выше. Наиболее кислую реакцию имеют болотные почвы верховых торфяников. Кислой реакцией почвенного раствора характеризуются подзолистые и дерново-подзолистые почвы (рН 4-6). Черноземы имеют реакцию, близкую к нейтральной. Наиболее щелочная реакция у солончаков, особенно содовых (рН 8-9 и выше). Нейтральная реакция характерна для почв, не содержащих карбонатов, почвенно-поглощающий комплекс (ППК) которых полностью насыщен кальцием и магнием. Эта реакция наиболее благоприятна для развития большинства культурных растений и бактерий. Кислая реакция является следствием развития в почве кислотности, щелочная реакция – следствие щелочности почвы (3).
Кислотность почвы – способность почвы подкислять воду и растворы нейтральных солей. Различают актуальную и потенциальную кислотность. Актуальной кислотностью называется кислотность почвенного раствора. Потенциальная кислотность характерна для твердой фазы почвы (3, 4). Между актуальной и потенциальной кислотностью в почве сохраняется подвижное равновесие, но доминирующее значение во всех почвах имеет кислотность твердой фазы почвы.
Актуальная кислотность почвенного раствора зависит от наличия в нем свободных кислот, кислых солей и степени их диссоциации. В почвенном растворе свободные минеральные кислоты в заметных количествах встречаются очень редко. В большинстве почв актуальная кислотность обусловлена угольной кислотой и ее кислыми солями (3).
Потенциальная кислотность (кислотность твердой фазы) имеет сложную природу. Ее носителем являются обменные катионы Н+ и Аl3+ почвенных коллоидов. В литературе длительное время проходила дискуссия о природе кислотности твердой фазы почвы. К.К. Гедройц, Д.Н. Прянишников и ряд других исследователей считали, что кислотность обусловлена ионами водорода, а алюминий появляется в растворе в результате побочных реакций. Г. Дайкухара и В.А. Чернов показали, что алюминий действительно является носителем кислотности твердой фазы почвы. В настоящее время доказано, что как обменные ионы Н+, так и ионы Аl3+ являются причиной потенциальной кислотности почвы, так как при взаимодействии почвы с растворами солей эти катионы вытесняются в раствор и подкисляют его (5, 6, 7):
(ППК-) H+ + KCl![]() (ППК-) K+ + HCl;
(ППК-) K+ + HCl;
(ППК-) Al3+ + 3KCl![]() (ППК-) 3K+ + AlCl3.
(ППК-) 3K+ + AlCl3.
Образующаяся в растворе соль хлористого алюминия относится к категории гидролитически кислых солей и в водном растворе расщепляется на кислоту и основание:
AlCl3 + 3H2O![]() Al(OH)3 + 3HCl.
Al(OH)3 + 3HCl.
В гумусовых горизонтах наибольшее значение в формировании кислотности принадлежит иону водорода, а в минеральных горизонтах – алюминию. Источником обменного иона водорода являются органические кислоты, образующиеся при разложении и гумификации органических остатков, а также угольная кислота. При взаимодействии с почвой, насыщенной основаниями, водород этих кислот внедряется в диффузный слой почвенных коллоидов:
(ППК-) Ca2+ + R(COOH)2![]() (ППК-) 2H+ + R(COO)2Ca;
(ППК-) 2H+ + R(COO)2Ca;
(ППК-) Ca2+ + H2CO3![]() (ППК-) 2H+ + CaCO3.
(ППК-) 2H+ + CaCO3.
Источником обменного алюминия следует считать алюминий кристаллической решетки глинистых минералов и несиликатные формы гидроокиси алюминия, мобилизуемые органическими кислотами и также внедряющиеся в диффузный слой почвенных коллоидов.
В зависимости от характера вытеснения различают две формы потенциальной кислотности – обменную и гидролитическую. Обменная кислотность проявляется при обработке почвы раствором нейтральной соли:
(ППК-) 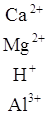 + 4KCl
+ 4KCl ![]() (ППК-)
(ППК-) 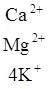 + HCl + AlCl3.
+ HCl + AlCl3.
Образующаяся в результате взаимодействия солевого раствора с почвой и гидролитического расщепления соляная кислота характеризует обменную кислотность. Величина обменной кислотности выражается в миллиграмм-эквивалентах Н+ и Аl3+, количество которых определяется методом титрования, или величиной рН солевой вытяжки, полученной при обработке почвы раствором нейтральной соли (3, 8).
Гидролитическая кислотность определяется как общая кислотность почвы, включающая в себя актуальную, обменную и «собственно» гидролитическую. Она значительно больше обменной и выражается в миллиграмм-эквивалентах на 100 г почвы. В отсутствие актуальной и обменной видов «собственно» гидролитическая кислотность не вредна для растений и микроорганизмов. Это наблюдается во всех черноземах, кроме южных (9).
С гидролитической кислотностью приходится встречаться чаще, чем с обменной, она свойственна большинству почв, даже черноземам. Эта кислотность включает менее подвижную часть поглощенных ионов Н+, труднее обменивающихся на катионы почвенного раствора. Определять ее необходимо для решения ряда практических вопросов применения удобрений – установления норм извести и возможности эффективного применения фосфоритной муки. При обработке почвы раствором уксуснокислого натрия в раствор переходят все содержащиеся в почве ионы водорода (и алюминия), т. е. определяется сумма всех видов кислотности (актуальная, обменная и гидролитическая). Чтобы определить величину собственно гидролитической кислотности, необходимо из общего показателя вычесть величину обменной кислотности. Обычно этого не делают и термином «гидролитическая кислотность» обозначают общую кислотность почвы, выражая ее в мг-экв на 100 г почвы.
Еще в начале XX века некоторые исследователи (Вейч в США, Дайкухара в Японии и, несколько позже, Каппен в Германии) обратили внимание на то, что в нейтрально солевых вытяжках из кислых почв присутствует Аl, и приняли за причину обменной кислотности наличие Аl среди поглощенных катионов почвы. Как уже указывалось выше, реакция нейтральной соли с кислой почвой, содержащей Аl на поверхности коллоидных частиц, представляется в следующем виде:
АlСl являясь гидролитически кислой солью, подкисляет раствор:
АlСl3 +3Н2О → Аl(ОН)3+3НCl.
Мера подкисления определяется титрованием:
АlСl3+NaОН → Аl(ОН)3 + 3NаСl.
Иное представление о природе почвенной кислотности поддерживалось К.К. Гедройцем, который считал причиной кислотности наличие в почве обменного Н+. Возражая Дайкухара и Каппепу, К.К. Гедройц (1930) объяснял появление Аl в фильтрате вторичной реакцией между НСl (продуктом взаимодействия кислой, т, е. содержащей обменный Н-ион почвой и нейтральной солью) и основными формами Аl твердой фазы почвы, легко вступающими в реакцию.
Взгляды Гедройца на вторичное происхождение Аl при взаимодействии почв с растворами нейтральных солей разделяли многие крупные исследователи в области химии почвы (Вигнер, 1930; Гиссинк, 1925 и др.). В дальнейшем к ним присоединился и Каппен (1929).
Представление о наличии водородного иона среди обменных катионов подтверждалось рядом явлений. Прежде всего, водородный ион, постоянно появляющийся в почве (в результате биологических процессов образования угольной кислоты, азотной кислоты, органических кислот), служит несомненным первичным фактором подкисления. Значение его усиливается тем, что протон (ион Н+) обладает наибольшей из всех ионов подвижностью и высокой способностью адсорбироваться. Во многих кислых почвах, прежде всего в почвах или почвенных горизонтах, богатых органическим веществом, в большинстве случаев отсутствует эквивалентность между кислотностью и количеством Аl в растворе: кислотность этих почв, определяемая титрованием вытяжек, больше, чем количество Аl, найденное в вытяжках. Суспензии кислых почв в исследованиях Раис и Осуги (1918) вызывают инверсию сахара, что считалось доказательством наличия в них Н, являющихся катализаторами реакции инверсии. Все эти (и некоторые другие) факты привели в 30-х годах исследователей в области химии почвы к сравнительно единодушному представлению о наличии Н+-иона па поверхности почвенных частиц, как об единственной причине обменной кислотности.
Сравнивая поглощение Аl из 0,05 н. растворов: 1) АlСl3; 2) АlСl3, нейтрализованного на 1/3 NаОН, т. е. содержащего Аl(ОН)2+, и 3) АlСl3, нейтрализованного на 2/3 NаОН, т. е. содержащего Аl(ОН)+2,– Чернов обнаружил еще более высокую адсорбционную способность у основных форм алюминия по сравнению с трехвалентными ионами. Видимо, решающую роль здесь играет слабая диссоциированность соединений, которые образуют ионы, включающие Аl, с ионами потенциал-определяющего слоя. Вторым моментом, подкрепляющим точку зрения Чернова, является эквивалентность между титрирной кислотностью КCl – вытяжек из кислых почв и содержанием Аl в этих вытяжках (за отмеченными выше исключениями: лесной подстилки; торфянистых почв; верхних горизонтов подзолистых почв). При обмене же равновалентных ионов разведение не влияет на количество адсорбированных ионов. Чернов использовал это положение для суждения о том, Н+ или Аl3+ обмениваются. с К+ солевого раствора при определении кислотности. В его опытах разведение раствора КCl приводило к резкому снижению величины определяемой кислотности, что принималось за подтверждение участия в обмене Аl-иоиов.
Однако все данные В. А. Чернова относятся к вытяжкам из почв и не являются прямым доказательством присутствия Аl среди обменных катионов. Работы В.А. Чернова вызвали оживленную дискуссию (Аскинази, Карпинский и Ремезов, 1955; Ярусов и Соколова, 1950; Моисеев, 1954). Доказательства присутствия Аl среди обменных катионов были получены лишь в самые последние годы в опытах, проводившихся с использованием обмеппо-способных смол. В опытах Харуорд и Колеман ( 1954) катионит насыщался в одном случае Аl путем промывания раствором АlСl3, в другом случае – Н-ноном путем промывания нормальным раствором НCl. Поскольку катионит представляет собой органическое вещество, появление Аl при промывке его НCl невозможно. С этими двумя образцами смол сравнивались по теплоте нейтрализации образцы различно подготовленных глин. Глина, промытая 1 н. НCl или пропущенная через колонку Н+-смолы, показала ту же величину теплоты нейтрализации, что и Н+-смола, т. е. оказалась насыщенной Н+-ионом.
Выше указывалось, что почвенная кислотность оказывает отрицательное влияние па развитие растений; при этом Аl оказывает гораздо более резкое токсическое действие па растения, чем Н. В опытах С.С. Ярусова и М.Ф. Соколовой (1950) при доведении почв, насыщенных ионами водорода или алюминия до одинаковой реакции (рН), горчица сильнее страдала от кислотности на почвах, насыщенных ионами алюминия. Поданным Е.Б. Дьяковой (1948), при содержании в почве 6-8 мг подвижного Аl на 100 г почвы клевер испытывает значительное угнетение. При повышении содержания подвижного Аl до 10-12 мг на 100 г почвы клевер страдает очень сильно и выпадает.
Различают актуальную и потенциальную щелочность. Актуальная щелочность обусловливается наличием в почвенном растворе гидролитически щелочных солей (Na2CO3, NaHCO3, Са(НСО3)2 и др.), которые при диссоциации определяют преобладающую концентрацию гидроксид-ионов.
При определении актуальной щелочности различают общую щелочность, щелочность от нормальных карбонатов и от бикарбонатов. Щелочность от нормальных карбонатов может проявляться как в результате обменных реакций почв, содержащих поглощенный натрий, так и вследствие жизнедеятельности сульфатредуцирующих бактерий, восстанавливающих в анаэробных условиях и в присутствии органического вещества сернокислые соли натрия с образованием соды:
Na2SO4 + 2С = 2СО2 + Na2S; Na2S + CO2 + Н2О = Na2CO3 + H2S.
Потенциальная щелочность обнаруживается у почв, содержащих поглощенный натрий. Щелочность почвенного раствора характеризуется в миллиграмм-эквивалентах кислоты, необходимой для нейтрализации ионов ОН- раствора, обусловленных ионами НСО3- (щелочность бикарбонатов), СО32- (щелочность нормальных карбонатов) или их суммой (общая щелочность) (3, 10).
Реакция почвенного раствора наряду с величинами обменной и гидролитической кислотности зависит от емкости поглощения и степени насыщенности почвы основаниями. Степень насыщенности почвы основаниями – второй важный показатель нуждаемости почв в известковании. Чем он ниже, тем выше нуждаемость и наоборот. Емкость поглощения катионов почвой – это максимальное количество обменных катионов, которые могут быть поглощены почвой. Ее выражают в миллиграмм-эквивалентах на 100 г почвы (мг-экв/100 г). Чем выше емкость катионного обмена (ЕКО) почвы, тем экономически выгоднее и экологически безопаснее разовое (запасное, периодическое) внесение больших доз удобрений и мелиорантов под культуры. Чем ниже ЕКО, тем острее необходимость дробного внесения небольшими дозами удобрений и мелиорантов под те же культуры (3, 9).
ЕКО и состав поглощенных катионов играют огромную, если не решающую, роль в питании растений и превращении удобрений. Они определяют реакцию и буферные свойства твердой и жидкой фаз ее, а также катионно-анионный состав и концентрацию почвенного раствора и, следовательно, обусловливают выбор вида, дозы, формы, срока и способа внесения удобрений и мелиорантов для возделываемых культур на каждой конкретной почве.
Состав и количество поглощенных катионов влияют на дисперсность ППК и, следовательно, на свойства почвы, питание растений и трансформацию удобрений и мелиорантов.
При подкислении почвы коагулирующее действие катионов усиливается, при подщелачивании – ослабевает, а одновалентные катионы в щелочной среде не вызывают коагуляции коллоидов. Катионы кальция осаждают коллоиды даже в щелочной среде, а магния занимают промежуточное положение между одновалентными и кальцием. Содержание в ППК одновалентных щелочных катионов калия, и особенно натрия, более 3-5 % ЕКО и увеличение количества их сильно диспергируют коллоидную и предколлоидную фракции, резко ухудшают свойства щелочных почв и, следовательно, питание растений. Значительное содержание в ППК обменно-поглощенных катионов водорода, алюминия, железа и марганца (подзолистые и болотные почвы, желтоземы, красноземы) также ухудшает многие свойства кислых почв. Поглощенный катион водорода постепенно разрушает минералы ППК, что приводит к ухудшению структуры почвы, обеднению ее коллоидной фракцией и, следовательно, снижению ЕКО (9).
Реакция почвенного раствора может изменяться вследствие накопления кислых продуктов разложения органических остатков, под влиянием выделения корнями растений углекислоты и протонов, образования азотной кислоты при нитрифицирующей деятельности микроорганизмов, при внесении физиологически кислых или физиологически щелочных минеральных удобрений. При этом изменение реакции на разных почвах будет неодинаково. На одних действие подкисляющих или подщелачивающих веществ будет проявляться больше, на других меньше вследствие разной буферной способности почв (3).
Буферной способностью, или буферностыо, называют способность почвы противостоять изменению реакции почвенного раствора при добавлении кислоты или основания (3, 10, 11, 12).
Различают буферную способность почв против изменения реакции в сторону подкисления и буферную способность против изменения реакции в сторону подщелачивания. Буферность зависит от химического состава и емкости поглощения почвы, состава поглощенных катионов и свойств почвенного раствора. Она обеспечивается способностью различных химических соединений почвенного раствора, как участвовать в различных реакциях, так и выполнять сходные функции в различных условиях (13).
По мнению И.С. Кауричева (1982), буферные свойства почвенного раствора связаны главным образом с буферностью твердой фазы почвы, с которой раствор находится в постоянном взаимодействии. Важнейшую роль при этом играют содержание свободных карбонатов, а также количество и состав обменных катионов. Буферность почвенного раствора обусловлена также присутствием в нем буферных систем, представленных смесью слабых кислот и их солей. Наибольшее значение в буферных свойствах почвенного раствора имеет система H2CO3 + Ca (HCO3)2 (3). С.Е. Иванова и соавторы (1996) считают, что большую роль в создании буферности играют растворимые органические вещества, которыми могут являться наиболее подвижная фракция органических кислот – фульвокислоты, неспецифические органические кислоты и их соли (14). О.Н. Козлова (1999) утверждает, что главными буферными комплексами, обеспечивающими устойчивость почвы в целом, являются тонкодисперсные фракции минеральных горизонтов, так как они обладают высокой удельной поверхностью и химически активны (15).
Буферность почвы характеризуется количеством миллилитров кислоты или щелочи, которое необходимо прибавить, чтобы изменить концентрацию протонов в почвенном растворе. Обычно буферность почвы выражают графически с помощью кривых титрования: на графике наносят кривую титрования чистого кварцевого песка, лишенного всякой буферной способности, и кривую титрования исследуемой почвы. Чем резче кривая титрования почвы отстает от кривой титрования песка, тем больше ее буферная способность (12, 16). Кривая буферности графически выражает изменение рН почвенной суспензии при добавлении к почве кислоты или щелочи. Буферность почвы выражается также буферной площадью – площадью между кривой титрования почвы и песка. Эта площадь делится на две части – для кислотной и щелочной областей (11, 17). Для черноземов буферная площадь, как в кислой, так и в щелочной области примерно в 2-3 раза больше, чем для подзолистых почв (3).
Буферность природных почв в их естественном залегании отличается от буферности отдельных проб почвы, которую находят в лабораторных условиях. Почва динамична, а проба почвы мертва, статична. В природных условиях буферность характеризует способность почв не только противостоять изменению рН при добавлении кислоты или основания, но и восстанавливать прежнее значение рН во времени (11).
В поддержании стабильной реакции почв участвуют различные механизмы буферности. В почвах всегда происходят различные реакции с присоединением и сдачей протонов, т. е. встречаются различные буферные кислотно-щелочные системы. Поскольку части буферных систем проявляют свое действие самостоятельно или дополняя друг друга, выявить, оценить частное явление буферности весьма трудно.
Наиболее важными почвенными компонентами и реакциями с буферным действием, по мнению Д. Филеп и М. Редли (2), являются: а) присоединение и отдача протонов почвенными коллоидами (глинистыми минералами; органическими коллоидами; гидроксидами металлов, гидратированными металлическими окислами и гелями кремниевой кислоты); б) образование – растворение легковыветриваемых минералов; в) преобразование полимеров гидроксидов алюминия и/или алюминиевых гидроксокомплексов; г) образование – декомплексация органических металлических комплексов; д) система СаСО3 – Са(НСО3)2 – СО2.
Поведение коллоидов в значительной мере зависит от того, в каком количестве и соотношении встречаются на их поверхности перманентные (постоянные) и переменные (зависящие от рН) заряды. Перманентные заряды создаются при изоморфном замещении в процессе образования и преобразования глинистых минералов. При этом в тетраэдрах SiO4, центральные ионы Si4+ частично могут заменяться Аl3+, а ионы Аl3+ могут быть замещены ионами Mg2+ или Fe2+. Таким образом, часть отрицательных зарядов ионов О2- и Н-, составляющих кристаллическую решетку, остается некомпенсированной. Напротив, переменные заряды способны к присоединению и отдаче протонов, образуя в момент отдачи протонов радикалы с характером слабой кислоты. При увеличении рН или концентрации солей поверхностный переменный заряд увеличивается, при подкислении или разбавлении раствора уменьшается. Оба типа зарядов связывают металлические катионы электростатически – в обменной форме. Ионы Н+ присоединяются к радикалам, несущим переменный заряд, прочной ковалентной связью, а протоны встраиваются в поверхность (специфическая адсорбция). Перманентные заряды подобно одновалентным металлическим катионам связывают протоны почвенного раствора гораздо слабее – только электростатически и исключительно в форме Н3О+.
Многокомпонентную коллоидную фракцию почвы можно считать поверхностью со смешанным зарядом. Для оценки обменных реакций в таких системах с успехом используется упрощенная коллоидная модель, предложенная Д. Филеп:
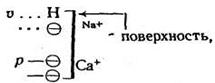
где ![]() – переменные заряды; р – перманентные заряды.
– переменные заряды; р – перманентные заряды.
При увеличении концентрации Н+ в почвенном растворе (подкислении) по причине специфического связывания протонов поверхностный заряд и способность связывания катионов уменьшается и часть металлических ионов, присоединенных к переменным зарядам, попадает в раствор
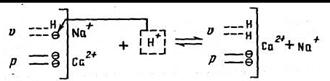
Если реакция среды почвенного раствора сдвигается в сторону подщелачивания, реакция, характеризуемая данным уравнением, идет в обратную сторону. Тогда ионы Н+ срываются со специфических мест связи, вследствие чего поверхностный заряд и емкость катионного обмена почв увеличиваются. Такие буферные реакции почвенных коллоидов быстрые и обычно обратимые.
Образование и растворение минералов протекают относительно медленно. Для растворения необходим избыток протонов, а образование сопровождается освобождением протонов. Во время разрушения минерала благодаря связыванию протонов освобождаются Аl3+ и другие катионы.
Отдача и присоединение протонов гидрокомплексами алюминия и полимерами гидроксидов алюминия. Если концентрация Н+ в почвенном растворе возрастает до такой степени, что рН становится больше либо равно 5, то из силикатной решетки растворяется большое количество алюминия и в водном растворе появляются ионы гексаква-алюминия (Аl(Н2О)6)3+, которые стабильны только в сильнокислой среде. Если рН несколько выше, чем это требуется для поддержания гексаква-ионов, из водных молекул гидратной сферы выделяются протоны и появляются ионы гидроксо-комплекса алюминия:
(Аl(Н2О)6)3+![]() (Аl(Н2О)6ОН)2+ = Н+
(Аl(Н2О)6ОН)2+ = Н+ ![]() (Аl(Н2О)4(ОН)2)+ + Н+.
(Аl(Н2О)4(ОН)2)+ + Н+.
Эта система ведет себя как кислотно-щелочной буфер. В более щелочной среде гидроксокомплексы полимеризуются, затем полимеры присоединяются к глинистым минералам и нейтрализуют часть перманентных зарядов. При дальнейшем подщелачивании положительный заряд полимеров постепенно уменьшается и блокированные места зарядов снова освобождаются. Под влиянием кислоты (в результате присоединения протона) заряд полимера, или свободный заряд, приходящийся на один ион алюминия, возрастает, а в сильнокислой среде соединение (Аl(Н2О)6)3+ деполимеризуется до аквакомплексионов.
Образование и разрушение органических металлических комплексов сопровождается переходом протона:
Мz+ + HzL ![]() ML + zH+,
ML + zH+,
где L – комплексообразующий лиганд.
В насыщенных почвах преобладают Са- и Mg-комплексы, в кислых почвах – Al-комплексы.
Буферное влияние системы СаСО3–Са(НСО3)2–СО2–Н2О. Реакцию среды системы регулирует равновесие реакции
СаСО3 + (H+ + HCO-3) ![]() Са(НСО3)2
Са(НСО3)2 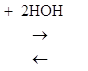 Ca2++ 2ОН- + Н2СО3
Ca2++ 2ОН- + Н2СО3
Соответственно этому в карбонатных почвах растворение СаСО3 снижает прибавку Н+, а образование (выпадение в осадок) СаСО3 – избыток ОН-.
То, в какой области рН наиболее эффективна та или другая буферная система, определяется постоянной диссоциацией протонированной формы функциональных групп, ведущих себя как слабые кислоты. Чем слабее кислота, чем сильнее связывает протоны протонированная форма, тем при более высоких значениях рН вступает в действие система. В различных фазах подкисления или подщелачивания – в зависимости от содержания коллоидов, их качества и насыщенности – в почве получают ведущую роль те или другие буферные системы (2, 12).
Б. Ульрихом (1980, 1983, 1986) разработана концепция буферных зон почв, в соответствии с которой те или иные компоненты почвы ответственны за создание буферности почвы, к кислоте в разных диапазонах значений рН, причем в пределах каждого диапазона ведущая роль принадлежит только одной буферной реакции.
Карбонатная буферная зона имеет значение только в почвах, содержащих карбонаты, и соответственно имеющих рН более 6,2. Основной буферной реакцией является растворение карбонатов.
Силикатная буферная зона играет наибольшую роль в диапазоне значений рН от 5,0 до 6,2. Основным механизмом буферности является замещение протонов щелочных и щелочноземельных металлов, входящих в кристаллическую решетку минералов. Буферная емкость в пределах этой зоны зависит от минералогического состава почвы, который определяет содержание оснований.
Ионообменная буферная зона соответствует диапазону значений рН от 4,2 до 5,0. Основной буферной реакцией является вытеснение кальция протоном из почвенного поглощающего комплекса. Прогрессивное подкисление вызывает переход почвы в состояние, соответствующее следующей – алюминиевой – буферной зоне.
Алюминиевая буферная зона соответствует диапазону значений рН 4,2-3,2. Основной буферной реакцией является освобождение алюминия из глинистых силикатов.
Железистая буферная зона характеризуется очень низкими значениями рН (менее 3,2), при которых начинается растворение гидроксидов железа, которое является основной буферной реакцией (18).
Буферность и буферные свойства почв заключают в себе определенную, притом немалую, информацию о процессах почвообразования, которую можно использовать при решении вопросов диагностики и классификации почв. Информация об устойчивости почв относительно подкисления и подщелачивания может служить в качестве теоретической основы при решении общеэкологических задач и многих практических вопросов химизации земледелия (19).
2 Природно-климатические условия исследования
2.1 Агроклиматические условия
По биоклиматическим показателям территория Челябинской области подразделяется на подзоны: горно-лесная зона, северная лесостепь, южная лесостепь, степь; в Курганской отсутствует горно-лесная. Южная лесостепная подзона – это Агаповский, Верхнеуральский Еткульский, Троицкий и Увельский районы Челябинской области; Альменевский, Сафакулевский, Кетовский, Юргамышский районы. Расположена она также в пределах зауральского пенеплена Западно-Сибирской низменности и имеет типичный равнинный характер(20).
Южная лесостепная почвенно-климатическая подзона характеризуется относительно большим количеством тепла и явным дефицитом влаги.
Сумма эффективных температур более 10 °C составляет 2000-2150 °С. Этот уровень теплообеспеченности наступает 5-8 мая, заканчивается 19 сентября, то есть период активной вегетации растений продолжается 130-135 дней. Весной заморозки прекращаются обычно 17-20 мая, осенью случаются в третьей декаде августа. Такой температурный режим позволяет выращивать не только зерновые, но и многие другие, более теплолюбивые культуры.
По количеству атмосферных осадков южная лесостепь значительно уступает северной и тем более горно-лесной зоне. Здесь за вегетационный период их выпадает 190-225 мм. Гидротермический коэффициент (по Селянинову) не превышает 0,9-1,0, запасы влаги в почве к началу сева яровых зерновых бывают недостаточные – 115-135 мм в метровом слое, или 45-60 % от потребности сельскохозяйственных культур. Засуха и суховеи в районах южной лесостепи бывают практически ежегодно. Наиболее засушливый месяц – июнь. В этих условиях эффективное ведение земледелия возможно только при применении агротехнических приемов по накоплению, сохранению и экономичному использованию влаги.
Устойчивый снежный покров формируется в первой декаде ноября и сохраняется в течение 145-150 дней. Высота его увеличивается медленно. В начале декабря снежный покров достигает 10 см, в январе 15-20 см и только к концу февраля 30-40 см. При сильных морозах, достигающих в январе – 44-48 °С, почва глубоко (до 150-170 см) и сильно промерзает, а весной поздно оттаивает.
2.2 Почвенный покров
Южная лесостепь расположена в пределах зауральского пенеплена Западно-Сибирской низменности. Рельеф зоны типично равнинный.
В почвенном покрове преобладают черноземы выщелоченные, на долю которых приходится 34,8 % общей площади, 46 % пашни и 45,9 % сельхозугодий. Второе место занимают черноземы обыкновенные, распространение которых характеризуется соответственно такими показателями: 21,3, 30,7 и 26,7 %.
Большие площади занимают солонцы – 14,9 % общей площади, 12,2 % пахотных земель и 19,5 % сельхозугодий. более 3 % от площади почвенного покрова, 2,2 % пашни и 2,4 % естественных сельхозугодий приходится на серые лесные осолоделые почвы (21).
Чернозёмные почвы в лесостепной зоне представлены оподзоленными, выщелоченными и типичными черноземами.
Среди черноземных почв в каждой подзоне развиты их полугидроморфные аналоги – лугово-черноземные почвы. Они формируются в условиях повышенного увлажнения за счет временного скопления вод поверхностного стока при глубоких грунтовых водах или за счет относительно неглубоких грунтовых вод.
Профиль лугово-черноземных почв морфологически в основных чертах близок к профилю черноземов. Однако особые гидрологические условия придают ему и ряд специфических признаков: более интенсивная (обычно черная) окраска верхней части гумусового профиля, некоторая растянутость гумусового слоя и глееватость нижних горизонтов. Профиль лугово-чер
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- Классификация лесных насаждений по устойчивости
Под устойчивостью лесных насаждений следует понимать наличие у них лесобиологических свойств противостоять неблагоприятным условиям
- Клиническое исследование животного
Министерство сельского хозяйства РФДепартамент научно-технической политики и образованияФГОУ ВПО "САНКТ-ПЕТЕРБУРГСКАЯ ГОСУДАРСТВЕНН
- Клиническое исследование животного
УГАВМКурсовая работана тему: «Клиническое исследование животного»1.1. Регистрация.Вид: крупный рогатый скотПол: короваИнвентарный но
- Клиническое исследование коровы
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВАРОССИЙСКОЙ ФЕДЕРАЦИИФГОУ ВПО «Санкт-Петербургская государственная академия ветеринарной медицины»К
- Клініко-морфологічна діагностика та розповсюдження лейкозу великої рогатої худоби у СВК "Ружинський" Ружинського району Житомирської області
ДИПЛОМНА РОБОТАНА ТЕМУ: «Клініко-морфологічна діагностика та розповсюдження лейкозу великої рогатої худоби у СВК «Ружинський» Ружинсь
- Конституция и экстерьер крупного рогатого скота комбинированного направления
В решении проблемы повсеместного перехода к интенсивным методам ведения животноводства и значительного повышения продуктивности имею
- Кооперация сельских товаропроизводителей в сфере производственного обслуживания
ГЛАВА 10. КООПЕРАЦИЯ СЕЛЬСКИХ ТОВАРОПРОИЗВОДИТЕЛЕЙ В СФЕРЕ ПРОИЗВОДСТВЕННОГО ОБСЛУЖИВАНИЯI.Общие методические положенияПереход сельск
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

