Квантово-механічна теорія будови речовини
Тема
КВАНТОВО-МЕХАНІЧНА ТЕОРІЯ БУДОВИ РЕЧОВИНИ
Квантово-механічна теорія виникла на початку ХХ ст., коли було встановлено, що атом подільний, і за елементарні частинки було прийнято електрон і ядро. Зараз вважається, що межею поділу речовини є елементарні частки: електрони, протони, нейрони і інші.
Атомами називаються найбільш прості електронейтральні системи, які складаються з елементарних частинок. Завдяки сучасним дослідженням відкрито понад 200 різних елементарних частинок. Атом хімічного елементу є носієм його хімічних властивостей. Він складається з ядра, яке включає протони і нейтрони, і електронів, що розподіляються навколо ядра. Атоми бувають стійкими і радіоактивними, які з часом перетворюються в інші атоми в результаті змін, що проходять у ядрі. Число електронів в атомі дорівнює заряду ядра. При видаленні з атома одного або декількох електронів утворюється позитивно заряджений іон, а при приєднанні до атома електрону утворюється негативно заряджений іон. Хімічний елемент – це сукупність атомів з одинаковим зарядом ядра. Порядковий номер елементу в Періодичниій системі дорівнює заряду ядра атома елементу.
Розміри та маси атомів
Число Авогадро NA показує число молекул в 1 моль будь-якої індивідуальної речовини і не залежить від природи речовини і її агрегатного стану. NA = 6,02296 · 1023 молекул в 1 моль речовини:
NA = ![]() = 6,02296 · 1023 часток
= 6,02296 · 1023 часток
Якщо два атоми, що утворюють молекулу, одинакові (наприклад, Н2, Сl), то половину міжатомної віддалі, на якій вони знаходяться в молекулі, приймають за радіус атома. Для наближеної оцінки радіуса атома можна скористатись питомою вагою простих речовин. Нехай, наприклад, потрібно визначити радіус атома міді. Металева мідь має густину рівну 8,9 г/см3, атомна маса міді рівна 63,5 г/моль. Тоді можна визначити число атомів міді в 1 см3:
NCu = ![]() · 6,022 · 1023 = 0,85 · 1023
· 6,022 · 1023 = 0,85 · 1023
Об’єм, що припадає на один атом міді, рівний оберненому значенню цієї величини:
![]() = ≈10–23
= ≈10–23
Приймаючи, що цей об’єм відповідає кулі радіусом r, знаходимо:
![]() pr3 = 10–23;
pr3 = 10–23;
r3 = 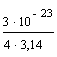 = 0,239 · 1023;
= 0,239 · 1023; ![]() 1,3 · 10–8 см
1,3 · 10–8 см
В дійсності радіус атома міді визначений точними методами (рентгеноструктурний аналіз) рівний 1,28 · 10–8 см. Це свідчить про те, що розміри атомів мають порядок ~10–8 см (1Å). В теперішній час в атомній фізиці користуються нанометром (1 нм = 10–9 м = 10Å).
Якщо атом, взаємодіючи з іншими атомами, втрачає або приєднує електрони, то його радіус відповідно може зменшуватись або зростати.
Для розрахунку середньої маси атомів або молекул в грамах необхідно масу 1 моля атомів даного елемента, або молярну масу речовини поділити на число Авогадро. Наприклад, для визначення маси молекули азоту (N2) маємо: 28,0134 : 6,02 · 1023 = 4,653 · 10–23 г; маса молекули (атома) гелію (Не): 4,0023 : 6,02 · 1023 = 4,649 · 10–24 г; маса атома хлору (Сl): 35,453 : 6,02 · 1023 = 5,889 · 10–23 г.
Молярну масу газоподібної речовини можна визначити за відносною густиною газу (D) – безрозмірна величина, яка показує, у скільки разів густина газу більша або менша густини стандартного газу при тих же умовах і в тому ж об’ємі. Молярна маса газу рівна його густині по відношенню до іншого газу помноженому на молярну масу другого (стандартного) газу. Наприклад:
М = ![]() ·
· ![]() =
= ![]() · 2,016
· 2,016
Молярну масу газоподібної речовини можна визначити виходячи з молярного об’єму газу (22,414 л/моль), знаючи масу і об’єм газу при н.у:
М = 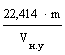
Якщо відома молекулярна маса простих газоподібних речовин (Н2, Cl2, O2, N2), то враховуючи двохатомний склад їх молекул можна безпосередньо визначити атомну масу хімічних елементів:
Аr = ![]() Mr.
Mr.
Атомну масу елементів можна визначити кількома методами:
1. За правилом П. Дюлонге і А. Пилс (1819 р.). Добуток атомної маси на питому теплоємність простих речовин у твердому стані приблизно рівний 26 Дж/моль·К.
2. Метод Каніцаро (1865 р.). Спочатку по густині пару (газу) визначали молекулярні маси можливо більшої кількості газоподібних або летких сполук даного елемента. Потім за результатами їх аналізу визначають, скільки одиниць маси припадає на долю цього елемента в молекулярній масі кожної із взятих сполук. Найменше з одержаних чисел приймали за атомну масу. Наприклад: візьмемо чотири газоподібні речовини з вмістом карбону:
СН4, С2Н6, С3Н8, СО.
1. Визначимо молярні маси газів: 16 30 44 28.
2. Визначимо масову густину карбону у молекулах газоподібних речовин (%): 78 80 81,82 42,86.
3. Визначимо масу карбону в усіх сполуках: 12 24 36 12.
4. Найменше значення маси елементу приймаємо за атомну масу
| № п/п | Формула сполуки | М, г/моль | ω (с), % | m (c) |
| 1. | CH4 | 16 | 75 | 12 |
| 2. | C2H6 | 30 | 80 | 24 |
| 3. | C3H8 | 44 | 81,82 | 36 |
| 4. | CO | 28 | 42,86 | 12 |
Категории:
- Астрономии
- Банковскому делу
- ОБЖ
- Биологии
- Бухучету и аудиту
- Военному делу
- Географии
- Праву
- Гражданскому праву
- Иностранным языкам
- Истории
- Коммуникации и связи
- Информатике
- Культурологии
- Литературе
- Маркетингу
- Математике
- Медицине
- Международным отношениям
- Менеджменту
- Педагогике
- Политологии
- Психологии
- Радиоэлектронике
- Религии и мифологии
- Сельскому хозяйству
- Социологии
- Строительству
- Технике
- Транспорту
- Туризму
- Физике
- Физкультуре
- Философии
- Химии
- Экологии
- Экономике
- Кулинарии
Подобное:
- О тепловизорах
Успехи, достигнутые за последнюю четверть века в освоении инфракрасного диапазона электромагнитного спектра, привели к созданию разн
- Проектирование отопительно-производственной котельной сельскохозяйственного назначения
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВАРОССИЙСКОЙ ФЕДЕРАЦИИФГОУ ВПО "Башкирский государственный аграрныйуниверситет"Факультет: Энергетич
- Электрооборудование подстанций
1. Перечислите и опишите объем послеремонтных испытаний трехфазного трансформатора, автотрансформатораПосле окончания сборки трансф
- Солнечная батарея
МОУ «Лицей №43»Естественно- техническийРЕФЕРАТСолнечная батареяСаранск2010Солнце разлито поровну.Вернее, по справедливости,Вернее, по
- Расчет трансформатора ТМ1000/35
Федеральное агентство по образованию РФГОУ ВПО УГТУ – УПИкафедра «Электрические машины»Курсовая работаРасчёт трансформатора ТМ 1000
- Электроснабжение агломерационной фабрики металлургического комбината
АннотацияЦелью данного дипломного проекта является электроснабжение агломерационной фабрики металлургического комбината. Содержани
- Основные научные и мировоззренческие идеи А. Эйнштейна
Альберт Эйнштейн родился в Швейцарии, в небогатой еврейской семье, которая жила вначале в Швейцарии, затем в Германии. В 1933 г. (в Германи
Copyright © https://referat-web.com/. All Rights Reserved
 referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.
referat-web.com Бесплатно скачать - рефераты, курсовые, контрольные. Большая база работ.

